
4140
.pdf11
Составляем электронные уравнения, то есть, изображаем процессы окисления и восстановления. Наименьшее общее кратное для отданных и принятых электронов равно 10. Подбираем коэффициенты для окислителя и восстановителя:
S-2 – 2 |
ē → S0 |
| |
| 5 – процесс окисления, S-2 – восстановитель, |
|
|
| 10 | |
|
Mn+7 + |
5 ē → Mn+2 |
| |
| 2 – процесс восстановления, Mn+7 – окислитель. |
5 S-2 + 2 Mn+7 → 5 S0 +2 Mn+2
Переносим полученные коэффициенты в молекулярное уравнение:
5 H2S + 2 KMnO4 + H2SO4 → 5 S + 2 MnSO4 + K2SO4 + H2 O.
Находим коэффициенты для других реагирующих веществ методом простого подбора, уравнивая сначала металлы (в данном примере К и Mn уже уравнены). Затем уравниваем неметаллы (атомов S в левой части уравнения 6, в правой – 8, следовательно, перед формулой серной кислоты надо поставить коэффициент 3). Последними обычно уравнивают атомы водорода:
5 H2S + 2 KMnO4 + 3 H2SO4 → 5 S + 2 MnSO4 + K2SO4 + 8 H2 O.
Проверяем по кислороду: в левой и правой частях по 20 атомов О.
Вывод: реакция уравнена.
ПРИМЕР 6:
Уравнять окислительно-восстановительную реакцию термического разложения хлората калия и назвать тип реакции
KСlO3 → KСlО2 + KСlO4
Решение. Определяем степени окисления всех элементов в исходных и конечных веществах и находим элементы, которые изменяют степень окисления
K+1Сl+5 О-23 → K+1Сl+3О-22 + K+1Сl+7 О-24
Выражаем электронными уравнениями процессы принятия и отдачи электронов

|
|
|
|
12 |
Сl+5 |
– 2 ē → Сl+7 |
| |
| |
1 – процесс окисления, Сl+5 – восстановитель, |
Сl+5 |
+ 2 ē → Сl+3 |
| 2 |
| |
1 – процесс восстановления, Сl+5 – окислитель. |
| |
| |
Так как коэффициенты перед окислителем и восстановителем равны 1, их в уравнение реакции не ставят. Однако следует обратить внимание, что Сl+5 участвует в двух процессах: окисления и восстановления. Поэтому перед веществом KсlO3 ставим коэффициент 2.
2 KСlO3 → KСlО2 + KСlO4
Подсчитываем в левой и правой частях уравнения атомы К, Cl и О. Реакция уравнена.
Так как окисляются и восстанавливаются одинаковые ионы (Сl+5), тип данной реакции – диспропорционирование.
Задания для самостоятельного решения Пользуясь методом электронного баланса, уравняйте следующие реак-
ции, определите окислитель и восстановитель, а также назовите тип окис- лительно-восстановительной реакции:
а) Cl2 + H2O → HclO + HCl ;
б) NaNO3 → NaNO2 + O2 ;
в) H2S + H2SO4 → S + H2O ;
г) MnO2+ KNO3 + KOH → K2MnO4 + KNO2 + H2O ;
д) PH3 + HNO3 → H3PO4 + NO2+ H2O ;
е) KBr + H2SO4 → Br2 + SO2 + H2O + KHSO4;
ж) K2Cr2O7 + HCl → CrCl3 + Cl2 + H2O + KCl.
13
Метод полуреакций (электронно-ионный метод)
Этот метод более сложен и используется в случае протекания реакции в растворах. Метод полуреакций основан на составлении уравнений для процесссов окисления и восстановления реально существующих ионов с последующим их суммированием в общее уравнение. Ионы, которые не изменяются в ходе реакции, в уравнениях полуреакций не рассматриваются.
Достоинства метода:
В электронно-ионных уравнениях записываются ионы, реально существующие в водном растворе, а не условные частицы (например, ионы NO–2 , а не N+3; ионы SO2–4 , а не S+6).
При использовании этого метода не нужно знать все вещества, они определяются при выводе уравнения реакции.
Видна роль среды как активного участника всего процесса.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде). В ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду частицы:
H+ – кислая среда, OH– – щелочная среда,
H2O – нейтральная среда.
Алгоритм действий при уравнивании реакции
Найти окислитель и восстановитель.
Определить, какие ионы реально существуют в растворе.
Записать полуреакции окисления и восстановления.
Сбалансировать число атомов в каждой, добавляя Н+ или Н2О – в кислой среде, ОН– или Н2О – в щелочной среде (см. таблицу 3).
Уравнять количество электронов (зарядов).
Суммировать полуреакции в полное электронно-ионное уравнение (электроны сокращаются).
Записать уравнение в молекулярном виде с коэффициентами.
14
Таблица 3
Баланс атомов кислорода в ОВР в зависимости от реакции среды
Число атомов |
Кислая |
Нейтральная |
Щелочная |
|
кислорода |
среда |
среда |
среда |
|
в исходных |
Н+, Н2О |
Н2О |
ОН–, Н2О |
|
веществах |
||||
|
|
|
||
Избыточное |
|
|
|
|
(надо связать |
О2– + 2Н+ → Н2О |
О2– + Н2О → 2ОН– |
О2– + Н2О → 2ОН– |
|
избыток) |
|
|
|
|
Недостаточное |
|
|
|
|
(надо восполнить |
Н2О → О2– + 2Н+ |
Н2О → О2– + 2Н+ |
2ОН– → О2– + Н2О |
|
недостаток) |
|
|
|
Для уравнивания кислорода в ионно-молекулярных полуреакциях используют молекулы H2O, катионы H+ в кислой среде, гидроксид-ионы OH– в щелочной среде.
Правило кислой среды: в ту часть полуреакции, где не хватает кислорода, на каждый недостающий кислород добавляется по одной молекуле H2O, а в противоположную часть – необходимое для уравнивания водорода число катионов H+.
Правило щелочной среды: в ту часть полуреакции, где не хватает кислорода, на каждый недостающий кислород добавляется по два гидроксид-иона OH–, а в противоположную часть – необходимое для уравнивания водорода число молекул H2O.
В нейтральной среде в зависимости от продуктов реакции используется или правило кислой среды, или правило щелочной среды.
ПРИМЕР 7: Расставить коэффициенты методом полуреакций в уравнении реакции
KmnO4 + HCl MnCl2 + KCl + Cl2 + H2O
1.Записываем схему реакции с указанием степеней окисления элементов
ивыделяем элементы, изменяющие свои степени окисления:
 .
.

15
2. Приводим эту схему в ионно-молекулярной форме, чтобы определить реальные частицы, существующие в растворе
.
3. Выписываем частицы, в состав которых входят элементы, изменяющие свои степени окисления
 .
.
4. Чтобы получить полуреакции, следует соблюдать баланс по числу атомов каждого элемента. Поскольку в данном примере среда кислая, для уравнивания полуреакций пользуются правилом кислой среды. В первой полуреакции в правой части не хватает четыре атома кислорода, следовательно, в эту часть записываем четыре молекулы воды. Для баланса по водороду в левую часть добавляют восемь катионов водорода. Во второй полуреакции уравнивают только число атомов хлора
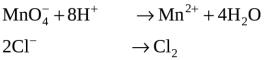 .
.
5. Определяем суммарные заряды в левых и правых частях полуреакций и добавлением или вычитанием электронов уравниваем заряды
MnO–4 + 8H+ + 5ē = Mn2+ + 4H2O
2Cl– – 2ē = Cl2.
6. Устанавливаем дополнительные множители для окислителя и восстановителя на основании того, что число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем. Первую полуреакцию умножаем на два, вторую – на пять, складываем правые и левые части полуреакций, в результате чего получаем
.
7. Записываем окончательное уравнение в молекулярной форме
16
 .
.
ПРИМЕР 8: Расставить коэффициенты методом полуреакций в уравнении реакции
Na2SO3 + H2O + Cl2 Na2SO4 + HCl.
1.Записываем схему реакции с указанием степеней окисления элементов
ивыделяем элементы, изменяющие свои степени окисления
Na+2S+4О-23 + H+2O-2 + Cl02 Na+2S+6O2–4 + H+Cl– .
2. Приводим эту схему в ионно-молекулярной форме, чтобы определить реальные частицы, существующие в растворе
2Na+ + SO3-2 + H2O + Cl2 2Na+ + SO42– + H+ + Cl– .
Участие в реакции ионов H+ говорит о том, что процесс протекает в кислой среде.
3. Полуреакции имеют вид
SO3-2 SO42–
Cl2 2Cl– .
Так как среда кислая, то ионно-молекулярное уравнение полуреакции имеет вид (см. табл. 3)
SO3-2 + H2O SO42– + 2H+ .
4. Составляем электронно-ионные уравнения полуреакций. Для этого в левую часть каждой полуреакции добавляем или вычитаем такое число электронов, чтобы суммарный заряд в обеих частях уравнений стал одинаковым. Получаем
SO32– + H2O – 2ē SO42– + 2H+ |
– процесс окисления |
Cl20 + 2ē 2Cl– |
– процесс восстановления |
5. В данном случае баланс по электронам есть. Поэтому суммируем элек- тронно-ионные уравнения
SO32– + H2O – 2ē + Cl20 + 2ē SO42– + 2H+ + 2Cl– .
17
6. Сокращаем подобные члены и получаем ионно-молекулярное уравнение окислительно-восстановительной реакции
SO32– + H2O + Cl20 SO42– + 2H+ + 2Cl– .
7. По полученному ионно-молекулярному уравнению окислительновосстановительной реакции составляем молекулярное уравнение.
Na2SO3 + H2O + Cl2 Na2SO4 + 2HCl.
Направление протекания ОВР в зависимости от различных факторов
Реакция между окислителем и восстановителем может протекать различно в зависимости от следующих факторов:
температуры;
реакции среды (рН);
природы реагирующих веществ;
концентрации реагентов.
ПРИМЕРЫ.
(В данных примерах приведены схемы реакций. Студенту предлагается самостоятельно уравнять реакции).
а) В зависимости от температуры термическое разложение хлората калия протекает различно
КClO3 |
КClО4 + КCl |
(4000 C) |
КClO3 |
КCl + O2 |
(2000 C) |
б) В кислой, нейтральной и щелочной среде перманганат калия и сульфит натрия реагируют различно
KMnO4 + Na2SO3 |
+ H2SO4 = MnSO4 |
+ Na2SO4 |
+ K2SO4 + H2O |
|
KMnO4 |
+ Na2SO3 |
+ H2O = MnO2 + Na2SO4 + KOH |
||
KMnO4 |
+ Na2SO3 |
+ KOH = K2MnO4 |
+ Na2SO4 |
+ H2O |
18
в) Взаимодействие металлов с кислотами протекает различно в зависимости от
природы кислоты
Zn + HCl ZnCl2 + H2
Zn + HNO3 Zn(NO3)2 + H2O + NO
г) Концентрация кислоты влияет на взаимодействие ее с металлами
H2SO4 (разб) + Zn ZnSO4 + H2
H2SO4 (конц) + Zn ZnSO4 + H2О + H2S
Взаимодействие металлов с кислотами
(Все приводимые ниже реакции даны в виде схем. Студентам следует их уравнять)
Продукты взаимодействия металлов с кислотами определяются несколькими факторами: природой и концентрацией кислоты, природой металла, температурой.
Все кислоты (кроме азотной и концентрированной серной!) реагируют с металлами, стоящими в ряду активности до водорода, при этом из растворов кислот вытесняется газообразный водород. Окислителем является катион Н+.
HCl + Zn ZnCl2 + H2
HCl + Cu (реакция не идет)
Серная кислота разбавленная подчиняется этому же правилу, то есть в реакциях с металлами окислителем также является катион Н+
H2SO4 (разб) + Ni NiSO4 + H2
H2SO4 (разб) + Cu (реакция не идет)

19
Серная кислота концентрированная с металлами реагирует по-
другому. Окислителем является ион SO42– (S+6). Продукты восстановления серной кислоты определяются активностью взаимодействующих с ней металлов (см. табл. 4). Ряд активности металлов условно разбит на четыре группы.
Таблица 4
I |
II |
|
III |
IV |
|
|
|
|
|
А к т и в н ы е |
Средней активности |
|
Н е а к т и в н ы е |
|
|
|
|
|
|
Li Cs Rb K Ba Sr Ca Na Mg Be Al Mn Zn |
Cr Fe Cd Co Ni Sn Pb |
Н |
Sb Bi Cu Ag Hg |
Pt Au |
|
|
|
|
|
Схемы процессов взаимодействия серной кислоты с металлами (Ме) можно представить следующим образом
Исключением из приведенной схемы являются Al, Cr, Fe, которые не реагируют без нагревания с H2SO4 (конц) ввиду пассивации.
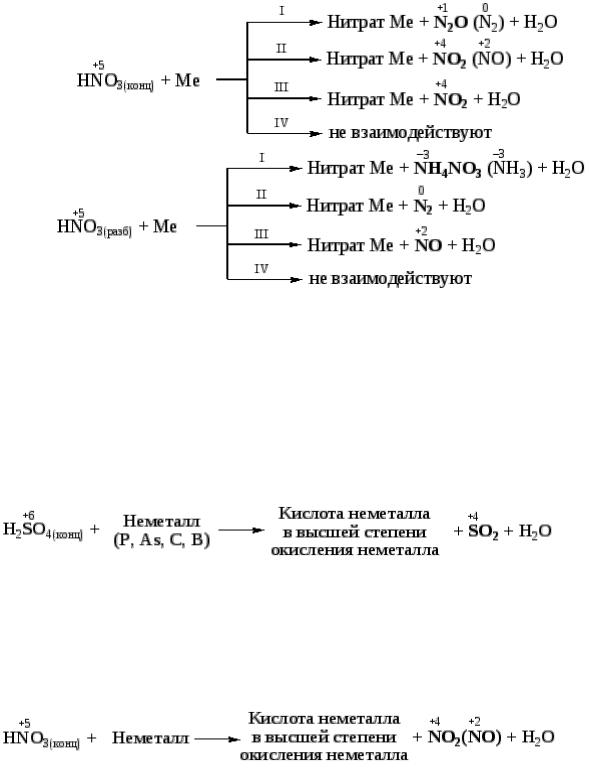
Азотная кислота. Окислителем в молекуле азотной кислоты является ион NO3– (N+5), который в зависимости от концентрации HNO3 и активности металла принимает от 1 до 8 электронов, образуя
NO2 ; NO ; N2O ; N2 ; NH3 (NH4NO3)
увеличение концентрации кислоты увеличение активности металла
Схемы процессов взаимодействия азотной кислоты с металлами (Ме) можно представить следующим образом
20
Так же, как и для концентрированной серной кислоты, Al, Cr, Fe не реагируют без нагревания с HNO3 (конц) ввиду пассивации.
Взаимодействие неметаллов с кислотами
Некоторые неметаллы взаимодействуют с концентрированной серной кислотой, при этом они восстанавливают ее до SO2
Так, P0 окисляется до H3PO4; As0 – до H3AsO4; C0 – до H2CO3 (H2O + CO2).
Неметаллы восстанавливают концентрированную азотную кислоту до NO2 или NO, при этом сами окисляются, как правило, до своей кислоты в высшей степени окисления
Например: HNO3 + S → H2SO4 + NO2 + H2O ; HNO3 + С → H2O + СО2 + NO2 .
