
4037
.pdfМинистерство науки и высшего образования Российской Федерации Федеральное государственное бюджетное образовательное учреждение
высшего образования «Воронежский государственный лесотехнический университет
им. Г.Ф. Морозова»
БИОТЕХНОЛОГИЯ.
РАННЯЯ ДИАГНОСТИКА ЗАБОЛЕВНИЙ СЕЯНЦЕВ ЛЕСНЫХ ПИТОМНИКОВ С ПОМОЩЬЮ МЕТОДОВ МОЛЕКУЛЯРНОГЕНЕТИЧЕСКОГО АНАЛИЗА
методические указания к практическим занятиям
для студентов по направлению подготовки 35.04.09 Ландшафтная архитектура
ВОРОНЕЖ 2018
1
УДК 630*
Биотехнология. Ранняя диагностика заболеваний сеянцев лесных питомников с помощью методов молекулярно-генетического анализа [Электронный ресурс]: методические к практическим занятиям для студентов по направлению подготовки 35.04.09 Ландшафтная / В. А. Сиволапов, Н. А. Карпеченко, В. Н. Вепринцев, И. Ю. Карпеченко, А. И. Сиволапов; М-во науки высшего образования РФ, ФГБОУ ВО «ВГЛТУ». – Воронеж, 2018. – 24 с.
Печатается по решению учебно-методического совета ФГБОУ ВПО «ВГЛТУ».
Методические указания предлагаются для обучения и подготовки магистров по предмету «Биотехнология», специалистам генетических лабораторий по молекулярно-генетическому анализу.
Методические указания могут быть использованы при обучении слушателей по соответствующим программам дополнительного профессионального образования.
Рецензент:
канд. биол. наук, зав лабораторией лесной биотехнологии ВНИИЛГИСбиотех О.С. Машкина
Ответственный за выпуск канд. с.-х. наук проф, А. И. Сиволапов
2
ОГЛАВЛЕНИЕ
Список основных терминов………………………………………………… 4
Введение…………………………………………………………………….. 5
1.Общая часть………………………………………………………….. 6
2.Методика видовой идентификации фитопатогенов сеянцев лесных питомников с помощью молекулярно-генетических методов анализа………………………………………………………………………. 8
2.1 Сбор образцов с лесных питомников для ДНК-анализа ..................... 8
2.2Протокол выделения ДНК……………………………………………… 8
2.3Спектрофотометрическое измерение концентрации ДНК …………... 9
2.4Протокол постановки ПЦР…………………………………………….. 10
2.5 Протокол постановки электрофореза в агарозном геле……………… 11
2.6Протокол выделения и очистки ампликона из агарозного геля (на примере наборов Eurugen Cleanup Mini).………………………………….. 11
2.7Протокол постановки секвенирующей ПЦР………………………….. 12
2.8Протокол очистки проб набором BigDye® XTerminator Purification Kit…………………………………………………………………………….. 12
2.9Протокол определения структуры ДНК на генетическом анализаторе ABI PRISM 310………………………………………………. 13
2.10Протокол анализа результатов секвенирования……………………. 15
3. Описание некоторых заболеваний сеянцев лесных питомников, выявленных с помощью методов молекулярно-генетического анализа, и
методы борьбы с ними……………………………………………………… 16
Библиографический список………………………………………………… 20 Приложение 1. Список оборудования для видовой идентификации фитопатогенов сеянцев лесных питомников с помощью молекулярногенетических методов анализа……………………………………………... 22 Приложение 2. Список химических реактивов и пластиковой посуды на различных этапах работ для видовой идентификации фитопатогенов сеянцев лесных питомников с помощью молекулярно-генетических методов анализа…………………………………………………………….. 23
3
СПИСОК ОСНОВНЫХ ТЕРМИНОВ
Биотехнология – наука о методах и технологиях производства продуктов с использованием биологических объектов.
Генотип – совокупность генов организма.
Генная инженерия – совокупность методов молекулярной генетики,
направленных на получение рекомбинантных нуклеиновых кислот,
осуществление манипуляций с генами.
Денатурация биополимеров – изменение структуры молекулы, вызывающее потерю её естественных свойств.
ДНК (дезоксирибонуклеиновая кислота) – биологический полимер, носитель наследственной информации всех живых организмов. В ядре клетки она представлена в виде хромосом.
Лиофилизат – продукт лиофилизации (способ мягкой сушки вещества)
Митотип – генотип по митохондриальной ДНК.
Отжиг праймера – присоединение праймера к ДНК-матрице.
Полимеразная цепная реакция (ПЦР) – метод амплификации (многократного копирования) небольших количеств фрагментов ДНК.
Праймер – последовательность из нескольких десятков нуклеотидов,
используемая для ПЦР.
Секвенирование – определение нуклеотидной последовательности.
Фитопатогены – инфекционные болезни растений.
Хладагент – вещество, используемое для охлаждения при термостатировании.
Электрофорез – метод разделения белков и нуклеиновых кислот под действием электрического поля.
Элонгация – процесс удлинения нуклеотидной последовательности.
BLAST – Интернет ресурс, применяемый для сравнения нуклеиновых последовательностей.
4
ВВЕДЕНИЕ
Внастоящее время быстро развиваются и внедряются в лесохозяйственную деятельность России различные методы биотехнологии и генной инженерии.
Решение ряда важнейших проблем в области лесной генетики не было возможно ввиду отсутствия соответствующего оборудования и апробированных методик работ.
Инновационные технологии, внедрённые в современное лесное хозяйство, при их рациональном использовании, способны дать положительный эффект в развитии отрасли и вывести её на качественно новый уровень. Исключением не является и анализ ДНК как растений, так и их патогенов.
Вданной работе большое внимание было сконцентрировано на модернизации и апробации общепринятых методик и протоколов выделения, идентификации заболеваний инфекционного происхождения древесных растений. Исследования проведены в ходе плановых работ отдела лесной генетики филиала ФБУ «Рослесозащита»-«ЦЗЛ Воронежской области».
Приведённые ниже протоколы могут быть использованы при подготовке специалистов высших учебных заведений в области молекулярной генетики и прочих специалистов производств лесного хозяйства.
5
1. ОБЩАЯ ЧАСТЬ
Одним из действенных способов недопущения роста численности вредных организмов, приносящих существенный ущерб от потери качества и количества как репродуктивного материала лесных питомников, так и древостоев, является их ранняя диагностика и профилактика с применением современных способов защиты и воспроизводства леса. В связи с этим возникает необходимость введения в практику современного лесного хозяйства фитосанитарных обследований состояния лесных питомников на основе методов молекулярно-генетического анализа. Они позволят поставить точный диагноз и узнать происхождение репродуктивного материала при наличии региональной базы данных митотипов основных лесообразующих пород. Во многом состояние и продуктивность создаваемых лесных культур зависит не только от факторов внешней среды, но и от качества и происхождения посадочного материала. На сегодняшний день оборудование и реактивы для ДНК-анализа являются весьма дорогостоящими, однако их стоимость оправдана экономической и экологической целесообразностью, заключающейся в предупреждении увеличения площади и степени поражения патогенами, по сравнению с проведением лесозащитных мероприятий и последующих лесовосстановительных работ.
Причиной повреждения и усыхания лесных растений служит воздействие ряда факторов абиотической и биотической природы, а также антропогенной – нарушение агротехники выращивания посадочного материала, несоблюдение условий хранения, технологии предпосевной обработки и посева семян. Нередко неблагоприятные погодные условия (аномальные засухи, град и т. д.), повреждения насекомыми приводят к ослаблению биологической устойчивости растения и создают предпосылки для поражения различными болезнями.
Важной особенностью для ведения хозяйства является наличие инкубационного периода инфекционных заболеваний – времени от начала заражения до появления первых признаков. Длительность этого периода зависит от способа заражения и вида возбудителя и может продолжаться от нескольких часов до нескольких лет.
Практическая значимость методов молекулярно-генетического анализа заключается в диагностике заболеваний уже на ранних стадиях, трудно идентифицируемых заболеваний и для уточнения диагноза, поставленного по морфологическим признакам.
6
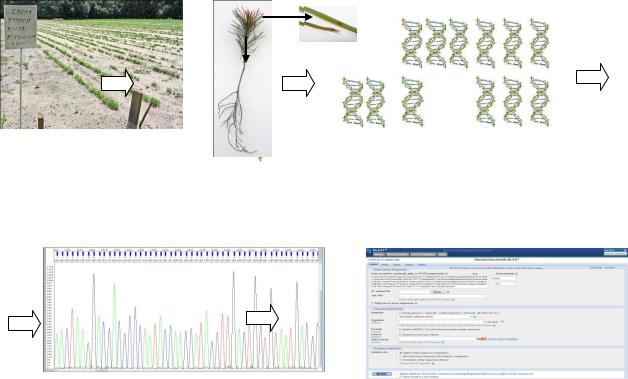
Диагностика фитопатогенов включает в себя ряд технологических этапов: выделение генетического материала (ДНК) из лесных растений, амплификация маркерных участков фитопатогенов, определение нуклеотидной последовательности амплифицированных фрагментов, анализ и идентификация патогенов в базе данных (рис. 1).
Отбор образцов с |
|
Многократное копирование |
|
|
ДНК фитопатогена |
||
питомника |
|
||
Выделение тотальной |
ДНК |
||
|
|||
|
из вегетативной части |
||
|
растения |
||
…AGTAAAAGTCGTAACAAGGTCTCCGTAGGTG…
Идентификация в базе данных
Расшифровка ДНК фитопатогена (секвенирование)
Рис.1. Схема видовой идентификации фитопатогенов сеянцев лесных питомников с помощью молекулярно-генетических методов
Ранее используемый метод фитопатологического анализа посадочного материала в лесных питомниках основан на обнаружении внешних признаков болезней: изменение цвета ассимиляционного аппарата или отдельных органов растения, наличие поверхностных спороносящих органов грибов и др. Он не позволяет осуществить своевременную профилактику и лечение заболеваний, что приводит к существенному экономическому и экологическому ущербу.
В связи с вышеизложенным, использование ДНК-анализа представляется более целесообразным, так как позволяет обнаружить поражение культур в питомниках на ранних стадиях и предупредить его распространение.
7
2. МЕТОДИКА ВИДОВОЙ ИДЕНТИФИКАЦИИ ФИТОПАТОГЕНОВ СЕЯНЦЕВ ЛЕСНЫХ ПИТОМНИКОВ С ПОМОЩЬЮ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ МЕТОДОВ АНАЛИЗА
2.1. Сбор образцов с лесных питомников для ДНК-анализа
Отбор образцов для генетического анализа осуществляют в количестве
20-50 поражённых растений каждой возрастной группы. Отобранные растения высушивают, этикетируют и отсылают в бумажных пакетах в ДНК-
лабораторию для последующего анализа.
В случае отсутствия поражённых растений в питомнике для оценки его фитосанитарного состояния осуществляют отбор растений без внешних признаков заболевания. Сбор проводят по диагонали производственного отделения или в шахматном порядке.
Для молекулярно-генетического анализа могут быть использованы любые части растения: хвоя, листья, стебель, корни. Однако лучше выделять ДНК из поражённого ассимиляционного аппарата.
Помимо растительных тканей возможно выделение ДНК патогенов из почвы, воды и насекомых.
2.2. Протокол выделения ДНК
Небольшой фрагмент ткани поместить в ступку для растирания, добавить
1мл прогретого ЦТАБ-буфера (3 % бромид цетилтриметилламоний (ЦТАБ), 1.4
М NaCl, 20 мМ ЭДТА, 100 мМ Трис, вода деионизованная) и максимально гомогенизировать образец.
Переместить гомогенат в заранее прогретые в термостате до 65 °С
центрифужные пробирки типа эппендорф. Инкубировать 5-7 мин. Навести и внести в каждую пробу равный объём смеси хлороформ : изоамиловый спирт
(24:1 соответственно) (работа под вытяжкой). Тщательно перемешать пробы в
течение 1-2 минут. Центрифугировать пробы 2-3 минуты при 13 000 g.
8
Перенести супернатант в микроцентрифужные пробирки типа эппендорф.
Среднюю и нижнюю фазы в дальнейшей работе не используют. Внести в каждую пробу 0,7 объёма охлажденного в морозилке изопропилового спирта
(работа под вытяжкой). Тщательно перемешать пробы в течение 1-2 минут.
Центрифугировать пробы 2-3 минуты на максимальных оборотах. Слить жидкость и оставить пробы обсохнуть на воздухе. Добавить в пробирки с пробами этиловый спирт 96 %. Тщательно перемешать в течение 2-3 минут.
Удалить жидкость из проб. Повторить процедуру промывки этанолом.
Высушить осадок. Добавить в пробы минимально необходимое для растворения осадка количество мQ-воды. Растворить до полного исчезновения осадка. Выделенные ДНК необходимо хранить при –20 °С.
2.3. Спектрофотометрическое измерение концентрации ДНК
Поскольку концентрация и чистота препарата ДНК являются важными факторами, влияющими на ход дальнейшего анализа, необходимо установление значений этих показателей с помощью спектрофотометра. Для определения количества ДНК измеряют поглощение раствора в областях с длинами волн
260 и 280 нм. Измерение при 260 нм позволяет рассчитать концентрацию нуклеиновой кислоты в пробе. Оптическая плотность D = 1 A соответствует приблизительно 50 мкг/мл двухцепочечной ДНК. Соотношение экстинкции
260/280 нм позволяет судить о чистоте нуклеиновой кислоты. Коэффициент отношения волн 260/280 нм для чистых препаратов ДНК должен укладываться в переделы 1,7 – 2,0. Коэффициент отношения волн 230/260 нм должен быть в переделах 0,3 – 0,9. Выход за параметры этих значений будет свидетельствовать о чрезмерном загрязнении образцов примесями (белки,
фенолы, соли и др.). Привести концентрации проб к оптимальному значению путем разбавления водой.
9
2.4. Протокол постановки ПЦР
Подготовить необходимые компоненты ПЦР-смеси. В штатив с хладагентом поместить пробирки, предназначенные для проведения ПЦР.
Рассчитать общее количество компонентов. Навести суммарную смесь в одной пробирке и разнести поровну в остальные. Добавить в каждую пробирку соответствующую ДНК-матрицу и довести водой до конечного объёма.
Состав ПЦР-смеси на 25 мкл: 2,5 мкл 10х ПЦР-буфера, 2,5 мкл 25 мМ
MgCl2, 1 мкл 10 мМ смесь дНТФ (дезоксинуклеотид трифосфаты), 1 ед. Taq-
ДНК-полимеразы, по 1 мкМ прямого и обратного праймеров, ДНК-матрицы (её объем зависит от концентрации полученной ДНК), деионизованной воды до 25
мкл. Перемешать, поместить в амплификатор, запустить необходимую программу.
Классический вид программы ПЦР для амплификатора (стадии со 2 по 4
повторяются циклически в количестве 25-40):
1.Первичный прогрев 95 °С - 5 мин.
2.Денатурация 90–95 °С - 15 сек. Происходит расщепление двухцепочечной молекулы ДНК.
3.Отжиг 20 сек (температура отжига зависит от длины и нуклеотидного состава праймера и устанавливается оптимизированной для используемых праймеров (40–60 °С)).
4.Элонгация 72 °С - 40 сек
5.Конечная элонгация 72 °С - 5 мин.
6.Хранение 4 °С - ∞
Состав смеси и программа ПЦР могут варьироваться и подбираются экспериментально.
10
