
3623
.pdfМинистерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования «Воронежская государственная лесотехническая академия»
БИОТЕХНОЛОГИЯ Ранняя диагностика заболеваний сеянцев лесных питомников
с помощью методов молекулярно-генетического анализа
Методические указания к практическим занятиям для студентов по направлению подготовки магистров 250700 – Ландшафтная архитектура
Воронеж 2014
2
УДК 630*
Биотехнология. Ранняя диагностика заболеваний сеянцев лесных питомников с помощью методов молекулярно-генетического анализа [Текст] : методические указания к практическим занятиям для студентов по направлению подготовки магистров 250700 – Ландшафтная архитектура / В. А. Сиволапов, Н. А. Карпеченко, В. Н. Вепринцев, И. Ю. Карпеченко, А. И. Сиволапов ; М-во образования и науки РФ, ФГБОУ ВПО «ВГЛТА». – Воронеж, 2014. – 23 с.
Печатается по решению учебно-методического совета ФГБОУ ВПО «ВГЛТА» (протокол № 2 от 31 октября 2014 г.)
Рецензент заведующий лабораторией лесной биотехнологии ФГБУ «ВНИИЛГИСбиотех» канд. биол. наук О.С. Машкина
Ответственный за выпуск канд. с.-х. наук, проф. А.И. Сиволапов
Методические указания предлагаются для обучения и подготовки магистров по предмету «Биотехнология», специалистам генетических лабораторий по молекулярногенетическому анализу.
Методические указания могут быть использованы при обучении слушателей по соответствующим программам дополнительного профессионального образования.
3
ОГЛАВЛЕНИЕ
Введение…………………………………………………………………….. 4
Список основных терминов………………………………………………… 5
1.Общая часть………………………………………………………….. 6
2.Методика видовой идентификации фитопатогенов сеянцев лесных питомников с помощью молекулярно-генетических методов анализа………………………………………………………………………. 8
2.1.Сбор образцов с лесных питомников для ДНК-анализа ..................... 8
2.2. Протокол выделения ДНК…………………………………………… 8
2.3.Спектрофотометрическое измерение концентрации ДНК ………….. 9
2.4.Протокол постановки ПЦР…………………………………………….. 9
2.5. Протокол постановки электрофореза в агарозном геле……………… 10
2.6.Протокол выделения и очистки ампликона из агарозного геля (на примере наборов Eurugen Cleanup Mini).………………………………….. 11
2.7.Протокол постановки секвенирующей ПЦР………………………….. 11
2.8.Протокол очистки проб набором BigDye® XTerminator Purification Kit…………………………………………………………………………….. 12
2.9.Протокол определения структуры ДНК на генетическом анализаторе ABI PRISM 310………………………………………………. 12
2.10.Протокол анализа результатов секвенирования……………………. 14
3. Описание некоторых заболеваний сеянцев лесных питомников, выявленных с помощью методов молекулярно-генетического анализа, и
методы борьбы с ними……………………………………………………… 15
Библиографический список………………………………………………… 18 Приложение 1. Список оборудования для видовой идентификации фитопатогенов сеянцев лесных питомников с помощью молекулярногенетических методов анализа……………………………………………... 20 Приложение 2. Список химических реактивов и пластиковой посуды на различных этапах работ для видовой идентификации фитопатогенов сеянцев лесных питомников с помощью молекулярно-генетических методов анализа…………………………………………………………….. 21
4
ВВЕДЕНИЕ
Начало XXI столетия ознаменовалось быстрым развитием и внедрением в лесохозяйственную деятельность России различных методов биотехнологии и генной инженерии.
Решение ряда важнейших проблем в области лесной генетики не было возможно ввиду отсутствия соответствующего оборудования и апробированных методик работ.
Инновационные технологии, внедрённые в современное лесное хозяйство, при их рациональном использовании, способны дать положительный эффект в развитии отрасли и вывести её на качественно новый уровень. Исключением не является и анализ ДНК как растений, так и их патогенов.
В данной работе большое внимание было сконцентрировано на модернизации и апробации общепринятых методик и протоколов выделения, идентификации заболеваний инфекционного происхождения древесных растений. Исследования проведены в ходе плановых работ отдела лесной генетики филиала ФБУ «Рослесозащита»-«ЦЗЛ Воронежской области».
Приведённые ниже протоколы могут быть использованы при подготовке специалистов высших учебных заведений в области молекулярной генетики и прочих специалистов производств лесного хозяйства.
5
СПИСОК ОСНОВНЫХ ТЕРМИНОВ
Биотехнология – наука о методах и технологиях производства продуктов с использованием биологических объектов.
Генотип – совокупность генов организма.
Генная инженерия – совокупность методов молекулярной генетики, направленных на получение рекомбинантных нуклеиновых кислот, осуществление манипуляций с генами.
Денатурация биополимеров – изменение структуры молекулы, вызывающее потерю её естественных свойств.
ДНК (дезоксирибонуклеиновая кислота) – биологический полимер, носитель наследственной информации всех живых организмов. В ядре клетки она представлена в виде хромосом.
Лиофилизат – продукт лиофилизации (способ мягкой сушки вещества) Митотип – генотип по митохондриальной ДНК.
Отжиг праймера – присоединение праймера к ДНК-матрице.
Полимеразная цепная реакция (ПЦР) – метод амплификации (многократного копирования) небольших количеств фрагментов ДНК.
Праймер – последовательность из нескольких десятков нуклеотидов, используемая для ПЦР.
Секвенирование – определение нуклеотидной последовательности. Фитопатогены – инфекционные болезни растений.
Хладагент – вещество, используемое для охлаждения при термостатировании. Электрофорез – метод разделения белков и нуклеиновых кислот под действием электрического поля.
Элонгация – процесс удлинения нуклеотидной последовательности.
BLAST – Интернет ресурс, применяемый для сравнения нуклеиновых последовательностей.
6
1. ОБЩАЯ ЧАСТЬ
Одним из действенных способов недопущения роста численности вредных организмов, приносящих существенный ущерб от потери качества и количества как репродуктивного материала лесных питомников, так и древостоев, является их ранняя диагностика и профилактика с применением современных способов защиты и воспроизводства леса. В связи с этим возникает необходимость введения в практику современного лесного хозяйства фитосанитарных обследований состояния лесных питомников на основе методов молекулярно-генетического анализа. Они позволят поставить точный диагноз и узнать происхождение репродуктивного материала при наличии региональной базы данных митотипов основных лесообразующих пород. Во многом состояние и продуктивность создаваемых лесных культур зависит не только от факторов внешней среды, но и от качества и происхождения посадочного материала. На сегодняшний день оборудование и реактивы для ДНК-анализа являются весьма дорогостоящими, однако их стоимость оправдана экономической и экологической целесообразностью, заключающейся в предупреждении увеличения площади и степени поражения патогенами, по сравнению с проведением лесозащитных мероприятий и последующих лесовосстановительных работ.
Причиной повреждения и усыхания лесных растений служит воздействие ряда факторов абиотической и биотической природы, а также антропогенной – нарушение агротехники выращивания посадочного материала, несоблюдение условий хранения, технологии предпосевной обработки и посева семян. Нередко неблагоприятные погодные условия (аномальные засухи, град и т. д.), повреждения насекомыми приводят к ослаблению биологической устойчивости растения и создают предпосылки для поражения различными болезнями.
Важной особенностью для ведения хозяйства является наличие инкубационного периода инфекционных заболеваний – времени от начала заражения до появления первых признаков. Длительность этого периода зависит от способа заражения и вида возбудителя и может продолжаться от нескольких часов до нескольких лет.
Практическая значимость методов молекулярно-генетического анализа заключается в диагностике заболеваний уже на ранних стадиях, трудно идентифицируемых заболеваний и для уточнения диагноза, поставленного по морфологическим признакам.
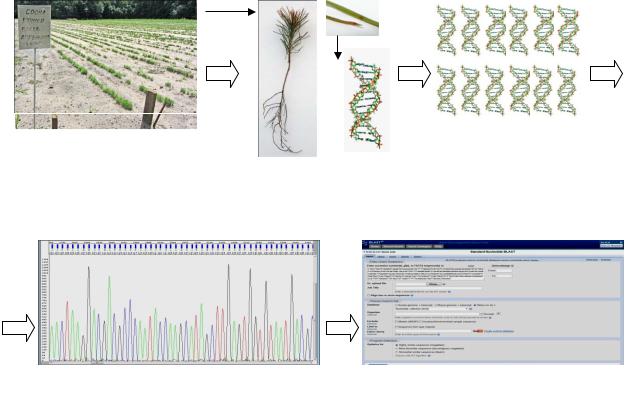
7
Диагностика фитопатогенов включает в себя ряд технологических этапов: выделение генетического материала (ДНК) из лесных растений, амплификация маркерных участков фитопатогенов, определение нуклеотидной последовательности амплифицированных фрагментов, анализ и идентификация патогенов в базе данных (рис. 1).
Отбор образцов с |
Многократное копирование |
питомника |
ДНК фитопатогена |
|
Выделение тотальной |
|
|
|
ДНК из вегетативной |
|
части растения |
...AGTAAAAGTCGTAACAAGGTCTCCGTAGGTG… |
Идентификация в базе данных |
Расшифровка ДНК фитопатогена (секвенирование)
Рис. 1. Схема видовой идентификации фитопатогенов сеянцев лесных питомников с помощью молекулярно-генетических методов
Ранее используемый метод фитопатологического анализа посадочного материала в лесных питомниках основан на обнаружении внешних признаков болезней: изменение цвета ассимиляционного аппарата или отдельных органов растения, наличие поверхностных спороносящих органов грибов и др. Он не позволяет осуществить своевременную профилактику и лечение заболеваний, что приводит к существенному экономическому и экологическому ущербу.
В связи с вышеизложенным, использование ДНК-анализа представляется более целесообразным, так как позволяет обнаружить поражение культур в питомниках на ранних стадиях и предупредить его распространение.
8
2. МЕТОДИКА ВИДОВОЙ ИДЕНТИФИКАЦИИ ФИТОПАТОГЕНОВ СЕЯНЦЕВ ЛЕСНЫХ ПИТОМНИКОВ С ПОМОЩЬЮ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ МЕТОДОВ АНАЛИЗА
2.1. Сбор образцов с лесных питомников для ДНК-анализа
Отбор образцов для генетического анализа осуществляют в количестве 20-50 поражённых растений каждой возрастной группы. Отобранные растения высушивают, этикетируют и отсылают в бумажных пакетах в ДНКлабораторию для последующего анализа.
В случае отсутствия поражённых растений в питомнике для оценки его фитосанитарного состояния осуществляют отбор растений без внешних признаков заболевания. Сбор проводят по диагонали производственного отделения или в шахматном порядке.
Для молекулярно-генетического анализа могут быть использованы любые части растения: хвоя, листья, стебель, корни. Однако лучше выделять ДНК из поражённого ассимиляционного аппарата.
Помимо растительных тканей возможно выделение ДНК патогенов из почвы, воды и насекомых.
2.2. Протокол выделения ДНК
Небольшой фрагмент ткани поместить в ступку для растирания, добавить 1 мл прогретого ЦТАБ-буфера (3 % бромид цетилтриметилламоний (ЦТАБ), 1,4 М NaCl, 20 мМ ЭДТА, 100 мМ Трис, вода деионизованная) и максимально гомогенизировать образец.
Переместить гомогенат в заранее прогретые в термостате до 65 °С центрифужные пробирки типа эппендорф. Инкубировать 5-7 мин. Навести и внести в каждую пробу равный объём смеси хлороформ : изоамиловый спирт (24:1 соответственно) (работа под вытяжкой). Тщательно перемешать пробы в течение 1-2 минут. Центрифугировать пробы 2-3 минуты при 13 000 g. Перенести супернатант в микроцентрифужные пробирки типа эппендорф. Среднюю и нижнюю фазы в дальнейшей работе не используют. Внести в каждую пробу 0,7 объёма охлажденного в морозилке изопропилового спирта
9
(работа под вытяжкой). Тщательно перемешать пробы в течение 1-2 минут. Центрифугировать пробы 2-3 минуты на максимальных оборотах. Слить жидкость и оставить пробы обсохнуть на воздухе. Добавить в пробирки с пробами этиловый спирт 96 %. Тщательно перемешать в течение 2-3 минут. Удалить жидкость из проб. Повторить процедуру промывки этанолом. Высушить осадок. Добавить в пробы минимально необходимое для растворения осадка количество мQ-воды. Растворить до полного исчезновения осадка. Выделенные ДНК необходимо хранить при –20 °С.
2.3. Спектрофотометрическое измерение концентрации ДНК
Поскольку концентрация и чистота препарата ДНК являются важными факторами, влияющими на ход дальнейшего анализа, необходимо установление значений этих показателей с помощью спектрофотометра. Для определения количества ДНК измеряют поглощение раствора в областях с длинами волн 260 и 280 нм. Измерение при 260 нм позволяет рассчитать концентрацию нуклеиновой кислоты в пробе. Оптическая плотность D = 1 A соответствует приблизительно 50 мкг/мл двухцепочечной ДНК. Соотношение экстинкции 260/280 нм позволяет судить о чистоте нуклеиновой кислоты. Коэффициент отношения волн 260/280 нм для чистых препаратов ДНК должен укладываться в переделы 1,7 – 2,0. Коэффициент отношения волн 230/260 нм должен быть в переделах 0,3 – 0,9. Выход за параметры этих значений будет свидетельствовать о чрезмерном загрязнении образцов примесями (белки, фенолы, соли и др.). Привести концентрации проб к оптимальному значению путем разбавления водой.
2.4. Протокол постановки ПЦР
Подготовить необходимые компоненты ПЦР-смеси. В штатив с хладагентом поместить пробирки, предназначенные для проведения ПЦР. Рассчитать общее количество компонентов. Навести суммарную смесь в одной пробирке и разнести поровну в остальные. Добавить в каждую пробирку соответствующую ДНК-матрицу и довести водой до конечного объёма.
10
Состав ПЦР-смеси на 25 мкл: 2,5 мкл 10х ПЦР-буфера, 2,5 мкл 25 мМ MgCl2, 1 мкл 10 мМ смесь дНТФ (дезоксинуклеотид трифосфаты), 1 ед. Taq- ДНК-полимеразы, по 1 мкМ прямого и обратного праймеров, ДНК-матрицы (её объем зависит от концентрации полученной ДНК), деионизованной воды до 25 мкл. Перемешать, поместить в амплификатор, запустить необходимую программу.
Классический вид программы ПЦР для амплификатора (стадии со 2 по 4 повторяются циклически в количестве 25-40):
1.Первичный прогрев 95 °С – 5 мин.
2.Денатурация 90-95 °С – 15 сек. Происходит расщепление двухцепочечной молекулы ДНК.
3.Отжиг 20 сек (температура отжига зависит от длины и нуклеотидного состава праймера и устанавливается оптимизированной для используемых праймеров (40-60 °С)).
4.Элонгация 72 °С – 40 сек
5.Конечная элонгация 72 °С – 5 мин.
6.Хранение 4 °С – ∞ Состав смеси и программа ПЦР могут варьироваться и подбираются экспериментально.
2.5.Протокол постановки электрофореза в агарозном геле
Приготовить агарозный гель (сварить) необходимого состава и объёма. Состав 2 % агарозного геля: агароза 2 %,трис-ацетатный буфер 2 % (pH 8,5, 2 М трис, 0,5 М ЭДТА, уксусная кислота, дистиллированная вода), вода до конечного объема. Необходимый объём геля выбирается, исходя из вместимости заливочного столика электрофоретической камеры. Собрать заливочный столик. После охлаждения геля до температуры 55 °С добавить бромистый этидий (0,01 % от объёма геля), хорошо перемешать и залить в заливочный столик. Вставить гребёнку. Застывший гель переместить в электрофоретическую камеру. Смешать краситель с пробами (их соотношение зависит от кратности красителя, указанной на упаковке). Закрыть камеру и включить источник питания. После окончания электрофореза поместить гель в систему гель-документации для анализа результата.
