
3024
.pdfбиотехнологический. Таким методом получают, например, аспарагиновую кислоту (на основе фумаровой кислоты). Раствор фумаровой кислоты пропускают через колонки, в которых иммобилизованы или ферменты, или клетки микроорганизмов с высокой активностью аспартазы, например, Escherichia coli или Serratia marcesceus; туда же подается аммиак и осуществляется биотрансформация.
Химико-энзиматически можно производить практически все аминокислоты, однако из-за дороговизны и сложности получения соответствующих органических кислот-предшественников этот метод не всегда экономически выгоден и в большинстве случаев уступает методу прямого микробиологического синтеза.
Четвертый способ получения аминокислот — их прямой микробиологический синтез — целиком основан на использовании биообъектов (т.е. является полностью биотехнологическим). В качестве биообъектов в нем применяются штаммы-продуценты аминокислот. Этим методом аминокислоты чаще всего получают на основе Escherichia coli (кишечная палочка — симбионт человека), Bacillus subtilis (сенная палочка
— почвенный микроорганизм) и Corynebacterium glutamicum (почвенный микроорганизм).
Для получения аминокислот, органических кислот, ферментов, биологически активных веществ биотехологическими способами используют ауксотрофные мутанты, т.е. штаммы, приобретшие способность к сверхсинтезу нужных нам веществ. Это происходит за счет потери способности синтезировать другие необходимые соединения, которые приходится добавлять в питательную среду.
Бактерии для производства аминокислот стали использовать с начала 50-х годов ХХ века. Их штаммы улучшали генетическими методами, выделяя ауксотрофные мутанты и мутанты с измененными регуляторными свойствами. В основе большинства производственных процессов при получении аминокислот лежит регулирование условий среды (изменение концентрации субстрата, рН, ионов металлов, органических добавок), что приводит к синтезу избыточных количеств необходимого продукта.
Все эти микроорганизмы на сегодняшний день прекрасно изучены. Известна полная нуклеотидная последовательность всего их генома. Для кишечной палочки разработаны многообразные способы генетического обмена, позволяющие легко комбинировать разные гены и изменять процесс метаболизма. В меньшей степени это относится к Bacillus subtilis, и еще в меньшей степени к Corynebacterium glutamicum.
Использование этих микроорганизмов для получения аминокислот основано на их способности самостоятельно синтезировать все 20 аминокислот. Также они являются гетеротрофными бактериями, которые в качестве источника углерода используют органические соединения (углевод или какую-нибудь органическую кислоту), а все остальные компоненты получают из неорганических соединений.
Применение микроорганизмов гетеротрофов позволяет существенно сократить по времени процесс ферментации. Так, кишечная палочка в богатой питательной среде делится каждые 20-30 мин, коринебактерии – каждый час. В бедных средах – время регенерации в два раза больше (1 ч для кишечной палочки, 1,5-2 ч для коринебактерии и сенной палочки). Вместе с тем существуют бактерии, так называемые ауксотрофные мутанты
— микроорганизмы, которые, с одной стороны, утратили способность самостоятельно синтезировать необходимые для построения всех компонентов своей клетки разные аминокислоты, а с другой – приобрели способность к сверхсинтезу целевой аминокислоты. Такие мутанты получают либо воздействием различных мутагенов физической и химической природы на исходную культуру микроорганизма с последующей селекцией штамма по заранее заданным признакам, либо методами генной инженерии.
Так для производства глутамата из гидролизата крахмала, мелассы из сахарного тростника и свеклы используют Corynebacterium и Brewibacterium. Через 48-52 часа после начала культивирования в среде накапливается глутаминовая кислота, которую осаждают известковым молоком и отделяют на ионно-обменных смолах. Из всех аминокислот, вырабатываемых промышленным способом, наибольший объем приходится на глутамат натрия – около 150000 т ежегодное мировое производство. Ежегодное производство другой аминокислоты лизина – 15000 т. Основная роль в производстве этих аминокислот принадлежит японским фирмам.
Для получения лизина используют мутанты микрококков, не способные синтезировать серин, но способные к сверхсинтезу лизина. Процесс идет при непрерывном культивировании с периодической подачей питательного раствора.
Перечень препаратов на основе аминокислот и их комплексов постоянно растет и расширяется. Очень хорошую перспективу для успешного развития имеют препараты для парентерального питания, содержащие комплексы аминокислот. Они назначаются, когда питание «естественным» образом противопоказано, так как стимулирует секрецию пищеварительных желез. Например, при остром панкреатите человек не должен ни пить, ни есть, поскольку любая стимуляция секреции может привести к самоперевариванию поджелудочной железы.
Незаменимые аминокислоты могут получаться микробиологическим путем более эффективно, чем путем химического синтеза, так как при биологическом синтезе используемые микроорганизмы образуют аминокислоты в биологически активной L-форме. Как продуценты лизина изучаются Brevibacterium lactofermentum и бактерии рода Corynebacterium,
также предложены способы биотехнологического получения изолейцина, треонина при использовании E. coli. Большинство исследованных штаммов микроорганизмов независимо от их систематического положения преимущественно накапливают L-аланин и глутаминовую кислоту. Значительно меньше штаммов и в меньшем количестве выделяют аспарагиновую кислоту, лейцин, валин, изолейцин, лизин. За рубежом 60%
мощностей по производству аминокислот занимают глутаминовая кислота, далее идут метионин, лизин и глицин. Глутаминовая кислота производится при участии в качестве продуцента штамма Corynebacterium.
Производство органических кислот можно отнести к числу давних биотехнологических процессов. В 1893 году было налажено производство лимонной кислоты методом ферментации углеводов при участии грибов. В настоящее время в промышленном производстве лимонной кислоты в основном используются Aspergillus niger и Aspergillus wenti.
В конце 19 века началось промышленное производство молочной кислоты при участии молочно-кислых бактерий рода Lactobacillus. В качестве исходного сырья используются продукты, содержащие крахмал, сахарозу или молочную сыворотку. Молочную кислоту применяют в пищевой промышленности, в дубильной – для декальцификации кож; а также при производстве пластмасс и в медицине. Кроме лимонной и молочной кислот аналогичными способами производят и другие органические кислоты
–яблочную, салициловую, итаконовую (эта кислота идет на производство пластмасс и красителей). Большинство органических кислот, вырабатываемых с помощью микроорганизмов, являются продуктом переработки пищевого сырья, однако в ряде случаев в качестве исходного продукта используют такие вещества, как нафталин (для производства салициловой кислоты), н-парафины (описан способ получения яблочной кислоты при помощи дрожжей из н-парафинов).
Спомощью микроорганизмов можно получить до 60 органических кислот. Многие из них получаются в промышленном масштабе - итаконовая, молочная, уксусная, лимонная, яблочная, янтарная. Эти пищевые кислоты используются как регуляторы кислотности и консерванты. Лимонную кислоту получают с помощью Yarrowia lipolytica, Aspergillus niger, молочную
–Endomycopsis fibuligera, Rhisopus oryzae, Lactobacillus casei, янтарную – Anaerobiospirillum succiniproducens. Уксусную кислоту получают путем микробиологической конверсии водорода и углекислого газа бактериями
Acetobacterium woodi и Clostridium aceticum.
Микроорганизмы содержат много витаминов, которые чаще всего входят в состав ферментов. Состав и количество витаминов в биомассе зависят от биологических свойств данной культуры микроорганизмов и условий культивирования. Некоторые витамины микроорганизмы синтезируют, другие напротив усваивают в готовом виде из окружающей среды. Культура, способная синтезировать какой-либо витамин, называется автотрофной по отношению к нему, если культура не способна синтезировать данный витамин, она является авто-гетеротрофной.
Витамины синтезируют в основном химическим путем или получают
из естественных источников. Однако эргостерин, рибофлавин (В2), витамин В12 и аскорбиновую кислоту (микроорганизмы используются как селективные окислители сорбита в сорбозу при производстве витамина С) получают микробиологическим путем. Для синтеза витаминов В1, В2, В6, В12
и аскорбиновой кислоты также используют кефирные грибки, а
бифидобактерии – группы В, РР (никотиновая кислота) и Н, однако пока эти микроорганизмы не используются как продуценты витаминов в промышленных масштабах.
Вопросы для самоконтроля
1.Охарактеризуйте биологический метод получения аминокислот.
2.Охарактеризуйте химический метод получения аминокислот.
3.Охарактеризуйте химико-энзиматический метод получения аминокислот.
4.Охарактеризуйте микробиологический метод получения аминокислот.
5.Получение витаминов в биотехнологическом процессе.
6.Биотехнологическое производство органических кислот.
7.Какие микроорганизмы являются продуцентами лимонной кислоты?
8.Какие микроорганизмы являются продуцентами молочной кислоты?
Тема 4. Иммобилизованные системы в биотехнологии
Иммобилизация представляет собой включение фермента в такую среду, в которой для него доступной оказывается лишь ограниченная часть общего объема. На практике для иммобилизации ферментов используют рутинные физические и химические методы. Все существующие методы физической иммобилизации (т. е. иммобилизации, при которой фермент не соединяется с носителем ковалентными связями) могут быть подразделены на четыре основные группы:
·адсорбция на поверхности нерастворимого носителя (или как иногда говорят матрикса);
·включение в поры геля;
·пространственное разделение фермента от остальной части реакционной смеси с помощью полупроницаемой мембраны;
·введение фермента в двухфазную реакционную среду, в которой он растворим, но может находиться только в одной из фаз.
Эффективность ферментативных процессов, используемых в самых различных областях человеческой деятельности, удалось увеличить с помощью иммобилизации ферментов. Иммобилизованные ферменты обладают несколькими преимуществами над своими растворимыми аналогами:
1) могут быть отделены от продукта и использованы повторно, что снижает стоимость процесса; 2) характеризуются повышенной стабильностью и длительным сохранением активности;
3) пригодны для непрерывных процессов, которые, в свою очередь, облегчают контроль за качеством и снижают стоимость труда;
4)время реакции может быть уменьшено за счет создания более высокого соотношения ферментов и субстратов;
5)возможностью создания мультиферментных систем.
Однако применение ферментов ограничено из-за их низкой стабильности, способности катализировать только одну единственную реакцию, высокой стоимости чистых препаратов. Кроме того, для практических целей могут использоваться только те ферменты, для которых не требуется регенерации кофакторов. Поэтому в настоящее время наряду с иммобилизацией ферментов внимание исследователей все больше привлекает иммобилизация клеток и органелл. Живая клетка в отличие от фермента представляет собой готовый биотехнологический реактор, в котором реализуются не только процессы, приводящие к образованию конечного продукта, но и многие другие, способствующие поддержанию каталитической эффективности системы на высоком уровне (например, регенерация кофакторов). Поскольку ферменты функционируют в нативном окружении, их денатурация в процессе работы сводится к минимуму.
Это расширяет число применяемых ферментов и позволяет осуществлять как процессы синтеза, так и процессы деградации. Иммобилизованные клетки идеально подходят для использования в реакторах с перемешиванием, через которые пропускают субстрат. Преимуществом таких реакторов является возможность их многократного использования и получения продукта, свободного от фермента. Конечно, использование иммобилизованных клеток не лишено недостатков. Например, клеточная стенка или плазматическая мембрана могут препятствовать проникновению субстрата к ферменту или диффузии продукта из клетки. Кроме того, возникает необходимость поддержания целостности клеток и удержания их в той фазе роста, в которой синтезируются требуемые ферменты. Наконец, из-за большого числа присутствующих в клетке ферментов (что в ряде случаев рассматривается как достоинство) возможно протекание нежелательных побочных реакций.
Для иммобилизации клеток используется множество способов (сорбция инертными и ионообменными носителями, ковалентное связывание с полимерным носителем, включение в гель) и носителей разных типов (природные и синтетические полимеры и неорганические вещества). Включение живых клеток требует мягких условий иммобилизации, носитель при этом должен представлять собой систему открытых пор с хорошими условиями для газообмена. Следует принимать во внимание и возможное вредное влияние на жизнеспособность клеток сшивающих агентов. Наибольшее распространение получило включение клеток в полиакриламидный гель и гель альгината кальция. Альгинат – основной структурный полисахарид бурых морских водорослей. В присутствии моновалентных катионов полисахарид образует вязкий раствор, тогда как в присутствии двухвалентных катионов, особенно кальция, наблюдается образование геля. Поскольку гель образуется в мягких условиях, в нем можно иммобилизовать живые клетки.
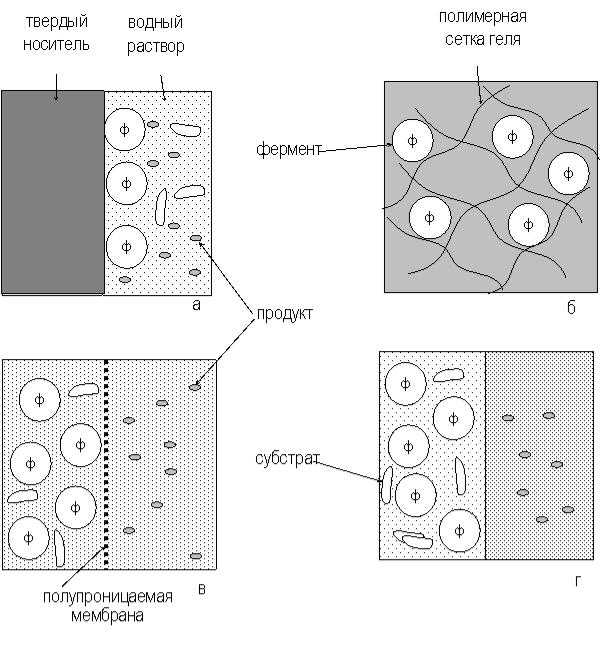
Существует четыре типа связывания ферментов:
-адсорбция на нерастворимых носителях;
-включение в поры геля;
-пространственное отделение фермента от остального объема реакционной системы с помощью полупроницаемой перегородки (мембраны);
-включение в двухфазную среду, где фермент растворим и может находиться только в одной из фаз.
Перечисленные подходы проиллюстрированы рисунке 1.
Рисунок 1. Способы иммобилизации ферментов: а - адсорбция на нерастворимых носителях, б – включение в поры геля, в – отделение фермента с помощью полупроницаемой мембраны, г – использование двухфазной реакционной среды
Адсорбционная иммобилизация является наиболее старым из существующих способов иммобилизации ферментов, начало ей было положено еще в 1916 г. Этот способ достаточно прост и достигается при контакте водного раствора фермента с носителем. После отмывки неадсорбировавшегося белка иммобилизованный фермент готов к использованию. Удерживание адсорбированной молекулы фермента на поверхности носителя может обеспечиваться за счет неспецифических ван- дер-ваальсовых взаимодействий, водородных связей, электростатических и гидрофобных взаимодействий между носителем и поверхностными группами белка. Вклад каждого из типов связывания зависит от химической природы носителя и функциональных групп на поверхности молекулы фермента.
Взаимодействия с носителем могут оказаться настолько сильными, что сорбция биокатализатора может сопровождаться разрушением его структуры. Например, при адсорбции некоторых растительных клеток на гранулах цитодекса клеточная стенка деформируется, повторяя рельеф поверхности частиц носителя. Преимуществом метода адсорбционной иммобилизации является доступность и дешевизна сорбентов, выступающих в роли носителей. Им также можно придать любую конфигурацию и обеспечить требуемую пористость. Важный фактор - простота применяемых методик. При адсорбционном связывании можно решить и проблему очистки фермента, так как связывание белка с носителем во многих случаях достаточно специфическое. К сожалению, прочность связывания фермента с носителем не всегда достаточно высока, что ограничивает применение метода. К недостаткам адсорбционной иммобилизации следует отнести отсутствие общих рекомендаций, позволяющих сделать правильный выбор носителя и оптимальных условий иммобилизации конкретного фермента.
Некоторых из перечисленных затруднений можно избежать при иммобилизации ферментов путем включения в гели. Суть этого метода иммобилизации состоит в том, что молекулы фермента включаются в трехмерную сетку из тесно переплетенных полимерных цепей, образующих гель. Среднее расстояние между соседними цепями в геле меньше размера молекулы включенного фермента, поэтому он не может покинуть полимерную матрицу и выйти в окружающий раствор, т.е. находится в иммобилизованном состоянии. Дополнительный вклад в удерживание фермента в сетке геля могут вносить также ионные и водородные связи между молекулой фермента и окружающими ее полимерными цепями. Пространство между полимерными цепями в геле заполнено водой, на долю которой обычно приходится значительная часть всего объема геля. Например, широко применяемые гели полимеров акриловой кислоты в зависимости от концентрации полимера и его природы содержат от 50 до
90% воды.
Для иммобилизации ферментов в геле существует два основных способа. При одном из них фермент помещают в водный раствор мономера, а затем проводят полимеризацию, в результате чего образуется полимерный гель с включенными в него молекулами фермента. В реакционную смесь
часто добавляют также бифункциональные (содержащие в молекуле две двойные связи) сшивающие агенты, которые придают образующемуся полимеру структуру трехмерной сетки. В другом случае фермент вносят в раствор готового полимера, который затем каким-либо образом переводят в гелеобразное состояние. Способ иммобилизации ферментов путем включения в полимерный гель позволяет создавать препараты любой геометрической конфигурации, обеспечивая при этом равномерное распределение биокатализатора в объеме носителя. Метод универсален, применим для иммобилизации практически любых ферментов, полиферментных систем, клеточных фрагментов и клеток. Фермент, включенный в гель, стабилен, надежно защищен от инактивации вследствие бактериального заражения, так как крупные клетки бактерий не могут проникнуть в мелкопористую полимерную матрицу. В то же время, эта матрица может создавать значительные препятствия для диффузии субстрата к ферменту, снижая каталитическую эффективность иммобилизованного препарата, поэтому для высокомолекулярных субстратов данный метод иммобилизации не применим вообще.
Общий принцип иммобилизации ферментов с использованием мембран заключается в том, что водный раствор фермента отделяется от водного раствора субстрата полупроницаемой перегородкой. Полупроницаемая мембрана легко пропускает небольшие молекулы субстрата, но непреодолима для крупных молекул фермента. Существующие модификации этого метода различаются лишь способами получения полупроницаемой мембраны и ее природой. Водный раствор фермента можно включать внутрь микрокапсул, представляющих собой замкнутые сферические пузырьки с тонкой полимерной стенкой (микрокапсулирование). При двойном эмульгировании получается водная эмульсия из капель органического раствора полимера, содержащих, в свою очередь, еще более мелкие капли водного раствора фермента. Через некоторое время растворитель затвердевает, образуя сферические полимерные частицы с иммобилизованным в них ферментом. Если вместо водонерастворимого отвердевающего полимера используются жидкие углеводороды с высокой молекулярной массой, метод называется иммобилизацией путем включения в жидкие мембраны. К модификациям метода иммобилизации ферментов с использованием полупроницаемых оболочек относятся также включение в волокна ( при этом вместо капель, содержащих ферменты, получаются нити) и включение в липосомы. Применение систем мембранного типа позволяет получать иммобилизованные препараты с высоким содержанием фермента. Метод, как и предыдущий, достаточно универсален, т.е. применим как ферментам, так и к клеткам, а также их фрагментам. Благодаря высокому отношению поверхности к объему и малой толщине мембраны удается избежать значительных диффузионных ограничений скорости ферментативных реакций. Основной недостаток мембранных систем - невозможность ферментативного превращения высокомолекулярных субстратов.
При иммобилизации ферментов с использование систем двухфазного типа ограничение свободы перемещения фермента в объеме системы достигается благодаря его способности растворяться только в одной из фаз. Субстрат и продукт ферментативного превращения распределяются между обеими фазами в соответствии с их растворимостями в этих фазах. Природа фаз подбирается таким образом, что продукт накапливается в той из них, где фермент отсутствует. После завершения реакции эту фазу отделяют и извлекают из нее продукт, а фазу, содержащую фермент, вновь используют для проведения очередного процесса. Одним из важнейших преимуществ систем двухфазного типа является то, что они позволяют осуществлять ферментативные превращения макромолекулярных субстратов, которые невозможны при применении жестких носителей с ограниченным размером пор.
Главным отличительным признаком химических методов иммобилизации является то, что путем химического взаимодействия на структуру фермента в его молекуле создаются новые ковалентные связи, в частности между белком и носителем. Препараты иммобилизованных ферментов, полученные с применением химических методов, обладают по крайней мере двумя важными достоинствами. Во-первых, ковалентная связь фермента с носителем обеспечивает высокую прочность образующегося конъюгата. При широком варьировании таких условий, как рН и температура, фермент не десорбируется с носителя и не загрязняет целевых продуктов катализируемой им реакции. Это особенно важно при реализации процессов медицинского и пищевого назначения, а также для обеспечения устойчивых, воспроизводимых результатов в аналитических системах. Вовторых, химическая модификация ферментов способна приводить к существенным изменениям их свойств, таких как субстратная специфичность, каталитическая активность и стабильность. Химическая иммобилизация ферментов является искусством, уровень которого определяется, в первую очередь, умением экспериментатора. Основная задача экспериментатора заключается в формировании новых ковалентных связей в молекуле фермента при использовании его функциональных групп, несущественных для проявления его каталитической активности. При химической модификации фермента его активный центр желательно защищать. При сопоставлении различных приемов иммобилизации химические методы для крупномасштабных биотехнологических процессов кажутся малопривлекательными из-за сложности и дороговизны. В промышленных процессах обычно используются те или иные методы физической иммобилизации.
Иммобилизованные ферментные препараты обладают рядом существенных преимуществ при использовании в прикладных (промышленных целях) производствах по сравнению с чистыми препаратами. Гетерогенный (иммобилизованный) катализатор легко отделить от реакционной среды, что обусловливает:
· возможность остановки реакции в любой нужный момент;
·повторное использование катализатора;
·получение конечного продукта, не загрязненного ферментом.
Последний момент весьма важен при производстве пищевых и медицинских продуктов. Применение иммобилизованного катализатора позволяет проводить ферментный процесс непрерывно и регулировать скорость реакции, а также изменять количество получаемого продукта в соответствии с изменениями скорости протока реакционной смеси. Иммобилизация или некоторая модификация фермента может обусловить изменения и некоторых его свойств (специфичность взаимодействия с субстратом; зависимость каталитической активности от рН, ионного состава
идругих параметров среды, а также его стабильность по отношению к различного рода денатурирующим воздействиям). Иммобилизация ферментов дает возможность регулировать их каталитическую активность за счет изменения свойств носителя.
Органические полимерные носители делятся на два класса:
1 - природные полимеры (подразделяются на группы в соответствии с их биохимической классификацией: полисахаридные, белковые и липидные носители.)
2 - синтетические полимерные носители (группы: полиметиленовые,
полиамидные и полиэфирные носители), используются для получения гелей
имикрокапсул.
Применение природных полимеров в качестве носителей аргументируется их доступностью и наличием свободных функциональных групп, легко вступающих в разнообразные химические реакции, а также их высокой гидрофильностью. К недостаткам следует отнести неустойчивость к воздействию некоторых микроорганизмов и относительно высокую стоимость многих из них.
Наиболее часто для иммобилизации ферментов используют целлюлозу,
декстран, агарозу и их производные. Для увеличения механической прочности целлюлозу гранулируют, что делает ее относительно дешевым и удобным для иммобилизации различных ферментов носителем. Однако она неустойчива к действию сильных кислот, щелочей и некоторых окислителей, что ограничивает области ее применения.
Хитин - природный аминополисахарид, напоминающий некоторым образом целлюлозу и является компонентом наружного скелета ракообразных, насекомых, а также входит в состав оболочек некоторых грибов. Являясь отходом промышленной переработки креветок и крабов, данное соединение имеется в достаточно больших количествах при относительно низкой стоимости. Препараты обладают высокой каталитической активностью и устойчивы к микробному воздействию.
Декстран - разветвленный полисахарид бактериального происхождения, содержащий остатки глюкозы.
Гели, приготовленные на основе декстрана, отличаются высокой стойкостью по отношению к различным химическим веществам, что делает их весьма широко используемыми в различного рода исследованиях и на
