
2054
.pdfразведении в 32 дм3 – 77,2 Ом-1см2. Вычислить значение эквивалентной электропроводности при бесконечном разведении.
Ответ: 364,8 Ом-1∙моль-1∙см2.
_________________________________________________________________
_________________________________________________________________
_________________________________________________________________
7.Константа электролитической диссоциации азотистой кислоты при 12,5 0С равна 4,6∙10-4. Вычислить степень электролитической диссоциации 0,05 н. раствора.
Ответ: 0,096 %.
_________________________________________________________________
_________________________________________________________________
8.Константа электролитической диссоциации ортоборной кислоты по первой ступени при 25 0С равна 5,8∙10-10. Вычислить степень электролитической диссоциации при разведении в 24 дм3.
Ответ: 0,012 %.
_________________________________________________________________
_________________________________________________________________
9.Эквивалентная электропроводность при 25 0С для раствора уксусной кислоты при разведении в 32 дм3 равна 8,2 Ом-1∙моль-1∙см2. Вычислить
константу электролитической диссоциации кислоты.
Ответ: 1,75∙10 -5.
________________________________________________________________
________________________________________________________________
________________________________________________________________
10.При 25 0С при разбавлении в 64 дм3 удельная электропроводность масляной кислоты С3Н7СООН - 1,812∙10-4 Ом-1∙см-1. Вычислить степень электролитической диссоциации, концентрацию ионов водорода и константу электролитической диссоциации. Подвижность иона С3Н7СОО- равна 40,3.
Ответ: 3,26 %; 5,09∙10-4 моль/ дм3; 1,70∙10-5.
_________________________________________________________________
_________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
11.Абсолютные скорости ионов серебра и хлора соответственно равны 5,7∙10-4 и 6,9∙10-4 см2/(с∙В). Вычислить эквивалентную электропроводность бесконечно разбавленного раствора хлорида серебра.
Ответ: 121,6 Ом-1∙моль-1∙см2.
_________________________________________________________________
_________________________________________________________________
_________________________________________________________________
11
ТЕМА 4.4. ЭЛЕКТРОДНЫЕ ПРОЦЕССЫ. ЭЛЕКТРОЛИЗ
Электрохимическими процессами называют процессы взаимного превращения химической и электрической форм энергии.
Электрохимические процессы можно разделить на две основные группы:
1)процессы превращения химической энергии в электрическую (в гальванических элементах);
2)процессы превращения электрической энергии в химическую (электролиз).
Простейшая электрохимическая система состоит из двух электродов, соединенных друг с другом металлическим проводником (внешней цепи) и ионного проводника между ними (растворы или расплавы электролитов). Электрод, на котором протекает процесс окисления, называется анодом. Электрод, на котором протекает процесс восстановления, называется катодом.
Электролизом называют химический процесс, то есть окислительновосстановительные реакции протекающие на электродах, при прохождении электрического тока через растворы или расплавы электролитов.
При электролизе электрод, соединенный с отрицательным полюсом внешнего источника постоянного тока, называется катодом (на нем идет восстановление), соединенный с положительным полюсом источника тока –
анодом (на нем идет окисление).
В любом растворяемом в воде электролите под влиянием полярных молекул воды или под влиянием нагрева безводного электролита наблюдается процесс диссоциации его молекул на ионы. Поэтому при погружении в электролит электродов, соединенных с источником тока, происходит направленное перемещение ионов: катионов (положительно заряженных ионов)
ккатоду, анионов (отрицательно заряженных ионов) - к аноду. Например, при электролизе раствора или расплава хлорида натрия (NaCl) ионы Na+ перемещаются к катоду (-), а ионы Cl- – к аноду (-).
Различают растворимые и нерастворимые аноды. К нерастворимым анодам относятся аноды, изготовленные из угля, графита или благородных металлов (золота, платины, палладия и т.п.). В этом случае к анодам перемещаются анионы кислотных остатков, и протекает соответствующий окислительный процесс. Например:
2Cl– – 2ē = 2Cl0 = Cl20↑;
2H2O – 4ē = 4H+ + O2↑.
К растворимым анодам относятся аноды, изготовленные из любых металлов, кроме благородных. В этом случае происходит окисление (растворение) самого анода
Ме0 – nē → Меn+.
Например, на медном аноде протекает следующий процесс
12
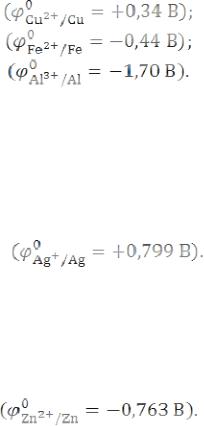
Cu0 – 2ē → Cu2+.
Cостав продуктов, полученных при электролизе определяется порядком восстановления катионов на катоде и анионов на аноде.
Катодные процессы при электролизе. Способность положительно заряженных ионов восстанавливаться на катоде определяется величиной их электродного потенциала. Чем больше численное значение величины φ, тем легче происходит восстановление.
При электролизе расплавов на катоде сначала восстанавливаются менее активные катионы, стоящие в ряду напряжений правее. Например:
Cu2+ + 2ē → Cu0;
Fe2+ + 2ē → Fe0;
Al3+ + 3ē → Al0;
При электролизе растворов последовательность разряжения ионов на катоде следующая.
1) Катионы металлов, стоящие в ряду напряжений правее водорода и имеющие положительные значения стандартных электродных потенциалов, всегда восстанавливаются из растворов. Например:
Ag+ + ē → Ag0;
2) Если катионы металлов занимают в ряду напряжений среднее положение (от марганца до водорода), то одновременно с восстановлением катионов металлов протекает процесс восстановления молекул воды с образованием газообразного водорода и ионов ОН-. Ионы ОН- соединяются с катионами металла с образованием основания. Например:
Zn2+ + 2ē → Zn0;
2H2O + 2ē → H2↑ + 2OH–; |
Zn2+ + 2OH– → Zn(ОН)2. |
Наиболее вероятно протекание 1-ого процесса – восстановления катионов металла.
3) Катионы металлов начала ряда напряжений, расположенные левее марганца, из водных растворов не восстанавливаются; их можно восстановить только из расплавов. Это связано с большим перенапряжением восстановления указанных металлов.
В водных растворах протекает восстановление молекул воды, а ионы металлов соединяются с ионами ОН-.
Например:
13

2H2O + 2ē → H2↑ + 2OH–, 2 Na+ + 2 OH– → 2 NaОН.
Продукты, образующиеся при электролизе на электродах в результате окислительно-восстановительных реакций, называются первичными продуктами электролиза. Продукты, образующиеся в растворе у электродов в результате вторичных реакций соединения, называются вторичными продуктами электролиза.
В приведенных примерах вторичными продуктами электролиза являются основания Zn(ОН)2 и NaОН.
Анодные процессы при электролизе. На аноде в первую очередь окисляются отрицательно заряженные ионы, которые имеют наименьшее значение электродного потенциала.
Пользуясь рядом стандартных окислительно-восстановительных потенциалов, можно приближённо установить порядок окисления анионов на аноде.
В первую очередь окисляются анионы бескислородных кислот (S2-, I–, Br–, Cl–, CN–), за исключением иона фтора. Например:
S2– – 2ē → S0;
Во вторую очередь окисляются молекулы воды:
2H2O – 4ē → O2↑ + 4H+;
Анионы кислородсодержащих кислот при электролизе водных растворов
участвуют во вторичных процессах соединения с ионами водорода. Например: SО42– + 2Н+ → Н2SО4.
Анионы кислородсодержащих кислот при электролизе расплавов
окисляются с образованием кислорода и соответствующего оксида. Например:
2SО42–– 4ē → O2↑ + 2SО3; 4РО43–– 12ē → 3O2↑ + 2Р2О5; 2СО32–– 4ē → O2↑ + 2СО2.
В третью очередь окисляются анионы OH–: 4OH– – 4ē → O2↑ + Н2О.
Рассмотрим примеры различных случаев электролиза.
1. Электролиз раствора хлорида меди с нерастворимым анодом.
Катодный процесс (–) |
CuCl2 ↔ Cu2+ + 2Cl–: |
Анодный процесс (+) |
|
Cu2+ + 2ē → Cu0. |
2Cl– – 2ē → Cl20↑. |
2. Электролиз раствора сульфата цинка с нерастворимым анодом. ZnSO4 ↔ Zn2+ + SО42–:
14
Катодный процесс (–) |
Анодный процесс (+) |
Zn2+ + 2ē → Zn0; |
2H2O – 4ē → O2↑ + 4H+; |
2H2O + 2ē → H2↑ + 2OH–; |
4H+ + 2SО42– → H2SO4. |
Zn2+ + 2OH– → Zn(OH)2. |
|
В данном примере вторичными продуктами электролиза являются: образовавшаяся у анода серная кислота и у катода гидроксид цинка. Цинк и кислород, образовавшиеся на электродах, являются первичными продуктами электролиза.
3. Электролиз раствора хлорида натрия с нерастворимым анодом.
NaCl ↔ Na+ + Cl–:
Катодный процесс (–) |
Анодный процесс (+) |
2H2O + 2ē → H2↑ + 2OH–; |
2Cl– – 2ē → Cl20↑. |
2Na+ + 2OH– → 2NaOH. |
|
В приведённом примере первичными |
продуктами электролиза являются |
газы – водород и хлор, вторичными - гидроксид натрия, образовавшийся у катода.
4. Электролиз раствора сульфата натрия с нерастворимым анодом.
|
Na2SO4 ↔ 2Na+ + SО42–: |
Катодный процесс (–) |
Анодный процесс (+) |
2H2O + 2ē → H2↑ + 2OH–; |
2H2O – 4ē → O2↑ + 4H+; |
2Na+ + 2OH– → 2NaOH. |
4H+ + 2SО42– → H2SO4. |
В данном случае, как и при электролизе кислородсодержащих кислот и щелочей, образуется 2 первичных (водород и кислород) и 2 вторичных (щелочь
икислота) продукта.
5.Электролиз расплава хлорида натрия.
NaCl ↔ Na+ + Cl–:
Катодный процесс (–) |
Анодный процесс (+) |
Na+ + ē → Na0. |
2Cl– – 2ē → Cl20↑. |
В приведённом примере первичными |
продуктами электролиза являются |
газ – хлор и металл – натрий. Вторичных продуктов нет. 6. Электролиз расплава сульфата натрия.
Na2SO4 ↔ 2Na+ + SО42–:
15
Катодный процесс (–) |
Анодный процесс (+) |
Na+ + ē → Na0. |
2SО42–– 4ē → O2↑ + 2SО3. |
В данном случае образуются 3 |
первичных продукта (натрий, кислород и |
оксид серы (VI)), вторичных продуктов нет.
7. Примером применения электролиза раствора с растворимым анодом служит рафинирование металлов, т.е. очистка их от примесей. Пример рафинирования меди с примесями Zn, Sn, Ag. Электролитом служит раствор соли меди, анодом – медь, загрязненная примесями, катодом – графит или пластинка из чистой меди. Прилагаемое из внешнего источника напряжение не превышает стандартный электродный потенциал меди ( 0,4 В).
|
CuCl2 ↔ Cu2+ + 2Cl–: |
|
Катодный процесс (–) |
Анодный процесс (+) |
|
Cu2+ + 2ē → Cu0. |
Zn0 |
– 2ē → Zn2+; |
|
Sn0 |
– 2ē → Sn2+; |
Cu0 – 2ē → Cu2+.
Медь растворяется и окисляется на аноде и восстанавливается и осаждается на катоде.
Для растворения серебра величина используемого напряжения недостаточна, и поэтому оно в нейтральном состоянии остается на дне электролизера в виде рыхлого осадка (в шламе).
Методом электролиза производится покрытие одного металла другим (гальваностегия), и наносятся металлические покрытия на неметаллические полупроводниковые подложки (гальванопластика).
Течение первичных анодных и катодных реакций подчиняется законам, установленным английским ученым М. Фарадеем (1834 г.).
1. Количество вещества m, образующегося под действием электрического тока, пропорционально количеству электричества, прошедшему через электролит q.
m |
|
kq, |
(13) |
но q |
|
I , |
(14) |
где I – сила тока в амперах, – время пропускания тока в секундах;
m kI , |
(15) |
k – коэффициент пропорциональности, равный количеству вещества, выделяемому при прохождении 1 кулона электричества (электрохимический эквивалент).
2. Масса различных веществ, выделенных одним и тем же количеством электричества, пропорциональны их химическим эквивалентам.
16
m1 |
|
Э1 |
, |
(16) |
|
m2 |
Э2 |
||||
|
|
|
где m – масса веществ, Э – эквивалентная масса веществ.
Для выделения одного эквивалента вещества любого вещества требуется пропустить через электролит одно и то же количество электричества, равное округленно 96500 Кл (число Фарадея).
Из |
пропорции |
Э |
|
k |
|
можно |
определить |
величину |
|
96500 |
|
||||||||
|
|
1 |
|
|
|
|
|
||
электрохимического эквивалента |
|
|
|
Э |
|
|
|
||
|
|
|
|
k |
. |
|
(17) |
||
|
|
|
|
|
|
||||
96500
Он равен химическому эквиваленту выделяемого электрическим током вещества, деленному на число Фарадея.
Подставив в уравнение (15) величину k (17), получим формулу, выражающую объединенный закон Фарадея.
m |
Э |
I . |
(18) |
|
96500
Соотношение (18) широко используется в количественных расчетах процессов при электролизе.
При практическом проведении электролиза всегда некоторая часть электрической энергии затрачивается на побочные процессы и теряется вследствие недостаточно хороших контактов. Важной характеристикой рентабельности установки для проведения электролиза является величина выхода по току η, %.
|
mпрак |
100 |
mпрак 96500 |
100, |
(19) |
|
mтеор |
ЭI |
|||||
|
|
|
|
|||
где mпрак количество |
фактически выделенного вещества, |
mтеор |
||||
количество вещества, которое должно было выделиться в соответствии с законом Фарадея.
На процесс электролиза оказывает существенное влияние величина плотности тока, т.е. сила тока, приходящаяся на единицу рабочей поверхности
электрода. Обычно плотность тока Iпл выражают в А/см2 или в А/дм2, |
|
||
Iпл |
I |
, |
(20) |
|
|||
|
S |
|
|
где S площадь поверхности электрода.
17

4.4.1. Расчеты, основанные на законе Фарадея Задача 3
Какая масса вещества выделится на катоде и какой объем газа выделится на аноде при электролизе водного раствора соли. В табл. 3 для каждого варианта приведены: химическая формула соли, сила тока и время проведения электролиза.
|
Исходные данные для решения задачи 3 |
|
Таблица 3 |
|||
|
|
|
|
|||
Вариант |
Соль |
Сила тока |
|
Время |
|
|
|
|
I, А |
|
|
|
|
1 |
Nа2SО4 |
2,4 |
|
5 мин. 45 с |
|
|
2 |
СuSO4 |
2,2 |
|
2 ч |
50 мин. |
|
3 |
ZnCl2 |
2,8 |
|
5 мин. 32 с |
|
|
4 |
КСl |
1,7 |
|
39 мин. 28 с |
|
|
5 |
СdCl2 |
3,6 |
|
42 мин. 17 с |
|
|
6 |
МgCl2 |
3,2 |
|
1 ч |
30 мин. |
|
7 |
СuSO4 |
0,4 |
|
2 ч |
40 мин. |
|
8 |
СuSO4 |
0,2 |
|
1 ч |
25 мин. |
|
9 |
NaCl |
10 |
|
6 ч |
20 мин. |
|
10 |
СdSO4 |
0,2 |
|
25 мин. 56 с |
|
|
11 |
Zn SO4 |
5,1 |
|
3 ч |
20 мин. |
|
12 |
Ni SO4 |
4,2 |
|
59 мин. 3 с |
|
|
13 |
NiCl2 |
0,9 |
|
1 ч |
57 мин. |
|
14 |
СuCl2 |
1,9 |
|
37 мин. 17 с |
|
|
15 |
К2SО4 |
12 |
|
4 мин. 30 с |
|
|
16 |
СdCl2 |
0,7 |
|
4 ч |
15 мин. |
|
17 |
АlCl3 |
9,2 |
|
27 мин. 5 c |
|
|
18 |
РtCl2 |
1,4 |
|
3 |
ч 40 с |
|
19 |
ZnCl2 |
7,1 |
|
1 ч |
27 мин. |
|
20 |
Nа2SО4 |
3,2 |
|
52 мин. 27 с |
|
|
П р и м е р
Сколько граммов меди выделится на катоде и какой объем газа при стандартных условиях выделится на аноде при пропускании тока в 4 А через раствор медного купороса в течение 18 мин?
Решение примера
Вычисляем эквивалентную массу меди, выделившуюся на катоде. Используем формулу (18).
m ЭCu I . 96500
Э |
|
MCu |
|
63,54 |
31,77; |
m |
|
31,77 4 1080 |
1,422 г. |
|
|
|
|||||||
Cu |
|
n |
|
2 |
|
Cu |
|
96500 |
|
|
|
|
|
|
|
|
18
На аноде будет выделяться кислород. Вычисляем массу выделившегося кислорода по формуле (18).
|
ЭO |
|
I |
|
|
8 4 1080 |
|||
m |
2 |
|
|
|
|
|
0,3581 г, |
||
|
|
|
|
|
|||||
O |
96500 |
|
|
|
96500 |
|
|||
2 |
|
|
|
|
|||||
|
Э |
|
|
16 |
|
8 г/моль. |
|||
|
|
|
|
|
|||||
|
O |
|
|
2 |
|
|
|
||
|
|
2 |
|
|
|
|
|
||
Объем кислорода находим из уравнения Д.И. Менделеева.
|
|
mO RT |
|
0,3581 8,313 298 |
|
3 |
||
VO |
|
2 |
|
|
|
0,000274 |
м |
|
MO p |
|
|
|
|||||
2 |
|
|
32 101325 |
|
|
|||
|
|
2 |
|
|
|
|
|
|
|
|
или |
VO |
|
= 0,274 дм3 = 274 см3. |
|
|
|
|
|
|
2 |
|
|
|
|
|
Решение задачи 3
1.Записываем уравнение электролитической диссоциации cоли, уравнения реакций на аноде и на катоде, а также суммарное уравнение электролиза.
_______________________________________________________________
_______________________________________________________________
_______________________________________________________________
_______________________________________________________________
2.Вычисляем массу вещества, выделившегося на катоде.
_______________________________________________________________
_______________________________________________________________
_______________________________________________________________
3.Вычисляем массу газа, выделившегося на аноде.
_______________________________________________________________
_______________________________________________________________
_______________________________________________________________
4.Находим объем газа, выделившегося на аноде из уравнения Д.И.Менделеева.
_______________________________________________________________
_______________________________________________________________
_______________________________________________________________
Задачи для самопроверки
1.Ток величиной в 2,2 А проходит через раствор медного купороса в течение двух часов. Какая масса выделившейся меди?
Ответ: 5,216 г.
__________________________________________________________________
_________________________________________________________________
_________________________________________________________________
19
2.Через раствор йодида бария пропускают ток 18 мин силой в 5,2 А. Какие реакции протекают на электродах? Какие вещества и в каком количестве выделятся на электродах?
Ответ: 0,059 г и 7,386 г.
_________________________________________________________________
_________________________________________________________________
_________________________________________________________________
_________________________________________________________________
_________________________________________________________________
3. Сколько граммов KOН образуется при электролизе раствора КС1, если на аноде выделилось 10,85 дм3 хлора, объем которого измерен при 22 0С и
99975 Па? Ответ: 49,65 г.
________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
4.Ток в 4,8 А выделяет из раствора платиновой соли 1,517 г платины в течение 10 мин 25 сек. Вычислить эквивалентную массу платины.
Ответ: 48,79 г/моль.
_________________________________________________________________
_________________________________________________________________
_________________________________________________________________
5. Сколько времени надо производить электролиз 20 см3 0,15 н. раствора сульфата кадмия током в 0,2 А для полного выделения кадмия, если выход по току составляет 93 %?
Ответ: 25 мин. 56 с.
_________________________________________________________________
_________________________________________________________________
_________________________________________________________________
_________________________________________________________________
_________________________________________________________________
_________________________________________________________________
_________________________________________________________________
6.При рафинировке меди ток в 50 А выделяет за 4 ч 224 г меди. Какой выход по току?
Ответ: 94,43 %.
_________________________________________________________________
_________________________________________________________________
_________________________________________________________________
7. Вычислить время, необходимое для получения электролизом одной тонны алюминия при величине тока в 20000 А и выходе по току 80 %.
Ответ: 186,3 ч.
20
