
3. ЭЛЕКТРОХИМИЯ
Процессы, сопровождающиеся возникновением электрического тока или протекающие под действием электрического тока, на-
зываются электрохимическими.
Раздел химии, изучающий электрохимические процессы, на-
СибАсчёт электрической энергии (под действиемДпостоянногоИэлектрического тока).
зывается электрохимией.
Электрохимические процессы нашли широкое применение в современной техн ке. Использование гальванических элементов обеспеч вает автономными и малогабаритными источниками энергии транспортные маш ны и двигатели, радиотехнические устройства и
приборы управлен я [1,3].
Электрох м ческ е системы представляют собой электрические цепи из проводн ков первого рода (металлы, полупроводники) и вто-
рого рода (растворы |
расплавы электролитов). В состав ЭС входят |
|
электроды. В простейшем случае электрод состоит из металла, нахо- |
||
дящегося в контакте с раствором электролита. |
||
Э.С. |
|
гальванические элементы |
подразделяются на |
электролизеры |
|
В электрохимических системах происходят взаимные превраще- |
||
ния электрической |
химической форм энергии. |
|
К гальваническим элементам относятся системы, в которых хи- |
||
мическая энергия превращается в полезную электрическую работу, |
||
т.е. гальванический элемент – источник получения электрического |
||
тока за счёт химической реакции. |
||
В электролизёрах или электролитических ячейках происходит |
||
обратный процесс, электролиз – протекание химической реакции за |
||
Гальванические элементы и электролизёры состоят из двух электродов: катода и анода.
На катоде протекают реакции восстановления, электроны переходят от электрода к иону (или молекуле).
28
Например: |
|
Сu2+ + 2е Сu0 |
(1) |
2Н2О + 2е Н2+ 2ОН- |
(2) |
На аноде протекают реакции окисления, электроны переходят
от иона (или молекулы) к электроду. |
|
СибАДИ |
|
Например: |
|
2Сl- – 2e Cl2 |
(3) |
Zn0 – 2e Zn2+ |
(4) |
2H2O – 4e O2 + 4H+ |
(5) |
Продукты перв чных реакций (2), (4), (5) нередко вступают в дальнейш е (втор чные) реакции, не связанные непосредственно с переносом тока онами.
Матер ал электрода может участвовать в электрохимической реакции (4), но может ыть и инертным (остальные реакции). В последнем случае на поверхности электрода могут выделиться металлы
(1) или газы (3),(5).
Совокупность двух электрохимических реакций, катодной и анодной, даёт химическую реакцию электролиза или реакцию, проте-
кающую в г.э. |
|
Например: (1) + (3) |
Сu2++ 2Сl- Сu0 + Cl2 |
(1) + (4) |
Сu2++ Zn0 Zn2+ + Сu0 |
Рассмотрим в качестве примера медно-цинковый г.э. Якоби-
Даниэля.
Этот элемент состоит из медной пластины, погруженной в раствор CuSO4 (медный электрод), цинковой пластины, погруженной в раствор ZnSО4 (цинковый электрод). Оба раствора соприкасаются друг с другом, но для предупреждения смешивания они разделены пористой перегородкой, а Me соединены между собой проводником. При работе элемента, т.е при замкнутой цепи, Zn окисляется.
29

-(А) |
2е |
|
|
+(К) |
|||
|
|
|
Zn |
|
|
|
Сu |
|
|
|
|
||||
|
|
|
|
|
|
|
|
СибАДИ |
||
Zn2+ |
SO42- |
Cu2+ |
Zn2+ |
SO42- |
|
ZnSO4 |
|
СuSO4 |
|
А (-) Zn0 – 2e Zn2+ |
|
Высвобождающ еся |
электроны движутся по внешней цепи к |
|
медному электроду. |
К (+) Cu2+ +2e Cu0 |
|
Суммарная реакция при работе гальванического элемента |
||
Zn° + Сu2+ Zn2+ |
+ Сu0 или Zn + CuSO4 ZnSO4 + Cu° |
|
Электроны переходят от восстановителя к окислителю по внешней цепи, а в растворе наблюдается направленное движение ионов. Гальванический элемент, основанный на описанном процессе, может служить источником получения электрического тока. Этот элемент был предложен в середине XlX в. русским учёным Якоби английским учёным Даниэлем. В настоящее время известно большое число других гальванических элементов подобного типа.
Схема гальванических элементов должна отражать процессы при работе гальванических элементов. Составим схему гальванического элемента Якоби-Даниэля:
А (-) Zn Zn2+ Cu2+ Cu (+) К
Э.Д.С. гальванического элемента равна алгебраической сумме отдельных скачков потенциала, возникающих на границе раздела различных фаз (Е1, Е2 – скачок на границе раствор – Ме; Ед – диффузионный скачок потенциала), т.к. на практике скачок потен-
30
циала на межфазной границе измерить нельзя, то Э.Д.С. гальванической цепи можно рассчитать как разность электродных потенциалов катода и анода (она может быть измерена как разность потенциалов фаз, находящихся на концах цепи)
Е = к - а,
где – электродный потенциал.
вязь между и концентрацией ионов Me в растворе выведена немецк м ф з ко-х м ком Вальтером Нернстом в 1888 г. и носит название уравнен я Нернста:
= 0 + RT/nF lnCMe+n,
где R – ун версальная газовая const = 8,314 Дж/К; Т – температура в кельвинах Т = 298 К;
F – ч сло Фарадея F = 96 487 Кулон; n – ч сло е, отданных атомом металла;
С – концентрац я |
онов металла. |
Подстав в значен |
я const в уравнение и переведя ln в lg, получим |
|
= 0 + 0,059/n lgCMe+n, |
где 0 – стандартный электродный потенциал,0 – потенциал металлического электрода в растворе собственных
ионов с их активностью, равной 1, или Э С гальванического элемента, составленного из данного электрода и стандартного электрода, потенциал которого принимаем за нуль.
Таким стандартным электродом является нормальный водородный электрод. Это платиновая пластинка, покрытая платиновой чернью (мелко-дисперсной платиной) для увеличения пористости электрода. Pt хорошо адсорбирует (поглощает) водород.
Нормальным водородным электродом считают платиновый электрод, погружённый в раствор с активностью ионов водорода =1 насыщенный водородом под давлением 1 атм.
+ |
|
|
СибАДИ |
||
Сн = 1 моль /л |
Н2 |
находится под давлением = 1 атм |
Н2 – 2е 2Н+ |
|
0 (Н2 / 2Н+) = 0 В |
Электродные потенциалы остальных систем измеряют относительно нормального водородного электрода.
1. Если данный электрод в цепи с Н.В.Э. является анодом, то его потенциал отрицательный.
31

A (-) Zn Zn2+ 2H+ H2, Pt (+) K
Замеряем Е = 0,76В Е = к – а к = 0
2. Если данный электрод в цепи с н.в.э. является катодом, то его электродный потенциал будет положительным.
СибАДИ |
|||
А (-) Рt , Н2 |
2Н+ Сu2+ |
Cu (+) К |
|
Замеряем Е = 0,341 3 В |
Е = к - |
а = 0,341 3 |
( а = 0) |
к0 = Е =0,34 В. Следовательно, стандартный электродный потенциал меди равен 0,34 В. Стандартные электродные потенциалы для большинства электродов определены и приводятся в табл. 1, 2.
Располагая Me в ряд по нарастанию величины их стандартных электродных потенц алов, мы получим так называемый ряд напря-
жений металлов.
Na+ |
Mg+2 |
Zn+2 |
Fe+2 |
Ni+2 |
Pb+2 Н+ Сu+2 Сu+ Аg+ Рt+2 Аu+3 |
-2,71 |
-2,36 |
-0,76 |
-0,44 |
-0,23 |
-0,13 0 0,34 0,52 0,8 1,2 1,5 В |
Ряд напряжений имеет не только большое теоретическое значение, но с его помощью можно разрешить ряд практических вопросов:
1. Металлы, стоящие в ряду до Н, взаимодействуют с кислотами, вытесняя водород:
Zn + 2HCl ZnCl2 + H2
2. Металлы, стоящие в ряду после Н, характеризуются химической инертностью не вытесняют водород из раствора кислот:
Ag + HCl
3. Любой металл, стоящий левее (т.е. предыдущий), вытесняет из растворов солей Me, стоящий правее (т.е. последующий):
Fe + CuCl2 Си0 + FeCl2
4. В гальваническом элементе металл, стоящий левее (с меньшим потенциалом) будет анодом, а металл стоящий правее – катодом. Пример: Г.э образован железной пластинкой, опущенной в 0,1М раствор FeSO4 и серебряной пластинкой, опущенной в 0,01М раствор
32
AgNO3. Составить схему г.э., |
написать уравнения электродных про- |
||
цессов, рассчитать Э.Д.С. г.э. |
|
||
0 |
Fe+2/Fe = -0,44 В; |
Fe – анод |
|
0 |
Ag +/Ag = 0,8 B; |
Ag – катод |
|
|
(-) Fe |Fe2+ || Ag+ | Ag (+) |
||
СибАДИ |
|||
A (-) Fe0 - 2e Fe2+ |
окисление |
||
К (+) Ag+ + 1e Ag° |
восстановление |
||
Fe+2/Fe = -0,44 + 0,059/2 Lgl0-1 = -0,47 ВAg+ /Ag = 0,8 + 0,059/1 Lg10-2 = 0,68 В E = k - а = 0,68- (- 0,47) = 1,15 В
Концентрац онные г.э. состоят из электродов одного Me, опущенных в растворы разной концентрации. Электрод с большой концентрац ей онов в растворе удет катодом, а с меньшей – анодом.
(-) Мg | Mg2+ ( 1) || Mg2+ (С2) | Mg (+) |
С1 С2 |
Электродные процессы, протекающие в электролизёрах |
|
Катодные процессы при электролизе. |
|
Катод заряжен отрицательно. На катоде |
протекают ре- |
акции восстановления. Способность положительно заряженных ионов восстанавливаться на катоде определяется величиной их электродного потенциала. Чем больше алгебраическая величина , тем легче
происходит восстановление. |
|
|
|
|
НАПРИМЕР: |
Ni 2+ |
Ag+ |
K+ |
Au+ |
0 , В |
-0,23 |
0,80 |
-2,9 |
1,69 |
|
(3) |
(2) |
(4) |
(1) |
Последовательность разряжения ионов на катоде:
1. Ионы металлов, стоящих в электрохимическом ряду напряжений после водорода, всегда восстанавливаются из расплавов и рас-
творов.
Me+n + ne Me0
2. Ионы металлов начала ряда напряжений (приблизительно до титана) из водных растворов не восстанавливаются; их можно восстановить только из расплавов.
33
В водных растворах протекает восстановление воды, а ионы металлов участвуют во вторичных процессах взаимодействия с гидроксильными группами с образованием оснований
2H2O + 2e H2 + 2OH- |
= - 0,41 В |
Me+n + nOH- Me(OH)n |
|
СибАДИ |
|||
3. Если металл стоит в средней части ряда напряжений, возможно |
|||
восстановлен е как |
она металла, так воды: |
|
|
|
|
Me+n + ne Me0 |
|
|
|
2H2O + 2e H2 + 2OH- |
|
|
Me+n + nOH- Me(OH)n |
|
|
Ионы металлов восстанавливаются из водных растворов раньше |
|||
воды. Первый процесс наи олее вероятен. |
|
||
Акт вные |
|
Металлы средней |
Неактивные |
металлы |
|
активности |
металлы |
Al |
Ti |
H |
|
H2O до H2, Me+n(ОН)n |
Me0 , H2O до H2 |
Me0 |
|
4. Анодные процессы при электролизе. |
|
||
Анод заряжен положительно. На аноде протекают реакции окисления. На аноде в первую очередь окисляются отрицательно заряженные ионы, которые имеют наименьшее значение электродного потенциала.
2H2О – 4e O2 + 4H+ |
= + 1,23 В |
Последовательность разряжения ионов на аноде
1. Кислотные остатки бескислородных кислот: Cl- I- Br-
Например: 2Cl- - 2e Cl2
В расплавах при разряжении кислотных остатков кислородосодержащих кислот образуются кислород и оксид соответствующего элемента.
Например: SO42- - 2e ½ O2 + SO3
В водных растворах кислотные остатки кислородосодержащих кислот не окисляются, а окисляются молекулы воды. Кислотные ос-
34
татки участвуют во вторичных процессах взаимодействия с ионами водорода с образованием соответствующих кислот.
Например: 2H2О – 4e O2 + 4H+ 2SO42- + 4H+ 2H2SO4
2. Если анод не инертный (как графитовый или платиновый), то происходит его окисление.
СибАДИНапример: Анод Zn0 – 2e Zn2+
Характерные случаи электролиза
1. Электрол з расплавов солей: ток
Na2SO4 2Na + ½ О2 + SO3 |
|||
Na2SO4 2 Na+ + SO42- |
|||
К (-) Na+ + e Na0 |
|
|
2 |
|
|||
A(+) SO42- - 2e ½O2 + SO3 |
|
|
1 |
|
|
ток |
|
LiC1 Li |
+ ½ C120 |
||
LiC1 ↔ Li+ + C1- |
|||
К (-) Li+ + e Li0 A (+) C1- - e- →½C120
2. Электролиз растворов:
а) Соль образована малоактивным металлом и бескислородной кислотой:
ток
uCl2 + H2O Сu0 + Cl20 + H2O
СuCl2 Сu2+ + 2Cl- К (-) u2+ + 2e Сu0
H2O
А (-) 2Cl- - 2e Cl2
H2O
б) Соль образована активным металлом и кислородосодержащей кислотой:
35
Электролиз раствора Mg(NO3)2 с инертным анодом
Mg(NO3)2↔ Mg2+ + 2NO3-
φ0 Mg2+/ Mg0 =- 2,38 В << φ0 (H2O/H2) + 2OH- = - 0,41 B
На катоде восстанавливается вода до образования водорода, а на
аноде окисляется вода до образования кислорода. У катода накапли- СибАДИваются ионы ОН-, у анода – ионы H+. При электролизе раствора
Mg(NO3)2 протекают реакции по уравнениям:
на катоде 2H2O + 2e→ H2 + 2OH-,
в растворе около катода Mg2+ + 2OH- → Mg(OH)2,
на аноде 2H2O - 4e → O2 + 4H+,
в растворе около анода 4NO3- + 4H+→ 4HNO3.
Так м образом, при электролизе раствора Mg(NO3)2 на катоде выделяется газоо разный водород, а у катодного пространства накапливается основан е (Mg(OH)2). На аноде выделяется газообразный
кислород, а у анодного пространства накапливается кислота HNO3.
в) Соль образована активным металлом и кислородосодержащей
кислотой с акт вным анодом:
Электролиз раствора NiSО4 с никелевым анодом
φ0Ni2+/Ni = - 0,23 B ≥ φ0H2O/H2+ 2OH- = - 0,41 B
Поэтому при электролизе нейтрального раствора NiSО4 на катоде идет восстановление в основном ионов Ni2+ и в небольшом количестве воды до водорода. На аноде происходит окисление металла. Так
как потенциал никеля меньше потенциала окисления воды
(φ0H2O = + 1,23 B) и потенциала окисления ионов SO42- (φ0 = + 2,01 В), то в данном случае электролиз сводится к растворению металла на
аноде выделению его на катоде. Реакция протекает по уравнениям:
на катоде Ni2+ + 2e- →Ni0,
2H2O + 2e→ H2 + 2OH-, на аноде Ni0 - 2e- → Ni2+.
Этот процесс применяется для электрической очистки никеля
(электролитическое рафинирование). Таким образом, в общем слу-
чае на аноде легче окисляются те атомы, молекулы и ионы, потенциалы которых в данных условиях наиболее низкие, а восстанавливаются на катоде легче те ионы, молекулы и атомы, потенциалы которых наиболее высокие.
г) Электролиз водного раствора щелочи.
36
Рассмотрим электролиз гидроксида калия КOH. |
|
|
||||
|
|
КOH ↔ К+ + OH- |
|
|
||
К (-) К+, H2O |
|
2H2O + 2e→ H2 + 2OH- |
|
2 |
||
|
|
|||||
А (-) ОН-, H2O |
4ОН- - 4е- → 2H2 O + O2↑ |
|
1 |
|||
|
4H2O + 4 |
ОН- → 2H2 + 4OH- + O2↑ |
|
|
||
|
|
|
2H2O → 2H2 + O2↑ |
|
|
|
СибАДИ |
||||||
д) Электрол з водного раствора кислоты HNO3. |
|
|
||||
|
HNO3 ↔ Н+ + NO3- |
|
|
|||
К (-) Н+, H2O |
|
|
2H+ + 2e→ H2 |
|
2 |
|
А (-) NO3-, H2O |
2H2O - 4e → O2↑+ 4H+ |
|
1 |
|||
|
2H2O + 4Н+ → 2H2 + 4H+ + O2↑ |
|
|
|||
|
|
|
2H2O → 2H2 + O2↑ |
|
|
|
|
|
|
Законы Фарадея |
|
|
|
m = ЭI / F |
V = Эv I / F |
|
|
|||
m – масса вещества, выделяющегося на электроде, г; |
|
|
||||
Э – эквивалентная масса вещества, г/моль; |
|
|
||||
I – сила тока, |
; |
|
I Q – количество электричества; |
|||
– время , сек |
|
|
||||
F – 96 500 К – это количество электричества, необходимое для выделения на электродах одного химического эквивалента любого вещества.
Для того чтобы найти эквивалентную массу выделившегося металла, нужно его молярную массу разделить на степень окисления.
Например: для меди получается Э = 64/2 = 32 г/моль Для того чтобы найти эквивалентный объём выделившегося газа,
нужно его молярный объём разделить на количество отданных или принятых электронов.
Например: для кислорода получается Эv = 22,4/4 = 5,6 л.
ЛАБОРАТОРНАЯ РАБОТА №3
ИЗГОТОВЛЕНИЕ ГАЛЬВАНИЧЕСКИХ ЭЛЕМЕНТОВ
Цель работы: экспериментально показать превращение химической формы энергии в электрическую.
37
Опыт 1. Изготовление медно-цинкового элемента Порядок выполнения: одну пробирку заполните доверху 1 М
раствором сульфата цинка, другую – 1 М раствором сульфата меди. Пробирки соедините электролитным мостиком, заполненным насы-
щенным раствором хлорида калия в смеси с агар-агаром. Опустите в СибАДИраствор сульфата цинка ZnSO4 цинковую пластинку, а в раствор
сульфата меди CuSO4 – медную (пластинки предварительно очистите наждачной бумагой). Пластинки соедините электрическим проводом с гальванометром. Наблюдайте отклонение стрелки гальванометра, указывающее на возн кновение электрического тока.
оставьте схему гальванического элемента. Напишите уравнения химическ х реакц й, протекающих на электродах гальванического элемента, суммарное уравнение химической реакции, в результате которой возн кает электрический ток в данном элементе.
Используя ч словые значения стандартных электродных потенциалов ц нка меди, вычислите ЭДС медно-цинкового гальванического элемента.
В каком направлении перемещаются электроны во внешней цепи? Какие ионы и в каком направлении перемещаются в растворе?
Опыт 2. Изготовление концентрационного гальванического элемента
Порядок выполнения: заполните две пробирки растворами сульфата меди разной концентрации: первую – 2 M раствором CuSО4, вторую – 0,2 M раствором CuSO4. Соедините пробирки электролитным мостиком. Опустите в каждую пробирку медные пластинки и соедините их проводками с гальванометром.
Составьте схему концентрационного гальванического элемента. Напишите уравнения химических процессов, протекающих на электродах.
Используя значение стандартного потенциала медного электрода уравнение Нернста, вычислите электродный потенциал катода и
анода, а также ЭДС концентрационного гальванического элемента.
Контрольные вопросы и задания
1.Дайте определение гальваническим элементам.
2.Из чего состоит гальванический элемент?
3.Механизм действия и принцип работы гальванического эле-
мента.
38
4.Водородный электрод и стандартные электродные потенциалы.
5.ЭДС гальванического элемента.
6.Понятие концентрационного гальванического элемента [7].
ЛАБОРАТОРНАЯ РАБОТА №4
СибАДИ |
|
ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВ СОЛЕЙ |
|
Цель работы: экспериментально показать превращение электри- |
|
ческой формы энерг |
в энергию химической реакции, подтвердить |
порядок разряжен я |
онов на электродах. |
Порядок выполнения ра оты. Клеммы "+", "-" выпрямителя со-
едините соответственно с клеммами стенда с надписью «Вход» длинными проводами. Короткими проводами соедините клеммы с надписью «Выход» с электродами, закрепленными в крышке. В химический стакан налейте соответствующий электролит, закройте крышкой с электродами. Для змерения силы тока по амперметру переведите рычаг на стенде в максимальное положение. Угольные электроды, бывшие в употре лении, тщательно зачистите наждачной бумагой.
Опыт 1. Электролиз водного раствора сульфата натрия с инертным анодом
Порядок выполнения: опустите в стакан с раствором сульфата натрия угольные электроды, соединенные с клеммами стенда. Что наблюдается на аноде и катоде? В катодное пространство капните несколько капель фенолфталеина. Как изменилась окраска раствора? Наличие какой среды подтверждает фенолфталеин? В анодное пространство капните несколько капель лакмуса. Как изменилась окраска раствора? Наличие какой среды подтверждает лакмус? Напишите уравнение реакций катодного анодного процессов, протекающих при электролизе водного раствора сульфата натрия. Какой газ выделяется на катоде, аноде?
Опыт 2. Электролиз водного раствора сульфата цинка с инертным анодом
Порядок выполнения: опустите в стакан с раствором сульфата цинка угольные электроды, соединенные с клеммами стенда. Что наблюдается на аноде и катоде? В анодное пространство капните несколько капель лакмуса. В какой цвет окрашивается раствор в анодном пространстве, почему? Какой газ выделяется на аноде и катоде?
39
Опыт 3. Электролиз раствора сульфата меди с активным анодом
Порядок выполнения: в стакан с водным раствором сульфата меди опустите угольный и медный электроды, соединенные с клеммами стенда. Какие процессы осуществляются на катоде и аноде? Напишите уравнения реакций. Выньте электроды и поменяйте их местами: медный электрод сделайте катодом, а угольный с имеющимся налетом меди – анодом. Какие процессы осуществляются на аноде и катоде? Нап ш те уравнения реакций. Какой газ выделяется на графи-
СибАДИЭто можно понять, если учесть, что корродируют обычно те металлы (чёрные цветные), которые встречаются в природе не в само-
товом аноде после счезновения медного налета?
Контрольные вопросы и задания
1. Понят е электролиза.
2. Процессы, протекающие на аноде при электролизе водных растворов солей.
3. Процессы, протекающие на катоде при электролизе водных растворов солей.
4. Процессы, протекающие на аноде при электролизе расплавов солей.
5. Процессы, протекающие на катоде при электролизе расплавов солей.
6. Законы Фарадея, выход по току.
7. Каково основное применение электролиза? [7].
4. КОРРОЗИЯ МЕТ ЛЛОВ
Коррозией называется процесс самопроизвольного разрушения
металлов при их контакте с окружающей средой.
Почему же разрушаются металлы?
родковом состоянии, а в виде оксидов, сульфидов и других соединений. Выделение металлов из природных соединений требует значительной затраты энергии (в доменном процессе), которая накапливается в них как свободная энергия Гиббса. Поэтому обратное превращение чистых металлов в окисленное состояние протекает с освобо-
ждением энергии и совершается самопроизвольно [2].
Ме+n + ne Ме° ( G > 0) |
Ме° - ne Ме+n ( G < |
0) |
Металлургия |
Коррозия |
|
40
Следовательно, металлическое состояние для большинства Me неустойчиво в различных средах.
Исключения составляют только Аu, Ag, Pt, Hg, т.е. которые встречаются в природе в свободном виде. ~ 20% ежегодно добываемого металла выбывает из употребления по причине коррозии.
практической точки зрения решающее значение принадлежит скорости коррозионного процесса.
При лабораторных испытаниях скорость коррозии (W) измеряют потерей ли увел чен ем массы металла ( m) с единицы площади (S)
|
в един цу времени (t) |
|
|
|
Балл стойкости |
|
стойкостиГруппа Скорость коррозии |
||||
|
|
W = m / S t (мг/ м2 год) |
|
||
СВ техн ке W коррозии о ычно измеряют толщиной слоя |
|||||
|
прокоррод ровавшего Me за единицу времени. |
|
|||
|
|
|
W = ∆l / t (мм / год) |
|
|
|
б |
|
|||
|
Существует 10альная шкала коррозионной стойкости металлов. |
||||
|
Совершенно стойк й |
|
W < 0,001(мм/год) |
|
1 |
|
|
|
А |
|
6 и 7 |
|
Относительно стойкий |
|
W = 0,1-1(мм/год) |
|
|
|
Нестойкий |
|
W > 10,0 (мм/год) |
|
10 |
Виды коррозионных разрушений
тельно небольшие участки и поражаютДнеглубоко.
Коррозия в зависимости от природы металла, агрессивной среды
и других условий приводит к различным видам разрушений.
1. Сплошная – распространяется на всю поверхность металла.
2. Местная – бывает различных типов:
б) Точечная коррозия – сосредоточена на очень малой поверхности, проникает глубоко в металл. Мало заметна глазу. Металл как будто бы проткнут тонкой иглой. Такого вида коррозия встречается часто на поверхности железных крыш.
а) Коррозия пятнами – поражения распространяются на сравни- И
в) Язвенная коррозия – глубокое поражение на отдельных участках, а остальная поверхность металла целая.
г) Межкристальная коррозия – самая опасная, это избирательное разрушение металла по границам кристалла. Внешне металл не изменяется, но при этом резко уменьшается его механическая прочность. Межкристальной коррозии подвержены нержавеющие стали, чугун, медные сплавы.
41
Классификация процессов коррозии
По механизму протекания все коррозионные процессы делятся на химические и электрохимические.
С1. Газовая корроз я.
К химической коррозии относятся процессы, которые протекают на одном и том же участке поверхности Me и не сопровождаются возникновен ем электрического тока. Этот вид коррозии является химической гетерогенной реакцией. К химической коррозии относят-
лейсгораниявнутреннего ). Наи олее часто она происходит под действием к слорода (поверхность Me покрывается слоем оксида).
ся:
2. Корроз в органических жидкостях - неэлектролитах (бензин, толуол т.д.).
объём шегося металла) > 1,Ато возникает оксидная плёнка, которая тормозит
Газовая корроз я протекает в газовой сухой атмосфере при высоких температурах (арматура нагревательных печей, детали двигате-
Если Vo ( о разовавшегося оксида)/ Vме (объём окислив-
протекание коррозии (например, Fe, Al, Zn, Ni, Be, Cr). Для них скорость коррозии со временем уменьшается.
При высоких температурах коррозионноактивные газы могут проникать внутрь металлическогоДсплава и окислять элементы, входящие в состав сплава. Так у стали при высоких температурах наряду с окислением происходит обезуглероживание:
2 Fe3С + О2 6 Fe + 2СО
Fe3C + СО2 |
3Fe + 2СО |
|
И |
Fe3C + H2О 3Fe + СО + Н2 |
|
При обезуглероживании теряется механическая прочность по- |
|
верхностного слоя стальных изделий, т.к. происходит разрушение це- |
|
мента. |
|
Электрохимическая коррозия – это окислительно-восстано- |
|
вительные процессы, проходящие на разных участках поверхности |
|
металла и сопровождающиеся |
появлением электрического тока, |
т.е. передвижением ее от одного участка к другому. Этот вид коррозии происходит в среде электролита, а окислительные процессы протекают по принципу работы гальванических пар.
Электрохимическая коррозия встречается чаще всего и наиболее опасна для металлов.
42

Общую схему электрохимического коррозионного процесса
можно представить в виде |
|
|||||
|
(-) А |
(основной Me) Ме –nё Ме+n (переход Me в раствор) |
||||
|
(+) К |
(примесь |
менее активного |
Me) Ох + nё Red |
||
|
(восстановление деполяризатора, находящегося в растворе). |
|||||
|
|
Деполяризаторы – вещества, |
которые могут присоединять |
|||
электроны, выполняя функцию окислителей. |
||||||
|
В зав с мости от рН среды различают кислородную или |
|||||
водородную деполяр зацию. |
|
|||||
рН<7 |
(+) К 2H+ + 2 е H2 водородная деполяризация |
|||||
С |
|
|
||||
|
|
среда |
деполяризатор, ион водорода кислот |
|||
|
К слотный остаток связывается с ионом прокородировавшего |
|||||
металла |
продуктом коррозии является соль. |
|||||
кислая |
|
|||||
рН>7 нейтральная |
щелочная среда (+)К О2 +2H2О + 4ё 4ОН- |
|||||
|
|
|
|
|
|
деполяризатор |
Пример: Записать процесс коррозии Fe в контакте с Сu в кислой сре-
де (Н2SO4)
Fe / CuбА– гальваническая пара
Fe = -0,44 ВCu = 0,34 B
микрогальванический элемент
(-) Fe| H2SO4 | Cu (+) |
|
(-) A: Fe – 2e Fe+2 |
|
Д |
|
(+) K: 2H+ |
+ 2e H2 |
Fe2+ + SO42- FeSO4 |
– продукт коррозии |
Пример: Записать процесс коррозии стальнойИпластины в водном растворе NaCl. Fe/Fe3C, NaCl – создаёт электропроводность раствора
А (-) Fe| O2, H2O, NaCl| Fe3С (+) К (-) А: Fe –2e Fe2+
(+) К: О2 + 2H2O + 4e 4OH- Fe2+ + 2OH- Fe(OH)2 4Fe(OH)2 + О2 + 2H2O 4Fe(OH)3
43
Коррозия с кислородной деполяризацией протекает в воде, влажном воздухе и почве.
В зависимости от характера агрессивной среды и условий протекания электрохимическая коррозия подразделяется на несколько
видов.
СНа поверхности любого металла, находящегося в атмосфере, образуется тонкая плёнка воды. В ней растворяются газы, находящиеся в атмосфере, так е как СО2, SO2, NO2, О2, NH3, образуя растворы кислот, щелочей, солей. Таким о разом создаются условия соприкосноMe с электрол том, которые представляют большую опасность
Атмосферная коррозия.
Этот вид коррозии наиболее распространён. Примерно 80% ме-
таллическ х конструкц й подвергается атмосферной коррозии.
венияПр мером является разрушение трубопроводов, находящихся в почве. Вызывается растворами солей, находящихся в почве. Существенным фактором является влажность почвы. В сухой почве коррозия практически не происходит.
для металл ческ х конструкций.
Почвенная корроз я.
Коррозия в растворах электролитов (морской воде, в растворах кислот, солей).
( )x = f (состава электролита, рН среды).
При понижении рН скорость коррозии для многих металлов по-
вышается (Fe, Zn, Mg и другие). |
|
бА |
|
Растворы с рН>7 являются опасными для амфотерных металлов |
|
(Al, Sn, Sb, Zn,Cr и других). |
|
Активаторами процесса коррозии являются ионы Сl-, Вr-, молеку- |
|
|
Д |
|
И |
лы NH3. Адсорбируясь на поверхности Me, они препятствуют образо- |
|
ванию пассивирующей плёнки. |
|
СПОСОБЫ ЗАЩИТЫ ОТ КОРРОЗ
1) Электрохимическая защита.
1. Протекторная защита.
2. Катодная защита. а) Протекторная защита.
К защищаемому предмету присоединяют Me с большей активностью – протектор (анод). В качестве протектора для железных изделий обычно применяют Zn, Mg или их сплавы. Протектор наклеивают или соединяют проводом с защищаемой конструкцией.
44
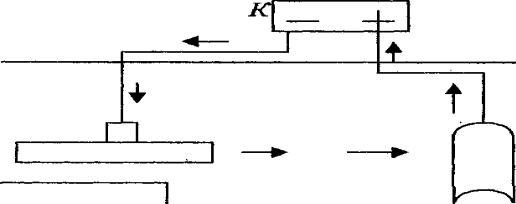
Они оказывают друг на друга поляризующее действие. Zn / Fe
(А) (К) -0,76 В; -0,44 В
Zn окисляется, а на Fe идёт процесс восстановления окислителя
(A) Zn-2e Zn+2
СибАДИ(K) 2H2O + O2 + 4e 4OH-
Протекторная защита применяется в средах, хорошо проводящих
электр ческ й ток, т. е. в морской воде, для защиты подводных частей морск х судов.
) Катодная защ та.
Защ щаемую конструкцию искусственно делают катодом электрохим ческой с стемы (т.е. присоединяют к минусу – полюсу источника электр ческой энергии) при подлежащей силе тока в цепи, на защищаемом здел происходит восстановление окислителя, процесс же ок слен я претерпевает вещество анода.
защищаемый трубопровод анодное заземление (какой-либо металл)
2) Обработка коррозионной среды:
Пригоден, когда защищаемое изделие эксплуатируется в ограниченном объёме жидкости.
Метод состоит:
1. B удалении или снижении концентрации веществ, вызывающих коррозию.
а) удаление О2 кипячением воды или пропусканием воды через фильтр металлической стружки; б) замена воздуха инертным газом;
в) применение осушителей для уменьшения влажности.
45
2. В добавлении к этому раствору ингибиторов. |
|
||||
Ингибиторы – вещества, |
вызывающие замедление или полное |
||||
прекращение коррозии. В |
зависимости от |
природы Me |
и рас- |
||
твора |
применяются различные ингибиторы: |
|
|
||
- жидкофазные – K2Cr2O7, K2CrO4 , Na2SiO3, Na3PO4, |
|
||||
С |
|
|
|
|
|
- парофазные - летучие амины – С6H5N, (СН2)6 N4. |
|
||||
Защитное действие ингибиторов объясняется адсорбцией их на |
|||||
поверхность Me с образованием защитных плёнок. |
|
||||
3) Защ тные покрытия. |
|
|
|
||
живан |
|
|
|
||
Пр меняются для защиты изделии из пористых сталей |
|
||||
а) Металл ческ е покрытия – применяют Me, образующие на |
|||||
своей поверхности защ тные плёнки (Cr, Ni, Zn, Al, Sn и др.). |
|
||||
Их можно раздел ть на анодные (Zn, Сr) и катодные (Ni, Sn и |
|||||
|
бА |
|
|||
др.). Основное тре ование – |
еспористость. Покрытия наносят на ос- |
||||
нован е Me разл чными спосо ами: гальваническим, горячим (залу- |
|||||
|
е), распылен е. |
|
|
|
|
б) Неметалл ческ е покрытия: |
|
|
|||
- |
орган ческ е: краски, лаки, полимеры (полиэтилен и др.). |
||||
- |
неорганические: |
эмали, основой которых является силикат. |
|||
Для длительной защиты от атмосферной коррозии металлических со- |
|||||
оружений, деталей машин, при оров чаще всего применяют лакокра- |
|||||
сочные изделия. |
|
|
|
|
|
в) Химические покрытия: |
|
|
|
||
Покрытия, создаваемые химической обработкой мeталлов. |
Пред- |
||||
ставляют собой в основном защитные оксидные или солевые плёнки. |
|||||
1. Оксидирование – создание на поверхности Me слоя оксидов. |
|||||
Осуществляется термическим, химическим |
и электрохимическим |
||||
|
|
|
И |
||
способом. Д Примером оксидирования является воронение стальных изделий –
кипячение в течение 20 – 60 мин обезжиренных и очищенных изделий в растворе NaOH, NaNO3, NaNO2. На поверхности стали образуется пленка Fe3О4 черного цвета с синеватым оттенком.
Электрохимическое оксидирование – анодирование – применяется для защиты Al, Mg и их сплавов. Детали присоединяются к аноду, а затем проводят электролиз в растворах Н2SO4, H2Cr2O7, H2CrO4.
На А (+) протекает следующий процесс:
SO42-+ Н2О –2е SO42- + 2Н+ + О – взаимодействует с поверхностью изделия, и она быстро покрывается плотной оксидной плёнкой.
46
2. Фосфатирование – процесс образования фосфатных плёнок на поверхности металлических изделий (для защиты изделий из чугуна, сталей, сплавов Mg, Al). Процесс проводят в горячем растворе гидро-
фосфатов марганца или железа (FeHPO4 и MnHPO4) или в растворе |
|
Zn(H2РО4 )2 |
|
С |
Fe3(PO4)2↓ + H2 |
Fe + 2FeHPO4 |
|
|
ЛАБОРАТОРНАЯ РАБОТА №5 |
ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ КОРРОЗИИ
Цель работы: рассмотреть влияние различных факторов на скорость корроз , сравн ть скорости химической и электрохимической корроз .
Опыт 1. |
|
коррозия оцинкованного и лу- |
Электрохимическая |
|
|
женого железа |
|
|
Порядок выполнения: в |
|
налейте 4 – 6 капель раство- |
ра соли железа (II) FеSO4, до авьте 1– 2 капли раствора K3 [Fe(CN)6] |
||
– красная пробиркукровяная соль – качественная реакция на ионы Fе2+, на- |
||
блюдайте появление синего |
окрашивания вследствие образования |
|
Налейте в чистуюАпробирку на 3/4 ее объема дистиллированной воды и добавьте по 4 – 5 капель 2 N серной кислоты и K3 [Fe(CN6)]. Раствор перемешайте, отлейте половину во вторую пробирку. В первую
турнбулевой сини Fe3[Fe(CN)6]2.
пробирку опустите железную пластинкуДв контакте с оловом, во вторую
– железную пластинку в контакте с цинком. В какой пробирке появилась синяя окраска? Почему? Наблюдается выделение газа. Какой это газ? С поверхности какого металла поднимается газ в луженом и оцинкованном железе? Составьте схему электрохимической коррозии. В каком случае будет проходить коррозия железа при нарушении защитного слоя?В каком случае будет разрушаться защитное покрытие?
Опыт 2. Влияние образования микрогальванических элемен- |
|
тов на коррозию металлов |
И |
|
|
Порядок выполнения: а) В две пробирки внесите по 5 – 6 капель |
|
2N серной кислоты и бросьте по кусочку цинка. В одну из пробирок |
|
добавьте одну каплю раствора сульфата меди. Наблюдайте более ин- |
|
тенсивное выделение водорода в пробирке с добавлением CuSO4. Что появилось на поверхности цинка в присутствии CuSO4? Объясните
47
различную интенсивность выделения водорода в двух пробирках, учитывая, что цинк с медью образуют микрогальванический элемент. Укажите анод и катод в образовавшейся гальванической паре. Напишите уравнения соответствующих реакций.
б) В пробирку внесите 5 – 6 капель 2N серной кислоты и кусочек цинка, опустите туда же медную проволоку так, чтобы она не каса-
Ссоприкосновен е с ц нком и наблюдайте интенсивное выделение водорода. Обрат те вн мание, на каком из металлов выделится водород. Объясн те, какова роль медной проволоки, в присутствии которой водород выделяется нтенсивнее.
лась цинка. Наблюдайте слабое выделение водорода на цинке и отсутств е его на медной проволоке. Приведите медную проволоку в
пробирки одбАнаковые кусочки алюминия. Сравните скорость выделе-
Опыт 3. Акт ваторы коррозии Порядок выполнения: в две пробирки порознь налейте по 7– 8
капель сульфата хлорида меди (одной концентрации) и внесите в
ния меди на кусочках алюминия в обеих пробирках. В пробирку с раствором CuSO4 до авьте кристаллик NаС1. Объясните, какой ион ускоряет коррозию алюминия. Напишите уравнения реакций.
|
Контрольные задания |
|
1. |
Понятие коррозии. |
Д |
|
||
2. |
Виды коррозионных повреждений. |
|
3. |
Классификация процессов коррозии. |
|
4. |
Методы защиты от коррозии. |
|
5. |
Электрохимическая коррозия в кислой среде электролита. |
|
|
|
И |
6. Электрохимическаякоррозиявнейтральнойсредеэлектролита[9].
5. ОРГАНИЗМ И СРЕ А
Основные среды жизни
Вся совокупность естественных условий существования, окружающих живые организмы, с которыми они находятся в постоянном взаимодействии, называется средой обитания. На нашей планете живые организмы освоили четыре основные среды обитания, сильно различающиеся по специфике условий. Водная среда была первой, в
48
которой возникла и распространилась жизнь. В последующем живые организмы овладели наземно-воздушной средой, создали и заселили почву. Четвертой специфической средой жизни стали сами живые организмы, каждый из которых представляет собой целый мир для населяющих его паразитов или симбионтов.
Среда обитания – это совокупность биотических и абиотических условий жизни. Составные части и свойства среды многообразны и изменч вы. Любое ж вое существо живет в сложном, меняющемся мире, постоянно пр спосабливаясь к нему и регулируя свою жизне- организмадеятельность в соответствии с его изменениями. Сочетание условий среды, на более благоприятное для жизни и размножения данного
, называется его оптимумом [5].
бАВодная среда обитания
Спец ф ческ е свойства водной среды – большая плотность,
сильные перепады давления, относительно малое содержание кислорода и элементов п тания, сильное поглощение солнечных лучей, солевой режим, скорость горизонтальных перемещений (течений), содержание взвешенных частиц. Обитатели водной среды получили в экологии общее название гидро ионтов.
Лимитирующим фактором водной среды жизни является свет. Существование фотосинтезирующихДорганизмов возможно лишь в верхних слоях, куда проникает достаточно солнечного света (эуфотическая зона, фотосфера). В прозрачных водах океана даже на глубину 140 м проникает около 1% солнечной радиации, а в небольших озерах с мутной водой на глубину 2 м всего лишь десятые доли процента. Быстрое убывание количества света сИглубиной связано с поглощением его водой. Лучи с разной длиной волны поглощаются неодинаково: красные исчезают уже недалеко от поверхности, тогда как сине-зеленые проникают значительно глубже. Сгущающиеся с глубиной сумерки (дисфотосфера) в океане имеют сначала зеленый, затем голубой, синий и сине-фиолетовый цвет, сменяясь, наконец, постоянным мраком (афотическая зона). С глубиной в водной среде жизни зелёные водоросли сменяются на бурые и красные, что является проявлением адаптации к убыванию солнечного света.
В темных глубинах океана в качестве источника зрительной информации организмы используют свет, испускаемый живыми существами. Свечение живого организма получило название биолюминес-
49
ценции. Светящиеся виды есть почти во всех классах водных животных от простейших до рыб, а также среди бактерий, низших растений и грибов. Биолюминесценция имеет в жизни животных в основном сигнальное значение.
Водной среде присуща высокая плотность, поэтому многие её обитатели имеют обтекаемую, торпедовидную форму тела. Животных, способных к быстрому плаванию и преодолению силы течений, объединяют в эколог ческую группу нектона («нектос» – плавающий). Представ тели нектона – рыбы, кальмары, дельфины. Для ориентации в водной среде у многих гидробионтов развита эхолокация.
Взвешенные, парящие в воде организмы объединяют в особую |
||
С |
|
|
эколог ческую группу гидро ионтов – планктон («планктос» – паря- |
||
щий). Планктонные организмы о ладают многими сходными адапта- |
||
циями: 1) |
увел |
чение относительной поверхности тела за счет |
уменьшен я размеров, сплющенности, удлинения, развития много- |
||
выростов |
ли щетинок, что увеличивает трение о воду; |
|
численных |
||
2) уменьшен |
е плотности за счет редукции скелета, накопления в теле |
|
жиров, пузырьков газа |
т. п. Водоросли (фитопланктон) парят в во- |
|
де пассивно. Многие виды зоопланктона способны к вертикальным |
||
общее миграциям в толще водыАна десятки и сотни метров как за счет актив-
ного передвижения, так и за счет регулирования плавучести своего тела. Особую разновидность планктона составляет экологическая группа нейстона («нейн» – плаватьД) – обитатели поверхностной пленки воды на границе с воздушной средой.
Обитателей морского дна объединяют под общим названием бентос. Они либо перемещаются по дну, либо зарываются в грунт.
Для водной среды характерно низкое содержание кислорода, что вызвано его плохой растворимостью в воде.ИВ насыщенной кислородом воде содержание его не превышает 10 мл/л, это в 21 раз ниже, чем в атмосфере. Поэтому условия дыхания гидробионтов значительно усложнены. Кислород поступает в воду в основном за счет фотосинтетической деятельности водорослей и диффузии из воздуха. С повышением температуры и солености воды концентрация в ней кислорода понижается. Среди водных обитателей много видов, способных переносить широкие колебания содержания кислорода в воде, вплоть до почти полного его отсутствия (эвриоксибионты – «окси» – кислород, «бионт» – обитатель). Среди рыб очень слабое насыщение воды кислородом могут выдерживать сазан, линь, караси. Вместе с тем ряд видов – стеноксибионтны – может существовать лишь при
50
достаточно высоком насыщении воды кислородом (радужная форель, кумжа, гольян). Дыхание гидробионтов осуществляется либо через поверхность тела, либо через специализированные органы – жабры, легкие, трахеи.
Большинство водных обитателей пойкилосмотичны: осмотическое давление в их теле зависит от солености окружающей воды. Поэтому для гидробионтов основной способ поддерживать свой солевой
СПресноводные формы не могут существовать в морях, морские – не переносят опреснен я. Если соленость воды подвержена изменениям, животные перемещаются в поисках благоприятной среды. Позвоночные ж вотные, высш е раки, насекомые и их личинки, обитающие в
баланс – это збегать местообитаний с неподходящей соленостью.
ми Это связаноболеес ф з ческ свойствами воды (высокой удельной теп-
воде, относятся к гомойосмотическим видам, сохраняя постоянное осмотическое давлен е в теле независимо от концентрации солей в воде.
Температурный режим водоемов более устойчив, чем на суше.
лоемкостью). Ампл туда годовых колебаний температуры в верхних слоях океана не 10–15˚C, в континентальных водоемах – 30–35˚C. Глубокие слои воды отличаются постоянством температуры. В связи с устойчивым температурным режимом воды среди гидробионтов в значительно ольшей мере распространена стенотермность (спосо ность существовать в узком интервале темпера-
тур). Эвритермные виды (способные переносить большие перепады |
|
температуры) встречаются в основном в мелких континентальных во- |
|
А |
|
доемах и в прибрежной зоне морей высоких и умеренных широт, где |
|
значительны суточные и сезонные колебания температуры. Благодаря |
|
высокой теплоёмкости вода служит регулятором климатических |
|
процессов глобального масштаба. |
|
Д |
|
|
И |
Наземно-воздушная среда жизни
Наземно-воздушная среда – самая сложная по экологическим условиям. Жизнь на суше потребовала таких приспособлений, которые оказались возможными лишь при достаточно высоком уровне организации растений и животных.
Для наземно-воздушной среды обитания характерны: низкая плотность воздуха, большие колебания температуры (годовая амплитуда до 100˚С), высокая подвижность атмосферы, хорошая обеспе-
51
ченность кислородом. Лимитирующим фактором наземно-воздушной среды является температура. Для наземно-воздушной среды обитания характерно многообразие жизненных форм организмов. Роль атмосферы в сообществах важна, так как поддерживает биотический круговорот веществ.
СОдной из форм приспособления к резким колебаниям температуры наземно-воздушной среды обитания является появление пойкилотермных ( зменяющ х температуру тела в зависимости от температуры окружающей среды) и гомотермных (теплокровных, сохраняю-
бочка, а к гомотермным – заяц и медведь.
приспособленностьщих температуру тела постоянной) животных. Например, к пойкилотермным об тателям наземно-воздушной среды относятся змея и ба-
Н зкая плотность воздуха определяет наличие собственной
опорной бАстемы, поддерживающей тело: растения – механическими
тканями, ж вотные – скелетом, способностью к полету. Анемофилия – растений к опылению с помощью ветра. Ветром опыляются все голосеменные, а среди покрытосеменных анемофиль-
ные растен я составляют примерно 10% всех видов. У многих видов развита анемохория – расселение с помощью воздушных потоков. Пассивно переносимые потоками воздуха организмы получили в совокупности название аэропланктона, по аналогии с планктонными обитателями водной среды. К аэропланктону относятся споры, пыль-
очень мелкими размерами (напримерД, семена орхидей), либо разнообразными крыловидными и парашютовидными придатками, увеличивающими их способность к планированию.
ца, семена растений, микроорганизмы и мелкие животные. Специальные адаптации для пассивного полета – очень мелкие размеры тела, увеличение его площади за счет выростов, сильного расчленения,
большой относительной поверхности крыльев, использование паути-
ны. Анемохорные семена и плоды растений обладают также либо И
Газовый состав воздуха в приземном слое атмосферы (тропосфере) довольно однороден в отношении содержания главных компонен-
тов (азот – 78,1 %, кислород – 21,0, аргон – 0,9%, углекислый газ – 0,035 % по объему). Однако различные примеси газообразных, ка- пельно-жидких и твердых (пылевых) частиц, попадающих в атмосферу из локальных источников, могут иметь существенное экологическое значение.
Высокое содержание кислорода способствует повышению обмена веществ у наземных организмов по сравнению с водными. Кислород,
52
из-за постоянно высокого его содержания в воздухе, не является фактором, лимитирующим жизнь в наземной среде.
одержание углекислого газа может изменяться в отдельных участках приземного слоя воздуха в довольно значительных пределах. Например, при отсутствии ветра в центре больших городов концентрация его возрастает в десятки раз. Закономерны суточные изменения содержания углекислоты в приземных слоях, связанные с ритмом фотос нтеза растен й. Сезонные изменения обусловлены изменения-
ми интенс вности дыхания живых организмов, преимущественно |
||
микроскоп ческого населения почв. Повышенное насыщение воздуха |
||
углекислым газом возн кает в зонах вулканической активности, возле |
||
С |
|
|
термальных |
сточн ков других подземных выходов этого газа. В |
|
высок х концентрац ях углекислый газ токсичен. В природе такие |
||
концентрац |
встречаются редко. |
|
В пр роде основным источником углекислоты является так назы- |
||
ваемое почвенное |
. Почвенные микроорганизмы и животные |
|
дыхание |
||
дышат очень |
нтенс вно. Углекислый газ диффундирует из почвы в |
|
атмосферу, |
энергично во время дождя. |
|
Азот воздуха для |
ольшинства обитателей наземной среды пред- |
|
особенно ставляет инертный газА, но ряд прокариотических организмов (клу-
беньковые бактерии, азото актерии, сине-зеленые водоросли и др.) обладает способностью связывать его и вовлекать в биологический круговорот. Д
Местные примеси, поступающие в воздух, также могут существенно влиять на живые организмы. Это особенно относится к ядовитым газообразным веществам – метану, оксиду серы, оксиду углерода, оксиду азота, сероводороду, соединениям хлора, а также к частицам пыли, сажи и т. п., засоряющим воздухИв промышленных районах. Оксид серы (SО2), например, ядовит для растений даже в концентрациях от одной пятидесятитысячной до одной миллионной от объема воздуха. Вокруг промышленных центров, загрязняющих атмосферу этим газом, погибает почти вся растительность. Некоторые виды растений особо чувствительны к SО2 и служат чутким индикатором его накопления в воздухе. Например, многие лишайники погибают даже при следах оксида серы в окружающей атмосфере. Присутствие лишайников в лесах вокруг крупных городов свидетельствует о высокой чистоте воздуха. Устойчивость растений к примесям в воздушной среде учитывают при подборе видов для озеленения населенных пунктов. Чувствительны к задымлению, например, обыкно-
53
венная ель и сосна, клен, липа, береза. Наиболее устойчивы туя, тополь канадский, клен американский, бузина и некоторые другие.
Почва как среда обитания
Свойстваобитан я. земной поверхности, оказывающие экологическое воздейств е на ее о итателей, объединяют названием эдафиче-
реда, которая занимает промежуточное положение между на- земно-воздушной и водной, представляет собой рыхлый поверхностный слой земной коры, образовавшийся в процессе выветривания, деятельности ж вых организмов, разложения органических остатков и перемеш ван я полученных веществ, называется почвенной средой
скиефакторы среды (от греч. «эдафос» – основание, почва). Для почвенной средыбАхарактерны не ольшие колебания температуры, плотное сложен е, нал ч е в порах воды и воздуха, малое содержание кислорода. Главная осо енность почвенной среды – постоянное поступление орган ческого вещества, в основном за счет отмирающих растений опадающей л ствы.
Почва – это сложная трехфазная система, в которой твердые частицы окружены воздухом и водой. Она пронизана полостями, заполненными смесью газов и водными растворами, и поэтому в ней складываются чрезвычайно разноо разные условия, благоприятные для жизни множества микро- и макроорганизмовД. В почве сглажены температурные колебания, наличие грунтовых вод и проникновение осадков создают запасы влаги и обеспечивают режим влажности, проме-
жуточный между водной и наземной средой, создаются запасы орга-
нических и минеральных веществ, поставляемых отмирающей растительностью и трупами животных. Все это определяетИбольшую насыщенность почвы жизнью. В среднем на 1 м2 почвенного слоя приходится более 100 млрд клеток простейших, миллионы коловраток и тихоходок, десятки миллионов нематод, десятки и сотни тысяч клещей и коллембол, тысячи других членистоногих, десятки тысяч энхитреид, десятки и сотни дождевых червей, моллюсков и прочих беспозвоночных. Кроме того, 1 см2 почвы содержит десятки и сотни миллионов бактерий, микроскопических грибов, актиномицетов и других микроорганизмов. В освещенных поверхностных слоях в каждом грамме обитают сотни тысяч фотосинтезирующих клеток зеленых, желтозеленых, диатомовых и сине-зеленых водорослей. Живые организмы столь же характерны для почвы, как и ее неживые компоненты. По-
54
этому В. И. Вернадский отнес почву к биокосным телам природы, подчеркивая насыщенность ее жизнью и неразрывную связь с ней.
|
Почва обеспечивает около 95% продовольственных ресурсов для |
|||||
населения планеты. Значение почвы как основного средства сельско- |
||||||
хозяйственного производства определяется ее основным свойством – |
||||||
С |
|
|
|
|
||
плодородием. Под плодородием понимают способность почвы удов- |
||||||
летворять потребность растений в элементах питания, воде, воздухе и |
||||||
тепле для нормального роста и развития. |
|
|||||
|
Уровень плодород я почвы определяется, прежде всего, химиче- |
|||||
кальцием |
|
|
||||
ским составом |
|
ф з ко-химическими свойствами: высоким содер- |
||||
жанием гумуса |
доступных для растений форм азота, фосфора, калия |
|||||
и друг х п тательных элементов, наличием микроэлементов, близкой |
||||||
к |
нейтральной |
реакц |
среды, |
насыщенностью преимущественно |
||
|
избытком |
|
||||
|
, н зк м содержанием поглощенного кислорода, отсутстви- |
|||||
ем |
поглощенного натрия и |
|
легкорастворимых солей. |
|||
Гу́ мус(лат. humus «земля, почва») – слой почвы, составляющий ос- |
||||||
новную часть её орган ческого вещества (до 90%). Гумус содержит |
||||||
питательные элементы, нео ходимые высшим растениям и образую- |
||||||
|
|
|
А |
|||
щиеся в результате |
иохимического превращения растительных и |
|||||
животных остатков; он является важным критерием при оценке плодородности почвы.
В зависимости от потре ности в плодородии различают эвтрофные и олиготрофные растения. Растения, способные развиваться только на плодородной почве, называются эвтрофными, к ним, например, относятся дуб черешчатый и сныть обыкновенная. Если рас-
тение нетребовательно к уровню плодородия, способно развиваться |
|
на бедных питательными веществами почвах, оно относится к классу |
|
|
И |
олиготрофных. Это сосна обыкновенная, хвощ полевой, вереск, сфаг- |
|
новые мхи. |
Д |
Живые организмы как среда обитания
Среда жизни, в которой организмы вступают в специфические взаимоотношения со своим биотопом и только через него осуществляют связь с внешней средой, называется организменной. Характерными особенностями организменной среды являются защищенность от непосредственного воздействия факторов внешней среды, неограниченность пищевых ресурсов, но ограниченность жизненного пространства.
55
Использование одними живыми организмами других в качестве среды обитания – очень древнее и широко распространенное в природе явление. Организмы, для которых средой жизни служат другие живые организмы, называются паразитами. В зависимости от того, обитают паразиты внутри другого организма или на его поверхности,
Сразличают эндопаразитов и эктопаразитов.
Эндопаразиты обитают в специфических условиях внутренней среды хозя на. Это, с одной стороны, дает им целый ряд экологических пре муществ, а с другой – затрудняет осуществление их жиз-
пищейненного ц кла по сравнению со свободноживущими видами.
Одно з главных преимуществ паразитов – обильное снабжение за счет содерж мого клеток, соков и тканей тела хозяина или содерж мого его к шечника. Вторым важным экологическим пре-
имуществомбАявляется защищенность от непосредственного воздейст-
вия факторов внешней среды (угроз высыхания, резких колебаний температур, знач тельных изменений солевого и осмотического режимов т. п.). Мног е внутренние паразиты характеризуются в эволюции втор чным упрощением строения, вплоть до потери целых систем органов.
Основные экологические трудности, с которыми сталкиваются внутренние сожители живых организмов, – это ограниченность жизненного пространства для тканевых и особенно внутриклеточных обитателей, сложности снабжения кислородом, трудность распространения от одной особи хозяев к другим, а также защитные реакции
У многоклеточных обитателейДвнутриорганизменной среды вырабатывается преимущественно анаэробный тип обмена. Необходимая для работы клеток энергия высвобождаетсяИза счет разных видов брожения. Среда обитания паразитов ограничена как во времени (жизнью хозяина), так и в пространстве. Поэтому основные адаптации направлены на возможность распространения в этой среде, передачи от одного хозяина к другому за счет повышенной способности к раз-
организма хозяина против паразитов.
множению, выработке сложных жизненных циклов, использование переносчиков и промежуточных хозяев.
Большой круг паразитов обитает не внутри, а на поверхности тела хозяина. Такие организмы называются эктопаразитами. Последний в этом случае выступает лишь как часть внешней среды паразита, снабжая его пищей, предоставляя убежище, трансформируя микроклимат. Связь эктопаразита с хозяином может быть постоянной или
56
временной. Для постоянных или длительно связанных с хозяином эктопаразитов одна из основных жизненно важных экологических задач
– удержаться на теле хозяина. В связи с этим типичные эктопаразиты обычно характеризуются наличием мощных органов прикрепления –
присосок, крючьев, коготков и т. п., которые независимыми путями развиваются у самых разных по происхождению видов [6].
СибАДИтропогенные.
ЛАБОРАТОРНАЯ РАБОТА №6
ОРГАНИЗМ И СРЕДА
Цель работы: рассмотреть влияние экологических факторов на живые орган змы, научиться различать виды адаптаций живых орга-
низмов к среде о |
тан я. |
|
|
|
|
|
|
Порядок выполнен я: оформите в виде таблицы сравнительные |
|||||||
характер ст ки всех сред жизни и ответьте на вопросы. |
|||||||
|
|
|
|
|
|
|
|
Характеристи |
Плотность |
Перепады |
Количество |
|
Перепад |
Освещённость |
|
ки |
|
среды |
температур |
кислорода |
давления |
|
|
Среда жизни |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
||
1. Что такое |
«среда обитания»? Назовите основные среды жизни. |
||||||
2. Что называется экологическими факторами? |
з приведённого |
||||||
перечня факторов выпишите: а) абиотические; ) биотические; в) ан- |
|||||||
Температура воздуха; плотность популяции; плодородие почвы; строительство автомагистрали; освещённость земной поверхности; хищничество; добыча нефти; рыболовство; сезонная миграция птиц; воздухопроницаемость почвы; высота над уровнем моря; симбиоз; интродукция новых видов растений; солевой состав воды озера; паразитизм; захоронение радиоактивных отходов.
3. Из приведённого списка факторов выпишите:
а) климатические; б) эдафогенные; в) орографические; г) химические. Осадки, газовый состав атмосферы; механический состав почвы; экспозиция склонов; теплопроводность почвы; высота над уровнем
57

моря; длина светового дня; солевой состав воды; атмосферное давление; рельеф местности; плодородие почвы; микроэлементный состав почв; температура воздуха.
4. Из приведённого списка факторов выпишите: а) фитогенные; б) зоогенные; в) микробогенные.
Деятельность азотфиксирующих бактерий; создание особого СибАДИмикроклимата в еловом лесу; строительство бобрами плотин на реках; выработка к слорода синтез органического вещества зелёными растениями; массовая г бель животных из-за вспышки инфекционного заболеван я; подавлен е жизнедеятельности ряда бактерий из-за выделения особых веществ (фитонцидов) в сосновом бору; регуляция численности копытных хищниками; строительство гнёзд птицами; переработка л стового опада в простые минеральные соединения
микроорган змами.
5. Какой фактор называется лимитирующим? Укажите лимитирующ е факторы для следующих организмов:
Ель; форель; волга; тигр; эвкалипт; воробей; дуб; северный олень; вирус холеры.
6. Дайте определение понятию «адаптация». Объясните механизм возникновения адаптаций. Какие виды адаптаций вы знаете? Подпишите, какой вид адаптации вы видите на рис.1–8.
Рис. 1. Камбала Рис.2. Верблюд
58
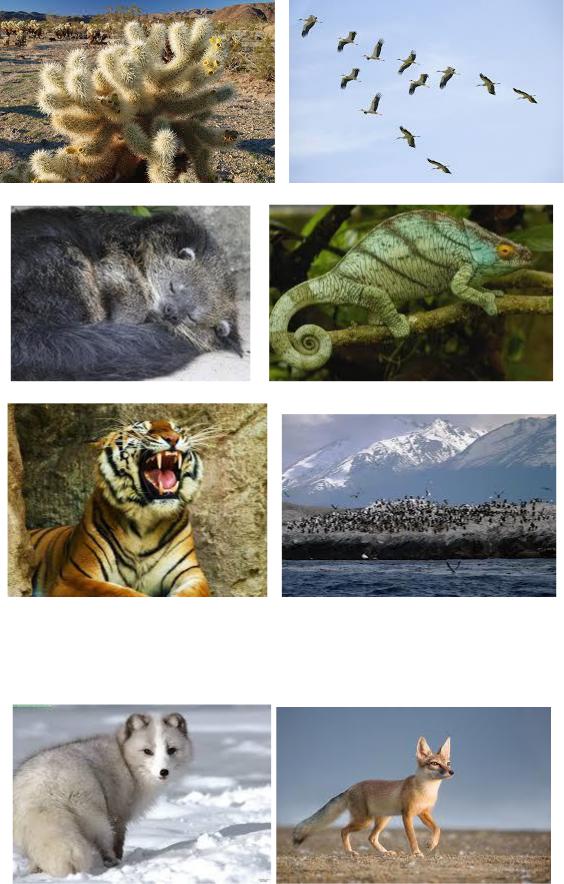
СибАДИ |
||
Р |
с. 3. Кактус |
Рис. 4. Журавли |
Р |
с.5. Сурок |
Рис. 6. Хамелеон |
Рис. 7. Тигр |
Рис. 8. Птичий базар |
|
7. Поясните суть правила Бергмана – Алена на основе следующих фотографий (рис.9 – 12):
Рис. 9. Песец (полярная лисица) |
Рис. 10. Корсак (степная лисица) |
59
