

Министерство образования и науки РФ Федеральное государственное бюджетное образовательное учреждение высшего образования
«Сибирский государственный автомобильно-дорожный университет (СибАДИ)»
СТ. . Х м ч и О НОВЫбАХИМИИ И ЭКОЛОГИИ
Лабораторный практикум
 Д
Д


 И
И
Омск – 2018

УДК 54 ББК 24
Х76
__________________________
Согласно 436-ФЗ от 29.12.2010 «О защите детей от информации, причиняющей вред их здоровью и развитию» данная продукция маркировке не подлежит.
____________________________
Рецензенты:
д-р биол. наук, проф. А.В. Синдирева (ОмГАУ); СибАДИканд. техн. наук, доц. Е.А. Бедрина (СибАДИ)
Работа утверждена редакционно-издательским советом СибАДИ в качестве лабораторного практ кума.
Х м ч, Татьяна Сергеевна.
Х76 Основы х м экологии[Электронный ресурс] : лабораторный практикум / Т.С. Х м ч. – Электрон. дан. – Омск : СибАДИ, 2018. – URL: http:// bek.sibadi.org/cgi-bin/irbis64r plus/cgiirbis 64 ft.exe. - Режим доступа: для авторизованных пользователей.
Содержит краткое изложение теоретического материала, а также указания по выполнению ла ораторных ра от по дисциплине «Основы химии и экологии».
Имеет интерактивное оглавление в виде закладок.
Предназначен для студентов всех форм обучения направления «Технология транспортных процессов».
Подготовлен на кафедре «Техносферная и экологическая безопасность».
Текстовое (символьное) издание (1,9 МБ)
Системные требования: Intel,3,4 GHz; 150 Мб; Windows XP/Vista/7; DVD-ROM; 1 Гб свободного места на жестком диске; программа для чтения pdf-файлов: Adobe Acrobat Reader; Foxit Reader
Редактор О. . Соболева Техническая подготовка Н.В. Кенжалинова
Издание первое. Дата подписания к использованию 04.05.18 Издательско-полиграфический комплекс СибАД. 644080, г. Омск, пр. Мира, 5 РИО ИПК СибАДИ. 644080, г. Омск, ул. 2-я Поселковая 1
ФГБОУ ВО «СибАДИ», 2018
ВВЕДЕНИЕ
Лабораторный практикум предназначен для студентов всех форм обучения направления «Технология транспортных процессов». В
практикуме перед каждой лабораторной работой приводится краткое Сизложение необходимого теоретического материала. Рассмотрены основные аспекты химической кинетики: скорость реакции, различные факторы, вл яющ е на нее и основные законы, описывающие скорость реакц , а также условия смещения химического равновесия. Освещены вопросы электрохимии: даны понятия гальванического элемента электрол за, коррозии металлов, рассмотрены электрохипроцессы, протекающие в электрохимических системах.
Изложены основные аспекты взаимодействия среды и живых организмов, пр ведены различные экологические факторы и законы, опи-
стоятельнолабораторныхпровер ть степень овладения изученным материалом по дисциплине «ОсновыАхимии и экологии».
сывающ е |
вл ян е на организмы. Далее изложены методики вы- |
|
полнен я |
|
от. После каждой работы приведены кон- |
мическ |
||
трольные вопросы |
задания для того, чтобы студенты могли само- |
|
Д И
3
1.ХИМИЧЕСКАЯ КИНЕТИКА
ИХИМИЧЕСКОЕ РАВНОВЕСИЕ
Химическая кинетика изучает скорость и механизм химических |
|
реакций, а также зависимость их от различных условий. Реакции про- |
|
С |
|
текают с разными скоростями: от долей секунд до минут, дней, деся- |
|
тилетий. |
|
Например: |
BaCl2 + H2SO4 BaSO4 + 2HCl |
зависимостиот па х мической реакции (гомогенная или гетероген- |
|
|
(белый осадок мгновенно) |
Na2S2O3 + H2SO4 Na2SO4 + SO2 + H2O + S ( елая муть спустя некоторое время)
корость х м ческой реакции равна изменению количества вещества в ед н цу времени в единице реакционного пространства. В
ная) меняется характер реакционного пространства.
Гомогенные реакц |
протекают в одной фазе (все газы, жидкие рас- |
|
творы). |
|
|
Гетерогенные реакции протекают на границе раздела фаз, например |
||
твердой и жидкой, газоо разной и жидкой. |
||
Реакционным |
пространством гомогенных реакций является |
|
|
|
Д |
объем, заполненный реагентами, а отношение количества вещества к |
||
единице объемабАназывается концентрацией (C), следовательно, ско- |
||
рость гомогенной реакции равна изменению концентрации исход- |
||
ных веществ или продуктов реакции во времени. |
||
|
|
υ = (C2 – C1)/ (τ2 – τ1) = C/ τ, |
где С1 |
|
И |
и С2 – концентрации исходного вещества в момент времени |
||
τ1 и τ2. |
Знак минус означает уменьшение концентраций исходных ве- |
|
ществ. |
|
|
Измеряется [моль дм-3 с-1] или [моль л-1 с-1].
Скорость гетерогенной реакции – это количество вещества,
вступающего в реакцию или образующегося при реакции за единицу времени на единице поверхности фазы.
υ = n / S τ,
n – число г-моль вещества, S –площадь поверхности фазы.
Единицы измерения скорости – [моль с-1].
4
Скорость реакции зависит:
1. От природы реагирующих веществ (некоторые реакции, например взрывы, протекают мгновенно, некоторые могут идти годами).
2. От концентрации реагентов. |
|
3. |
От температуры. |
С |
|
4. |
От катализатора. |
5. |
От внешнего воздействия (например излучения). |
6. |
От степени змельчения твердых веществ, от среды для реак- |
ц й, протекающ х в растворах.
Наиболее важное значение имеют первые четыре фактора, поэтому мы рассмотр м х подробнее.
реаг рующ х веществ |
|
|
|
|
2 NO + O2 2 NO2 |
протекает очень быстро |
|
||
2 CO + O2 2 CO2 |
протекает медленно, поэтому отравляются CO. |
|||
Природа |
|
|
|
|
Концентрац я реагентов |
|
|
|
|
Молекулы, атомы, ионы неупорядоченно движутся. Чтобы про- |
||||
изошла реакция, нео ходимо столкновение реагирующих частиц. При |
||||
T=const число столкновений растет при увеличении числа реагирую- |
||||
щих частиц в единице о ъема, следовательно, |
скорость реакции уве- |
|||
личивается с увеличением концентрации реагирующих веществ. |
||||
Влияние концентрации на скорость реакции выражает закон дей- |
||||
ствующих бАмасс, установленный в 1867 г. норвежскими учеными |
||||
Гульдбергом и Ваге (действующими массами раньше называли кон- |
||||
центрации реагирующих веществ) [3]. |
|
|
||
Скорость химической реакции равна произведению константы |
||||
скорости на концентрации реагирующих веществ в степенях их |
||||
|
Д |
|||
стехиометрических коэффициентов, называемых порядками ре- |
||||
акции по реагентам. |
|
|
|
|
Например: скорость необратимой реакции |
|
|||
|
bB + dD qQ + mM равна |
|||
|
υ = k [B]nb |
[D]nd, |
И |
|
|
|
(1) |
||
где k-константа скорости реакции или коэффициент пропорциональности зависит от природы реагентов, температуры и катализатора и не зависит от концентрации веществ.
5
k имеет физический смысл: численно равна скорости реакции, когда |
||||||
концентрация реагирующих веществ равна 1. |
||||||
nb, nd – коэффициенты, называются порядками реакции по веществам |
||||||
B и D. |
|
|
|
|
|
|
уравнение (1) называется кинетическим уравнением химической ре- |
||||||
С |
|
|
|
|
||
акции. |
|
|
|
|
|
|
Например: |
|
|
|
H2(г) +I2(г) 2HI(г) |
||
Особенностикинетики гетерогенных реакций |
||||||
|
υ = k CH2 |
CI2 |
или |
υ= k [H2] [I2] |
||
|
|
|
2NO2(г) 2NO(г)+O2(г) |
|||
|
особенностью |
υ = k C2 NO2 |
||||
|
|
υ = k [NO2]2 |
или |
|||
Гетерогенные реакции идут на поверхности раздела фаз, которые |
||||||
|
|
|
А |
|||
и служат реакционным пространством (поверхностью), следователь- |
||||||
но, первой |
|
|
|
кинетики этих реакций является влия- |
||
ние площади реакционной поверхности на скорость реакции. Если |
||||||
площадь =S, то |
|
υ = k C S, |
|
|||
|
|
|
|
|
Д |
|
где C – концентрация реагента (газообразного или жидкого).
Если в реакции непосредственно участвует твердое вещество, то в кинетическое уравнение не входит его концентрация, так как она постоянна. Роль твердого тела в кинетике отражается путем введения площади его поверхности, на которойИидет реакция, в кинетическое уравнение.
Например: CaO(к)+СO2(г) СaCO3 (к)
υ =k [CO2] SCaO
Влияние температуры на скорость реакции
Повышение температуры ускоряет большинство химических реакций. С повышением температуры увеличивается тепловое движение молекул, что приводит к увеличению частоты столкновений и, следовательно, увеличению скорости. Но не любое столкновение приводит к химическому взаимодействию. Если бы каждое столкновение при-
6
водило бы к взаимодействию, то все реакции протекали бы со скоростью взрыва.
Химическое взаимодействие происходит в том случае, когда частицы сближаются на расстояния, при которых становится возможным перераспределение электронной плотности и возникновение новых химических связей. ледовательно, сталкивающиеся частицы должны быть активированными, обладать энергией активации.В них расшатаны старые химические связи. Неакт в рованные молекулы сталкиваются друг с другом и
разлетаютсянепрореаг ровав. |
|
Уравнен е Вант-Гоффа |
|
С |
|
Экспер ментальные данные свидетельствуют о справедливости |
|
правила Вант-Гоффа, который установил: |
|
повышен |
ли пон жение температуры на каждые 10 (10К) увели- |
чивает ли замедляет скорость многих реакций в 2 – 4 раза [2]. Ма- |
|
тематическоевыражен е
гих реакцийбАлежит в пределах 2–4. Но есть и отступления. Особенно увеличивается значение в энзиматическихДпроцессах (ферментативных) =7 и выше. Кроме того, известны реакции с отрицательным.
υ2 = υ1 γ (T2-T1) / 10,
где υ2 и υ1 – скорости реакций при температурах Т2 и Т1.
γ – температурный коэффициент, значение которого для эндотерми-
ческой реакции выше, чем для экзотермической (γэнд > γэкз). Для мно-
При повышении температуры такие реакции замедляются. Примером может служить реакция
2 NO + O 2 NO
Причина лежит в своеобразии её внутреннего2 2Имеханизма. Реакций с отрицательным известно немного.
Уравнение Аррениуса
Для связи константы скорости реакции с энергией активации и температурой в 1889 г. шведский ученый С. Аррениус на основании экспериментов вывел уравнение, которое носит его имя [1,3].
k =k0 е–Ea/RT,
7
где k – константа скорости реакции,
k0 – предэкспоненциальный множитель (общее число столкновений между молекулами в секундах),
е – основание натурального логарифма, |
(2,7) |
Еа – энергия активации, определяемая природой реакции (ее значения для химических реакций лежат в пределах 40–400 кДж/моль),
T – температура в К,
R – ун версальная газовая постоянная = 8,31 Дж/моль.
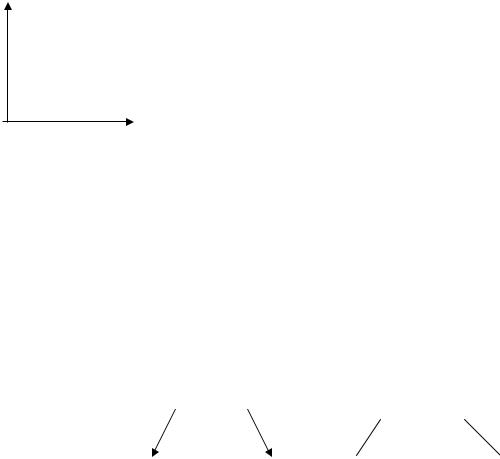
Из уравнен я в дно, что чем больше энергия активации и энтропия акт вац , тем на большее влияние температуры на скорость реакции. Уравнен е можно представить в логарифмической форме
Ln k =Ln k0-Ea/RT |
или |
Lgk=Lg k0-Ea/2,3RT |
||
Граф ческое изо ражение уравнения |
||||
Ln Еа |
Если при изменении температуры концентрация |
|||
|
реагентов остается постоянной, то можно записать |
|||
1/Т |
|
зависимость скорости от температуры |
||
υ = υ0 е-Ea/RT |
||||
|
||||
Энергия активации. Что такое Еа? |
Почему она влияет на скорость |
|||
реакции? Чтобы ответить на этот вопрос, необходимо рассмотреть |
||||
механизм реакции. В ходе химической реакции разрушаются одни и |
||||
возникают другие |
молекулы |
соединения, происходит изменение |
||
химических связей. Как показали исследования, в ходе реакции система проходит через переходное состояние, через образование активированного комплекса.
Например: Рассмотрим механизм реакции образования 2НI
(H2+I2 2HI) |
|
|
|
|
СибАДИ |
||||
H2 |
Н ----|---- Н |
|
Н |
Н |
I2 |
I -------|-------- I |
I |
|
I |
|
|
|||
активные |
активированный |
|
новые молекулы |
|
молекулы |
комплекс |
|
|
|
8
Активные молекулы H2 и I2 при столкновении образуют активированный комплекс H2 ……I2 .В активированном комплексе старые связи ещё не разорвались, но уже ослаблены, новые связи наметились, но ещё не образовались. Время существования его невелико (10-13 сек). В этом комплексе связи H–I образовываются одновремен-
но с разрывом связей H–Н и I–I. При распаде комплекса образуются |
|
СибАДИ |
|
либо продукты реакции, либо исходные вещества. Для образования |
|
активированного комплекса необходима энергия. Система в переход- |
|
ном состоян |
меет более высокую энергию, чем в исходном (Еисх ) |
и конечном (Екон ) состояниях.
Энерг я, необход мая для перехода вещества в состояние активированного комплекса, называется энергией активации.
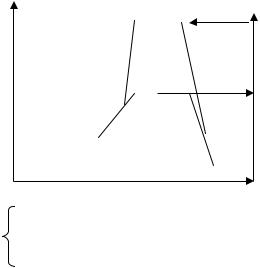
Рассмотр м энергетическую диаграмму образования йодоводорода по реакц H2+I2 2HI
Е – потенц альная энергия
|
2H+2I |
|
|
|
Е1 – энергия, необходимая для полного |
|
|
разрыв связей в исходных молекулах |
|
|
571 КДж |
H2+I2 |
|
Е2–энергия активации комплекса 168 КДж |
|
||
|
|
2HI |
путь реакции 1 путь – через полный разрыв связи в исходных молекулах;
2 путь – через образование активированного комплекса.
Путь через образование активированного комплекса энергетически более выгоден, чем путь через полный разрыв связи реагирующих молекул. Поэтому подавляющее большинство реакций проходит через образование активированных комплексов.
Итак, Еa – это энергия, необходимая для перехода частиц в состояние активированного комплекса. Частицы, энергия которых выше или равна энергии активации, называются активными. С ростом температуры растёт доля этих частиц и соответственно скорость реакции. С увеличением Еa уменьшается доля активных молекул и скорость реакции. Экзотермические реакции протекают с меньшей энергией активации, чем эндотермические. Высокая энергия активации является причиной того, что многие химические реакции при невысоких температурах не протекают, хотя и принципиально возможны ( G < 0).
9

Например, в обычных условиях самопроизвольно не загораются: дерево, ткани, бумага, уголь, хлеб, керосин, хотя G реакций окисления < 0.
По уравнению можно рассчитать отношение констант скорости реак-
ции при 2-х температурах (или отношение скоростей), если известно Еа |
|||||
(или наоборот). |
|
|
|
|
|
СибАДИ |
|||||
Предэкспоненциальный множитель |
|
||||
Кроме энерг акт вации важным условием осуществления химиче- |
|||||
ской реакц |
является ориентация молекул в момент столкновения. Как |
||||
показывает опыт, не каждое столкновение даже активных частиц приво- |
|||||
диткх м ческойреакц . |
|
|
|
||
НАПРИМЕР: в реакц |
Н2О + СО возможна различная их ориента- |
||||
ция относ тельно друг друга. |
|
|
|||
Н |
С = О |
|
|
|
|
О + |
→ |
О = С = О + Н - Н |
(1) |
||
Н |
|
|
|
|
|
Н |
|
|
|
|
|
O + О = С |
→ |
Н2О + |
С - О |
(2) |
|
Н |
|
|
|
|
|
В 1-м случае ориентация молекул благоприятствует, а во 2-м пре- |
|||||
пятствует осуществлению реакции. |
|
|
|||
Вывод : k0 – предэкспоненциальный множитель отражает частоту |
|||||
столкновения |
и ориентацию реагирующих частиц. |
Принципиально |
|||
возможная реакция протекает при соблюдении 2-х условий: доста- |
|||||
точной энергии и надлежащей ориентации частиц. |
|
||||
Уравнение Аррениуса позволяет |
проводить более точные расчеты, |
||||
чем уравнение Вант-Гоффа. |
|
|
|||
Например, покажем зависимость скорости реакции от температуры для синтеза воды из водорода и кислорода.
При 20 потребовалось бы 54 млрд лет. При 500 С потребовалось бы 50 мин. При 700 С реакция протекает мгновенно.
Температура на процессы гетерогенных реакций оказывает очень сложное влияние, так как воздействует не только на скорость реакции, но и на процессы диффузии, на летучесть или растворимость продуктов реакции. Но все равно влияние однозначно: увеличение температуры увеличивает скорость реакции.
10
Влияние катализатора на скорость реакции
Введение катализатора чаще ускоряет реакции. Явление изменения скорости реакции под действием катализатора называется катализом, а реакции каталитическими. Наиболее мощным средством интенсификации химических реакций является применение катализаторов,
т. е. веществ, которые ускоряют химические реакции, но сами при этом нерасходуются входереакции.
СибАДИют G, H). Если G > 0, то в присутствии катализатора она не станет самопроизвольной, Н > 0 – реакция эндотермическая, то в при-
Например: смесь Al I2 при комнатной температуре не обнаруживает признаков вза модействия, но достаточно капли воды, чтобы вызвать бурную реакц ю.
Хотя катал т ческ е процессы были известны давно (изготовление сп рта, уксуса, в на), однако лишь в 19 в. было обращено внимание на х характерные осо енности. На скорость реакции оказывает влиян е не просто катализатор, а даже концентрация введенного катализатора. Мног е катализаторы обладают селективностью (избира-
тельностью) [10]. |
|
|
Например: |
|
Th - торий |
Al2O3, ThO2 |
|
|
C2H5OH |
C2H4 + H2O |
|
этанол |
этилен |
|
Ni , Fe , Ag , Cu |
O |
|
|
||
C2H5OH |
CH3 - C |
+ H2 |
этанол |
|
H |
|
|
|
|
уксусный |
альдегид |
Катализаторы не |
влияют на термодинамику реакции (не изменя- |
|
сутствии катализатора она не станет экзотермической. Катализаторы могут ускорять наступление химического равновесия. Катализатор увеличивает константу скорости химической реакции, следовательно, в одинаковой степени влияет на k скоростей прямой и обратной реакции. Катализаторы уменьшают полную энергию активации процесса. Активированный комплекс с катализатором имеет меньшую энергию, чем комплекс без катализатора, следовательно, Еа реакции > Еа каталитической реакции.
11

Допустим, между веществами А и В возможно взаимодействие с образованием соединения АВ ( G 0).
А + В → А…..В → АВ, но энергия активации этой реакции очень высока и скорость реакции 0.
2HI H2+I2 Еа = 168 КДж.
Введение катализатора изменяет ход реакции и скорость. |
||||||||||||
СибАДИ |
||||||||||||
(А + К→А…..К→АК) +(АК +В →В…..АК→АВ + К) А+В → АВ, а |
||||||||||||
катализатор в результате реакции остался без изменения. |
||||||||||||
2HI H2+I2 |
|
катал затор |
Au Еа = 105 КДж. |
|||||||||
2HI H2+I2 |
катал затор |
Pt |
Еа = 59 КДж. |
|||||||||
Видно, что введен е катализатора уменьшает Еа и скорость реакции |
||||||||||||
увелич |
вается. |
|
|
|
|
|
|
|||||
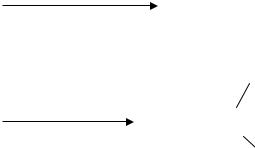
На рис. представлена энергетическая |
диаграмма некаталитической (1) и |
|||||||||||
каталит ческой (2) реакц и |
|
|
|
А + В → АВ ( G 0) |
||||||||
Еа |
|
|
|
А……В |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
А..В..К |
2 |
|
|||||
|
+В+К |
|
|
|
|
|
|
|
В+К |
|||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
ход реакции |
|
|
|
||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
Рис. Энергетическая диаграмма реакции |
|||||||
|
|
|
|
|
ХИМИЧЕСКОЕ РАВНОВЕСИЕ |
|||||||
Все химические реакции делят на две группы: |
||||||||||||
1. |
|
Необратимые, протекают до конца |
||||||||||
|
|
|
|
|
Ba(ОН)2 + H2SO4 BaSO4 + 2H2О |
|||||||
|
|
|
|
|
|
Zn + 2HCl ZnCl2 + H2↑ |
||||||
2. |
|
|
|
|
NaOH + HCl NaCl + H2О |
|||||||
|
Обратимые, протекают не до конца |
|||||||||||
3Н2(г) + N2(г) 2 NH3(г)
12

υпр.= k1 [H2]3 [N2] |
υобр.= k2 [NH3]2 |
|
Сначала реакция идет в сторону образования аммиака, а затем |
||
протекает обратный процесс – разложение молекул аммиака. В какой- |
||
то период скорости будут равны, т.е. k1 |
[H2]3 [N2] = |
k2 [NH3]2 и на- |
ступит химическое равновесие. [ H2] – равновесная |
концентрация |
|
водорода. Если концентрации (или парциальные давления в случае |
||||||
СибАДИ |
||||||
газов) исходных веществ и продуктов реакции не изменяются во вре- |
||||||
мени, то они называются равновесными концентрациями (или парци- |
||||||
альными давлен ями). |
|
|
|
|
||
Например: Ррн2 – равновесное парциальное давление водорода. |
||||||
Термод нам ческ м условием |
химического равновесия является ра- |
|||||
венство энерг Г |
са химической реакции 0, т.е. G = 0. При не- |
|||||
которой температуре энтальпийный и энтропийный факторы уравни- |
||||||
ваются. К нет ческ м условием химического равновесия υ пр.= υ обр. |
||||||
Химическое |
равновес е имеет динамический характер, т. е. происхо- |
|||||
дит непрерывное о разование и распад молекул. |
|
|||||
На основан |
равенства скоростей прямой и обратной реакции можно |
|||||
записать k2 / k1 =[NH3]2 / [H2]3 [N2] = К - константа химического рав- |
||||||
новесия, при |
Т=сonst величина постоянная. Это уравнение является |
|||||
вариантом математического выражения закона действующих масс, |
||||||
открытого шведским учёным К. Гульдбергом и П. Ваге в 1867 г. |
||||||
Закон действующих масс может быть сформулирован в следующем |
||||||
виде: oтношение произведения равновесных концентраций продуктов |
||||||
реакциивстепенях,равныхихстехиометрическимкоэффициентамк |
||||||
произведению равновесных концентраций исходных веществ в степе- |
||||||
нях, равных стехиометрическим коэффициентам, при Т=сonst явля- |
||||||
етсявеличинойпостоянной[2]. |
|
|
|
|||
Связь константы равновесия |
энергии Гиббса описывается следующим |
|||||
уравнением: |
G0 = -RT Ln Кр |
|
|
|
|
|
|
|
|
|
|
||
|
G0 = -RT Ln Кс |
отсюда |
|
Кс = е -∆G/RT |
||
Уравнения можно записать в следующем виде: |
|
|||||
|
G0 |
= -RT Ln ( P2p NH3 / P3 p H2 Pp N2 ) |
или |
|||
|
G0 = -RT Ln ( [NH3]2 /[H2]3 [N2] ), |
|
||||
|
|
Кр = ( P2p NH3 / P3p H2 |
P |
p N2 ) |
|
|
|
|
Кс = ( [NH3]2 / [H2]3 [N2] ), |
|
|||
где Кр или |
Кс – константы химического равновесия соответст- |
|||||
13
венно. Рассчитав ∆Gх.р, можем рассчитать величину Кс. Константа равновесия зависит от температуры. При экзотермических реакциях она уменьшается, а при эндотермических возрастает с ростом температуры.
При неизменных внешних условиях равновесие сохраняется сколько угодно долго, но оно меняется при изменении этих условий, и снова восстанавливается через некоторое время при новых услови-
Сиводу можно прийтибАДпри анализе выражения константыИравновесия:
ях. Переход с стемы з одного равновесного состояния в другое на-
зывают смещен ем ли сдвигом равновесия. При внешнем воздейст-
вии на с стему про сходит смещение химического равновесия,
т. е. изменяются равновесные концентрации исходных веществ и про-
дуктов реакц . Если увеличиваются равновесные концентрации продуктов реакц , то говорят о смещении равновесия вправо и наоборот. Характер смещения под влиянием внешних воздействий можно прогноз ровать, применяя принцип Ле Шателье (закономерное вл ян е внешн х условий на равновесие было установлено фран-
цузским ученым в 1847 г.): если на систему, находящуюся в равно-
весии, оказывать внешнее воздействие, то равновесие смещается в таком направлении, которое ослабляет внешнее воздействие (которое противодействует произведенному изменению).
Например: разберем влияние внешних факторов на реакции получения водорода конверсией метана водяным паром
СН4(г) + 2 Н2О(г) СО2(г) + 4 Н2(г)
1. Влияние концентраций. В систему добавим СН4, т.е. увеличим
его |
концентрацию. Равновесие нарушается, прямая реакция ускоря- |
|
ется и это приводит к увеличению концентрации продуктов реакции |
||
СО2 |
Н2, т.е. равновесие смещается |
вправо. Процесс будет проте- |
кать до тех пор, пока не установится |
новое равновесие. К этому вы- |
|
Кс СО2 Н2 4
СН4 Н2О2
При увеличении концентрации СН4 (знаменателя) возрастают концентрации продуктов реакции СО2 и Н2 (числитель). Это следует из того, что Кс – величина постоянная.
14
Вывод: при увеличении концентрации реагирующих веществ равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов – в сторону исходных веществ.
2. Влияние давления. Давление имеет существенное значение при реакциях между газами. Если в результате реакции изменяется число
молей газообразных веществ, то изменение общего давления в систе- |
|
СибАДИ |
|
ме вызывает смещение равновесия. При увеличении давления равно- |
|
весие смещается в сторону меньшего числа молей газа, т.е. в сторону |
|
уменьшен я его объёма. |
|
Например: |
3Н2(г) + N2(г) 2 NH3(г) |
До реакц |
ыло 4 моль газа, а после 2 при повышении давле- |
ния равновес е смещается в сторону продуктов реакции, т.е. в сторону образован я амм ака.
Если в с стеме кол чество молей исходных веществ и продуктов реакции равны, то увел чение или уменьшение давления приводит к возрастан ю замедлению скорости прямой и обратной реакций в равное ч сло раз, поэтому смещение равновесия в этом случае не произойдет Например:
F2(г) + H2(г) 2 HF(г) или Cl2(г) + H2(г) 2 HCl(г)
3. Влияние температуры. Равновесие большинства химических реакций сдвигается при изменении температуры. увеличением температуры равновесие смещается в сторону эндотермической реакции, т.е. реакции, протекание которой обеспечит поглощение теплоты.
Итак, как можно сдвинуть равновесие следующей реакции вправо?
1. |
СН4(г) + 2 Н2О(г) СО2(г) + 4Н2(г) - Q |
|
Увеличить концентрацию метана. |
||
2. |
Уменьшить давление, т.к. реакция протекает с увеличением объёма |
|
газа. |
|
|
3. |
Увеличить температуру, т.к. прямая реакция эндотермическая. |
|
|
Химическое равновесие в гетерогенных системах |
|
|
Условие G = 0 υпр. = υ обр. |
|
|
гет. |
гет. |
|
следовательно, наступает гетерогенное химическое равновесие. |
|
|
Например: конверсия углерода |
|
|
С(к) + 2Н2О СО2 + 2Н2 |
|
15
Рр CO2 P2 pH2
Кр= —————
Р2р H2O
Как видно, в уравнения констант гетерогенного химического
равновесия не входят участвующие и получающиеся твердые
вещества
СибАДИ[CO2] [ H2]2
Kc = ————————
[H2O]2
16
ЛАБОРАТОРНАЯ РАБОТА №1
ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
Цель: изучить влияние концентрации и температуры на скорость
|
реакции и на смещение химического равновесия. |
|
|
|
|
|||||||
СибАДИ |
||||||||||||
|
Опыт 1. Влияние концентраций на скорость реакции |
|
|
|
||||||||
|
Зав с мость скорости реакции от концентрации реагирующих |
|||||||||||
|
веществ |
сследуется на примере реакции |
|
|
|
|
|
|||||
|
|
|
Na2S2O3 + H2SO4 → Na2SO4 + H2O + S↓ + SO2 |
|
|
|
||||||
|
В результате реакции раствор становится мутным вследствие |
|||||||||||
|
выделен |
я свободной серы. |
|
|
|
|
|
|
||||
|
Порядок выполнения: для проведения опыта приготовьте в |
|||||||||||
|
трех проб рках |
равные о ъемы растворов тиосульфата натрия |
||||||||||
|
Na2S2O3 |
разл чной концентрации, добавив в две пробирки воду, как |
||||||||||
|
указано в табл. 1. |
|
|
|
|
|
Таблица 1 |
|||||
|
Кол чество реагентов, нео ходимых для выполнения опыта 1 |
|||||||||||
|
Номер |
|
Кол-во |
|
Кол-во |
О щий |
Условная |
Кол-во |
Время |
|
Условная |
|
|
про- |
|
капель |
|
капель |
о ъем, |
концент- |
капель |
течения |
|
скорость |
|
|
бирки |
|
р-ра |
|
воды |
капель |
рация |
H2SO4 |
реакции, |
реакции |
|
|
|
|
|
Na2S2O3 |
|
|
|
раствора |
(2N р-р) |
с |
|
1/t с-1 |
|
|
|
|
(1N р-р) |
|
|
|
|
|
|
|
|
|
|
1 |
|
4 |
|
8 |
12 |
|
1 |
|
|
|
|
|
2 |
|
8 |
|
4 |
12 |
2 С |
1 |
|
|
|
|
|
3 |
|
12 |
|
- |
12 |
3 С |
1 |
|
|
|
|
Осторожно встряхните пробирки № 1 и 2. В пробирку № 1 добавьте одну каплю 2N раствора H2SO4 определите время с момента добавления кислоты до едва заметного помутнения раствора. Опыт повторите поочередно с пробирками № 2 и 3. Все данные опыта занесите в табл. 1. Начертите график зависимости скорости реакции от концентрации тиосульфата натрия. Для этого на оси абсцисс отложите в определенном масштабе относительные концентрации тиосульфата натрия, а на оси ординат – отвечающие им скорости (в условных единицах). Сделайте вывод о характере зависимости скорости реакции от концентрации реагирующих веществ.
17

Опыт 2. Влияние температуры на скорость реакции Порядок выполнения: пробирку с 2N раствором серной кисло-
ты поставьте в термостат, вода в котором имеет комнатную температуру. В другую пробирку налейте 10 капель 1N раствора тиосульфата натрия и тоже поместите в термостат на 5 – 10 мин. Не вынимая про-
бирку с тиосульфатом, добавьте в нее одну каплю 2N серной кислоты из пробирки, находящейся в этом же термостате, отмечайте время до появлен я мути.
СибАДИРезультаты опыта выразите в графике, откладывая на оси абсцисс температуру и по оси ординат относительную скорость реакции.
Повтор те опыт с растворами тиосульфата и серной кислоты при температурах на 10 20оС выше, чем в предыдущем случае. Полу-
ченные данные зап ш те в табл. 2.
|
|
|
|
|
Таблица 2 |
|
Кол чества реагентов, нео ходимых для выполнения опыта 2 |
||||||
|
|
|
|
|
|
|
Номер |
Кол чество капель |
Темпера- |
Время |
Относительная |
||
проб рки |
|
|
тура, о С |
реакции, |
скорость |
|
Na2S2O3 |
H2SO4 |
|||||
|
(1N р-р) |
(2N р-ра) |
|
с |
1/t, с-1 |
|
1 |
10 |
1 |
|
|
|
|
2 |
10 |
1 |
|
|
|
|
3 |
10 |
1 |
|
|
|
|
Сделайте вывод о зависимости скорости реакции от температуры.
Опыт 3. Влияние изменения концентрации реагирующих веществ на смещение равновесия
Влияние изменения концентрации реагирующих веществ исследуется на примере обратимой реакции
3KCNS + FeCl3 ↔ Fe(CNS)3 + 3KCl
Порядок выполнения: в четыре пробирки внесите по 5 – 10 капель разбавленных растворов хлорида железа (III) FeCl3 роданида калия KCNS. Получившийся в результате реакции роданид железа Fe(CNS)3 сообщает раствору красную окраску. По изменению интенсивности окраски можно судить об изменении концентрации Fe(CNS)3, т.е. о смещении равновесия.
Одну пробирку с раствором сохраните в качестве контрольной для сравнения, в другую микрошпателем добавьте кристалл хлорида железа, в третью – кристалл роданида калия, в четвертую – несколько кристаллов хлорида калия. Отметьте изменение интенсивности окра-
18

ски в каждом случае. Полученные данные запишите в табл.3. Напишите выражение константы равновесия и сделайте вывод о
направлении смещения равновесия при изменении концентрации реагентов исходя из принципа Ле Шателье.
Таблица 3
Влияние изменения концентрации на смещение равновесия
|
|
|
|
|
|
|
|
№ про- |
СибАДИ |
Смещение |
|||||
|
Реактивы |
|
Добавленный |
Цвет |
|
||
|
бирки |
|
Цвет |
реактив |
|
равновесия |
|
|
1 |
KCNS |
|
контрольная |
|
|
|
|
2 |
FeCl3 |
|
+ FeCl3 |
|
|
|
|
3 |
Fe(CNS)3 |
|
+ КCNS |
|
|
|
|
4 |
KCl |
|
+ KCl |
|
|
|
Опыт 4. Вл ян е температуры на химическое равновесие
При действ йода на крахмал образуется непрочное соединение сложного состава, окрашенное в синий цвет. Равновесие системы можно условно зо раз ть следующей схемой:
Крахмал + Йод ↔ Окрашенное вещество + Q Эта реакция экзотермическая, идет с выделением тепла.
Порядок выполнения: для выполнения опыта в пробирку налейте 2–3 мл крахмала и до авьте 2–3 капли йодной воды, наблюдайте появление синей окраски. Нагрейте пробирку. Объясните исчезновение синей окраски. Сделайте вывод о влиянии температуры на химическое равновесие.
Контрольные вопросы и задания
1. Что изучает химическая кинетика?
2. Какие реакции называются гомогенными, а какие – гетерогенными? Приведите примеры.
3. Что такое скорость химической реакции? Запишите математическое выражение для определения скорости гомогенной гетерогенной реакции.
4. От каких факторов зависит скорость реакции? Сформулируйте закон, определяющий зависимость скорости реакции от концентрации реагирующих веществ. Запишите математическое выражение этого закона для гомогенных и гетерогенных реакций. Сформулируйте физический смысл константы скорости реакции.
19
