
- •1.1. Выбор варианта
- •1.2. Контрольные вопросы
- •1.3. Условия задач
- •1.4. Выбор исходных данных для контрольных задач
- •1.5. Методические указания к выполнению контрольной работы 1
- •2.1. Выбор варианта
- •2.2. Контрольные вопросы
- •2.3. Условия задач
- •2.4. Выбор исходных данных для контрольных задач
- •2.5. Методические указания к выполнению контрольной работы 2
- •644046, Г. Омск, пр. Маркса, 35
1.5. Методические указания к выполнению контрольной работы 1
Задачи № 1 – 11
Задачи составлены по разделам технической термодинамики: уравнение
состояния идеального газа, смесь идеальных газов, теплоемкость, первый закон 14
термодинамики и основные термодинамические процессы. При решении этих задач могут быть использованы следующие формулы и выражения.
Уравнение состояния идеального газа [2 – 8]:
для 1 кг –
![]()
-
pv RT ;
(1.1)
для G кг –
![]()
-
pv GRT ,
(1.2)
где v – удельный объем идеального газа, м3/кг; R = 8314/μ – газовая постоянная, Дж/(кг∙К);
– масса 1 моля газа, кг (численно равна молекулярной массе газа); р – абсолютное давление, Па:
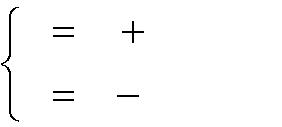
-
p
B
pм
;
(1.3)
p
B
pв ,
где рм – избыточное давление, измеряемое манометром, Па; рв – разряжение, измеряемое вакуумметром, Па;
– атмосферное (барометрическое) давление (В = 750 мм рт. ст. ≈105 Па), Па. Для газовых смесей вводят понятие о так называемой средней (кажущей-
ся) молекулярной массе смеси, значение которой определяется по выражениям:
через объемные доли [3] –
-
n
см
ri i ,
(1.4)
1
![]()
и через массовые доли –
-
n
см 1 / mi i ,
(1.5)
1
15
![]()
где μi – молекулярная масса компонента, входящего в смесь, кг/кмоль;
-
m
i
Gi
– массовая доля газа в смеси (отношение массы этого газа, входя-
G
![]()
щего в смесь, к массе всей смеси), кг;
r |
Vi |
– объемная доля (отношение приведенного объема какого–либо |
|
||
|
|
||||
i |
V |
|
|
|
|
|
|
|
|
||
газа, входящего в смесь, к объему всей смеси). |
|
|
|||
Формулы пересчета состава смеси [4 – 6]: |
|
|
|||
|
|
ri |
miμсм / μi ; |
(1.6) |
|
|
|
mi |
ri i / см , |
(1.7) |
|
![]()
![]()
![]()
Газовую постоянную смеси идеальных газов R можно определить или че-рез газовые постоянные отдельных компонентов Ri, входящих в смесь,
n
![]()
mi Ri , или по средней молекулярной массе смеси R = 8314/μсм, Дж/(кг∙К).
1
Для определения парциального давления отдельного компонента pi, вхо-
дящего в смесь, служат формулы p |
|
r p и p |
i |
m |
i |
Ri |
p , где р – полное давление |
|
|
|
|
||||||
|
i |
i |
|
R |
|
|||
смеси газов, Па. |
|
|
|
|
|
|
|
|
![]()
зависимости от выбранной количественной единицы вещества разли-
чают мольную теплоемкость μс, кДж/(кмоль∙К), массовую – с, кДж/(кг∙К), и
объемную – с´, кДж/(м3∙К). Объемную теплоемкость относят к 1 м3 при нор-мальных физических условиях (ро = 760 мм рт. ст. = 101325 Па, tо = 0 °С). Эти теплоемкости связаны между собой следующими зависимостями:
![]()
-
c
c c
;
(1.8)
0
c
c
c
0 ,
(1.9)
22, 4
![]()
где μ – молекулярная масса газа, кг/кмоль;
16
– плотность газа при нормальных физических условиях, кг/м3.
![]()
Мольная, массовая и объемная теплоемкости могут быть при постоянном давлении ср и при постоянном объеме сv. Отношение теплоемкостей при посто-янном давлении и постоянном объеме называют показателем адиабаты и обо-
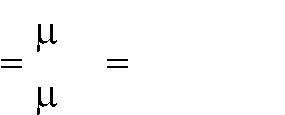
значают буквой k, т. е. k |
c p |
|
cp |
. |
|
|
|
|
|||
|
c v |
|
cv |
|
|
Теплоемкость газа зависит от его температуры. В приближенных расче-тах часто пренебрегают этой зависимостью и теплоемкость газов одинаковой атомности считают величиной постоянной. Значения мольных теплоемкостей и показателей адиабаты приведены в табл. 3.
|
|
Т а б л и ц а 3 |
|
|||
Значения мольных теплоемкостей и показателей адиабаты |
|
|
||||
|
|
|
|
|
||
Газы |
Удельная мольная теплоемкость, кДж/(кмоль∙К) |
k |
|
|||
|
|
|
||||
μсp |
μсv |
|
||||
|
|
|
||||
Одноатомные |
12,56 |
20,93 |
1,67 |
|
||
Двухатомные |
20,93 |
29,31 |
1,40 |
|
||
Трех- и многоатом- |
20,31 |
37,68 |
1,29 |
|
||
ные |
|
|||||
|
|
|
|
|||
Зависимости теплоемкостей газов от температуры имеют нелинейный ха-рактер. В источнике [7] в табл. П.1 приведены средние мольные теплоемкости некоторых газов в пределах от 0 до t, оС. При пользовании данными указанной таблицы в необходимых случаях требуется производить интерполяцию.
Для смесей идеальных газов [5, 6] теплоемкость определяется по формулам:
массовая –
-
n
ссм
mi c ;
(1.10)
1
![]()
объемная –
-
n
cсм
ri ci ;
(1.11)
1
17
![]()
мольная –
-
n
cсм
ri ci .
(1.12)
1
![]()
Для определения, например, средней мольной теплоемкости в пределах температуры от t1 до t2 надо из соответствующей таблицы взять теплоемкость cm1 и cm2 соответственно в пределах (0 – t1) оС и (0 – t2) оС (средние теплоем-
![]()

кости помечаются индексом m). Затем по выражению |
cm |
c m t 2 |
c m t1 |
рас- |
|
2 |
1 |
|
|||
|
|
|
|
||
|
|
t 2 |
t1 |
|
|
считать искомую теплоемкость.
Если в процессе участвуют G кг вещества, то количество теплоты в соот-ветствующем процессе определяется по выражению [7]:
-
Q G(c m
t
2
c m t 1 ) .
(1.13)
2
1
![]()
pv-диаграмме линия, изображающая политропный процесс, строится в
соответствии с уравнением pvn = const, где n – показатель политропы. Связь между основными параметрами рабочего тела в политропном процессе выра-жается следующими формулами:
-
p
/ p
2
v
/ v
2
n ;
(1.14)
1
1
T
/ T
v
1
/ v
2
n-1 ;
(1.15)
2
1
n-1
(1.16)
T2 / T1
p1 / p2
.
n
![]()
![]()
![]()
![]()
![]()
![]()
Для адиабатного процесса в формулах (1.14) – (1.16) показатель n заменя-ется показателем адиабаты k = сp/cv.
18
![]()
![]() Изменение
внутренней энергии u1
2 , энтальпии
h1 2
и энтропии s1
2 не зависит
от характера процесса и при постоянной
теплоемкости 1 кг идеаль-ного газа
подсчитывается по формулам:
Изменение
внутренней энергии u1
2 , энтальпии
h1 2
и энтропии s1
2 не зависит
от характера процесса и при постоянной
теплоемкости 1 кг идеаль-ного газа
подсчитывается по формулам:
-
Δu1-2
u2
u1
cv t 2
t1
;
(1.17)
Δh1-2
h 2
h1
cp t 2
t1
;
(1.18)
Δs1-2
s2
s1
cln T2 / T1 .
(1.19)
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
выражении (1.19) с – теплоемкость соответствующего процесса. Для политропного процесса теплоемкость [5]
![]()
-
c n cv
n
k
.
(1.20)
n
1
Работа газа в политропном процессе, кДж,
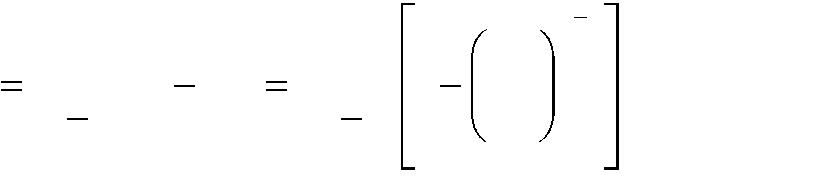
-
n
1
L
GR (T1 T2 )
GRT1 1
p2
n
.
(1.21)
n 1
n 1
p1
изотермическом процессе по первому закону термодинамики теплота равна работе процесса и может быть определена по формуле:
-
Q L GRTln
v2
GRTln
p1
.
(1.22)
v1
p2
![]()
В этом процессе изменение удельной энтропии [5]
-
s1 2
s2s1
R ln
v2
R ln
p1
q1 2
,
(1.23)
v1
p2
T
![]()
где q |
|
Q |
. |
|
2 |
|
|
||
1 |
G |
|
||
|
|
|
||
![]()
19
адиабатном процессе удельная работа равна изменению внутренней энергии с обратным знаком:
-
l L / G u1 u2 cv (t1 t2 ) .
(1.24)
![]()
Задачи № 12 – 18
Задачи решаются при помощи hs-диаграммы водяного пара, практическая часть которой состоит из двух областей [1]. Ниже пограничной кривой сухого насыщенного пара (степень сухости х = 1) будет область влажного насыщенно-го пара (0 < х < 1), выше – область перегретого пара. Поэтому, когда в задаче требуется определять состояние пара, нужно показать, в какой области диа-граммы находится точка данного состояния пара. В hs-диаграмме в области влажного пара соответствующие изобара и изотерма совпадают, так как в этой области определенному давлению соответствует определенная температура на-сыщения. В области перегретого пара изотермы отклоняются от изобар вправо, асимптотически приближаясь к горизонтальной линии.
Удельная внутренняя энергия пара u = h – pv (здесь необходимо обратить внимание на соответствие размерностей всех величин).
Удельная теплота в изобарном процессе равна изменению энтальпии в этом процессе, т. е. q1-2 = h2 – h1. В изотермическом процессе q1-2 = T(s2 – s1).
обратимом адиабатном процессе изменения состояния пара, протекаю-щем при постоянном значении энтропии, удельная работа l1-2 = u1 – u2 =
(h1 – p1v1) – (h2 – p2v2).
Процесс дросселирования пара условно изображается линией постоянной энтальпии.
Для влажного насыщенного пара [2 – 5] – удельный объем
![]()
vx v x v (1 x) ; энтальпия hx h rx ; энтропия sx s rx / Tн ; внутренняя
энергия
ux
![]()
hx
pvx .
Задачи № 19 – 22
Задачи составлены на процессы истечения и дросселирования газов и па-ров. Процесс истечения принимается без теплообмена, т. е. адиабатным, для ко-торого в указаниях к задачам 1 – 11 приведены формулы, связывающие основ-
20
ные параметры идеального газа, и неразрывным (сплошным), когда соблюдает-ся равенство (уравнение неразрывности):
![]()
-
Gv fc ,
(1.25)
где G – массовый расход газа или пара, кг/с;
– удельный объем газа или пара, м3/кг; f – площадь данного сечения сопла, м2;
с – скорость потока в рассматриваемом сечении, м/с.
По равенству (1.25) можно определять массовый расход или площадь данного сечения сопла.
Если адиабатное истечение газа или пара происходит при отношении давлений р2/р1 больше критического значения (р2/р1)кр, то применяют сужи-вающееся сопло. В этом случае теоретическая скорость истечения определяется по формуле, м/с [7]:

-
k
k 1
(1.26)
c
2
2
BT 1
(p
2
/p ) k
k
1
2
1
Для водяного пара скорость истечения определяют по выражению:
![]()
c
2 44,76![]()
![]() h1 h2
, (1.27)
h1 h2
, (1.27)
где h1 и h2 – соответственно энтальпия, кДж/кг, пара в начале и в конце адиабат-ного процесса истечения, значения энтальпии определяются по hs-диаграмме.
Критическое отношение давлений для двухатомных газов, в том числе для воздуха (k = 1,4), равно 0,528, а для перегретого водяного пара – 0,546.
Если истечение происходят при р2/р1 < (р2/р1)кр, то применяют расши-ряющееся сопло Лаваля, где скорость в выходном сечении сопла достигает сверхкритических (сверхзвуковых) значений. В этом случае скорость на выходе из сопла определяется по формулам (1.26) – (1.27), а критическая скорость в минимальном сечении для двухатомных газов – по формуле:
21
-
cкр 1,08 p1v1 ,
(1.28)
![]()
или
![]()
-
cкр 1,08 RT1
(1.29)
Для перегретого пара:
![]()
-
c кр 44, 76 h 1 hкр ,
(1.30)
где hкр – энтальпия пара в минимальном сечении сопла в конце адиабатного процесса расширения пара до критического давления ркр = 0,546р1, определяет-ся по hs-диаграмме.
Площадь минимального сечения Лаваля может быть определена по урав-нению неразрывности потока:
-
fmin
Mvкр
,
(1.31)
cкр
![]()
где v |
кр |
v (p / p |
кр |
)1/k |
– для газов. |
|
|
11 |
|
|
|
![]()
Величина vкр для пара может быть определена по hs-диаграмме.
Задачи № 23 и 24
При политропном сжатии работа одноступенчатого идеального компрес-сора определяется по выражению [5], кДж/с:
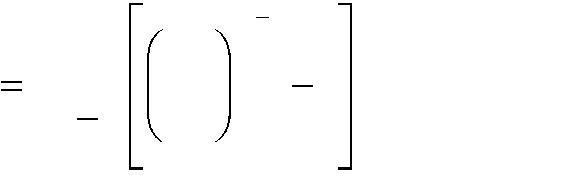
-
m 1
p1 v1
p2
m
L
1 ,
(1.32)
m 1
p1
где р1 и р2 – абсолютное давление в процессах всасывания и нагнетания, кПа; V1 = Vnn – подача компрессора при условиях всасывания, м3/с.
22
Теоретическая мощность привода компрессора в m раз больше L, т. е.
Nт = m ∙ L.
Работа, отнесенная к 1 м3 всасываемого газа, кДж/м3,

-
m
m 1
l
1 ,
(1.33)
m 1 p1
m
где для одноступенчатого компрессора β = р2/р1 для двухступенчатого – l = lI + lII.
![]()
При определении lI и lII I p пром / р1 , II p 2 / pпром .
Задачи № 25 – 29
Цикл вычерчивается в pv- и Ts-диаграммах с обозначением всех переход-ных точек цикла. Так как в теоретических циклах поршневых двигателей внут-реннего сгорания и газотурбинных установках процессы сжатия и расширения являются адиабатными, то основные параметры в точках этих процессов могут быть определены по зависимостям между начальными и конечными парамет-рами адиабатного процесса (см. указания к задачам 1 – 11).
задачах 26 и 27 неизвестные значения температуры в соответствующих точках процесса определяются по формуле теплоты данного процесса. В ряде точек цикла неизвестный параметр состояния рабочего тела определяется по
уравнению состояния идеального газа. Если в данной задаче определены тер-мический КПД ηt и удельная полезная работа lо, то удельное количество подве-денной теплоты в цикле q1 = l0/ηt, а отведенной – q2 = q1 – l0.
Задача № 30
Термический КПД теоретического паросилового цикла (цикла Ренкина)
-
t
h1
h
2
,
(1.34)
h1
h
2
![]()
где h1 – энтальпия пара в начале адиабатного процесса расширения пара в па-ровом двигателе. Значение h1 определяется по hs-диаграмме по заданным на-чальным параметрам пара [1];
23
h2 – энтальпия пара в конце адиабатного процесса расширения пара (точка
находится на пересечении линии расширения s1 = const с изобарой р2 заданно-го давления в конденсаторе);
h2 – энтальпия кипящей жидкости (конденсата) при заданном давлении в
![]()
конденсаторе.
Контрольная работа 2
ОСНОВЫ ТЕПЛОПЕРЕДАЧИ
