
- •Охарактеризувати предмет, завдання та основні методи психології вищої школи
- •2. Обґрунтувати навчально-професійну діяльність студента як провідну.
- •3. Пояснити суперечливості та кризи студентського віку
- •4. Розкрити адаптацію студента до навчання у вищій школі, та психологічні умови її ефективності
- •5. Пояснити зміст поняття творчості як умови самореалізації особистості у вищій школі
- •6. Пояснити психологічні особливості управління навчально-виховним процесом у закладах вищої освіти
- •7. Проаналізувати психологічні особливості студентської групи та її структуру
- •8. Проаналізувати психологічні бар’єри в професійно-педагогічному спілкуванні викладачів і студентів
- •9. Пояснити психологічний зміст і основні прояви професійного стресу та синдрому «професійного вигорання» учасників освітнього процесу закладів вищої освіти
- •10. З’ясувати психологічні передумови успішності та неуспішності студентів у навчально-професійній діяльності
- •11. Андрагогіка як галузь педагогічної науки
- •Мета підготовки фахівця у вищій школі. Мета виховання у вітчизняній і зарубіжній педагогіці
- •Українська етнопедагогіка як джерело розвитку педагогічної науки і практики
- •Поняття і завдання дидактики вищої школи
- •Сутність процесу навчання у вищій школі
- •Методи і засоби навчання у вищому навчальному закладі
- •Формування (виховання, розвиток) фахівця
- •Виховальні відносини викладача і студентів у вищій школі, засоби їх забезпечення
- •Методи і форми виховання у вищому навчальному закладі
- •Тьюторський підхід у діяльності викладача
- •21. Зміст навчання хімії у старшій і вищій школі.
- •22.Методи навчання хімії у старшій і вищій школі.
- •23. Програмоване навчання хімії у старшій і вищій школі.
- •24.Організаційні форми навчання хімії у старшій і вищій школі.
- •25. Лабораторний практикум і його роль в навчанні хімії у старшій і вищій школі.
- •26. Самостійна робота здобувачів освіти у навчанні хімії.
- •27. Засоби навчання хімії.
- •28. Контроль за засвоєнням хімічних знань у старшій і вищій школі.
- •29. Інноваційні технології навчання хімії.
- •30. Сучасні форми і методи оцінювання у старшій і вищій школі.
- •31. Будова атома. Будова матерії.
- •32. Будова молекул і хімічний зв’язок.
- •33. Симетрія молекул.
- •34. Кислоти і основи.
- •35. Окиснення і відновлення. Окисно-відновні потенціали.
- •36. Стереоізомерія.
- •37. Енергетика хімічних реакцій.
- •38. Механізми хімічних реакцій.
- •39. Фізико-хімічні методи дослідження речовин.
- •40. Будова атома Карбону.
- •41. Природа хімічних зв'язків.
- •42. Сучасні уявлення про взаємний вплив атомів у молекулі. Індукційний ефект.
- •Індуктивний (індукційний)ефект
- •43. Мезомерний ефект.
- •44. Ізомерія органічних сполук.
- •45. Кислотно-основні властивості органічних сполук
- •46. Ароматичність
- •47. Гетероциклічні ароматичні системи.
- •48. Основи теорії хімічних перетворень
- •49. Заміщення біля атому Карбону.
- •50. Електрофільне і нуклеофільне заміщення в ароматичному ряду.
- •Електрофільне заміщення в ароматичних сполуках проходить у три етапи.
- •51.Поняття хімічної номенклатури
- •52. Номенклатура неорганічних сполук.
- •53. Номенклатура iupac органічних сполук.
- •54. Сучасний хіміко-аналітичний контроль
- •55. Пробовідбір і пробопідготовка.
- •56. Концентрація і розподіл як стадії пробопідготовки.
- •57. Аналіз вод.
- •58. Аналіз повітря
- •59. Аналіз грунтів та донних відкладень.
- •60.Визначення екотоксикантів
- •61. Аналіз біологічних матеріалів.
- •62. Аналіз геологічних об'єктів.
- •63. Аналіз харчових і сільськогосподарських продуктів.
- •64.Відмінності якісного та кількісного аналізу органічних сполук від аналізу неорганічних речовин
- •65. Підготовка речовини до аналізу
- •66. Визначення фізичних констант
- •67. Елементний аналіз.
- •68.Ідентифікація органічних речовин
- •69. Якісний функціональний аналіз
- •70. Кількісний функціональний аналіз
- •71. Основи класичної теорії хімічної будови
- •72. Фундаментальні складові матеріальних об’єктів
- •73. Симетрія молекулярних систем
- •74. Поляризація молекул
- •75. Електричні та магнітні властивості атомів і малих молекул
- •76. Двохатомні молекули. Багатоатомні молекули
- •77. Будова і властивості твердих тіл
- •78. Математична модель хімічних перетворень
- •79. Молекулярна енергетика горіння
- •80. Каталіз та каталізатори. Вивчення впливу неорганічних каталізаторів та ферментів на перебіг хімічних реакцій.
- •81. Біогенний обмін речовин у біосфері
- •82. Жива речовина біосфери та її біогеохімічні функції
- •83.Газова функція живої речовини та біогенний кугооіг води
- •84. Концентраційна функція живої речовини
- •85. Окисно-відновна функція живої речовини
- •86. Значення хімічних елементів у житті живих організмів
- •87. Вплив геохімічного середовища на розвиток та хімічний склад рослин.
- •88. Біогеохімічне районування
- •89. Біологічний та біогеохімічний кругообіги елементів у біосфері
- •90. Ноосфера як етап розвитку біосфери
36. Стереоізомерія.
Стереоізомери – молекулярні структури з однаковими атомами й характером зв'язків, які відрізняються розміщенням у просторі. До них відносяться енантіомери, діастереомери й геометричні ізомери.
Оптична активність – здатність речовини повертати площину поляризації світла.
Речовини, які можуть повертати площину поляризації світла, називаються оптично активними. Такі речовини не повинні мати симетрії інверсії. Оптична активність може бути природною і наведеною зовнішніми полями. Явище оптичної активності поширене серед органічних речовин, особливо природних (гідрокси- й амінокислот, білків, вуглеводів, алкалоїдів). Однією з причин виникнення оптичної активності органічних молекул є наявність у структурі sp3-гібридизованого атома карбону, зв’язаного з чотирма різними замісниками. Такий атом карбону називається хіральним або асиметричним (хіральний центр). У структурних формулах асиметричний атом вуглецю позначають зірочкою – С*.
А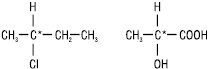 симетричними
можуть бути й інші атоми, нітрогену,
сульфуру, фосфору. Оптичну активність
виявляють також сполуки, які не містять
асиметричного атома – це похідні алену,
адамантану, фероцену, ізомерія яких
викликана відсутністю обертання навколо
простого зв’язку, так звана атропізомерія.
Оптична активність характерна також
для спіральних конформацій білків,
нуклеїнових кислот, гексагеліценів.
Сполуки, які містять один асиметричний
атом карбону, існують у вигляді двох
ізомерів, котрі співвідносяться як
предмет до свого дзеркального відображення.
Такі ізомери називають енантіомерами.
симетричними
можуть бути й інші атоми, нітрогену,
сульфуру, фосфору. Оптичну активність
виявляють також сполуки, які не містять
асиметричного атома – це похідні алену,
адамантану, фероцену, ізомерія яких
викликана відсутністю обертання навколо
простого зв’язку, так звана атропізомерія.
Оптична активність характерна також
для спіральних конформацій білків,
нуклеїнових кислот, гексагеліценів.
Сполуки, які містять один асиметричний
атом карбону, існують у вигляді двох
ізомерів, котрі співвідносяться як
предмет до свого дзеркального відображення.
Такі ізомери називають енантіомерами.
Для відображення просторової будови оптичних ізомерів на площині можуть бути використані стереохімічні формули – енантіомери бутанолу-2:
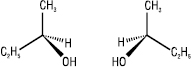

Частіше оптичні ізомери зображують на площині за допомогою проекційних формул Фішера. Енантіомери схожі між собою, але не тотожні, вони мають однаковий склад і послідовність зв’язування атомів у молекулі, але відрізняються один від одного відносним розташуванням атомів у просторі, тобто конфігурацією. Енантіомери мають однакові фізичні і хімічні властивості, обертають площину поляризації поляризованого променя на один і той же за величиною, але протилежний за напрямком кут; вони з різною швидкістю реагують з іншими хіральними сполуками і відрізняються за фізіологічною дією.
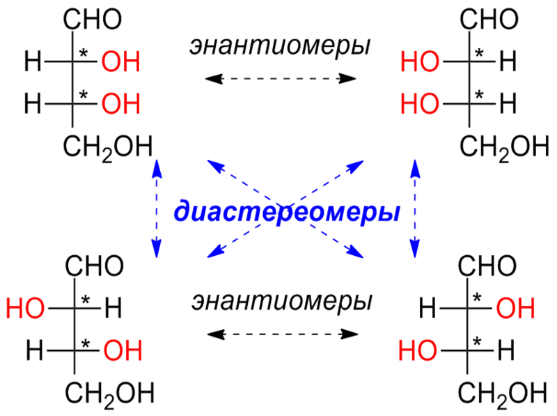 До
діастереоізомерів
належать усі стереоізомери, які не є
енантіомерами, тобто дзеркальними
відображеннями один одного. Діастереомери
молекули виникають при наявності у ній
декількох стереоцентрів. До діастереомерів
належать також стереоізомери, які
відрізняються конфігурацією подвійного
зв'язку (π-діастереомери, або геометричні
ізомери). Діастереомери відрізняються
за фізичними властивостями, зокрема за
оптичною активністю.
До
діастереоізомерів
належать усі стереоізомери, які не є
енантіомерами, тобто дзеркальними
відображеннями один одного. Діастереомери
молекули виникають при наявності у ній
декількох стереоцентрів. До діастереомерів
належать також стереоізомери, які
відрізняються конфігурацією подвійного
зв'язку (π-діастереомери, або геометричні
ізомери). Діастереомери відрізняються
за фізичними властивостями, зокрема за
оптичною активністю.
37. Енергетика хімічних реакцій.
Об'єктом вивчення в термодинаміці є термодинамічна система, під якою розуміють умовно виділену з простору сукупність тіл. Системи, які можуть обмінюватися з навколишнім середовищем і енергією і речовиною називаються відкритими. Системи, які обмінюються тільки енергією, називаються закритими. Якщо між середовищем та системою відсутній і тепло- і масообмін – це ізольована система. Розрізняють також гомогенні системи, що складаються з однієї фази та гетерогенні, що складаються з декількох фаз. Реакції, які протікають на межі розділу фаз – гетерогенні. Параметри діляться на інтенсивні та екстенсивні. Інтенсивні не залежать від розміру системи, а залежать від температури і тиску, екстенсивні залежать від маси та об'єму. Зміна одного з параметрів призводить до зміни стану в цілому. Стан системи називається рівноважним, якщо параметри системи в часі мимоволі не змінюються. Нерівноважна система –параметри в часі змінюються. Функції стану – внутрішня енергія, ентропія, ізобарний, ізотермічний потенціал.Перехід системи з 1-го стану під другим називається процесом.
1. T= const- Ізотермічний процес2. V= const - Ізохорний процес3.P= const - Ізобарний процес
Перший закон термодинаміки: теплота, підведена до системи, витрачається на збільшення внутрішньої енергії системи і на роботу над навколишнім середовищем Q=ΔU+AПерший закон термодинаміки є вираженням універсального закону збереження енергії.
Ентальпія – це функція стану, що за умов постійного тиску характеризує внутрішню енергію системи та її здатність до виконання роботи. Ентальпія залежить від кількості речовини, тому її змінення ΔH відносять до одного моля і вимірюють у [кДж/моль]. При підстановці Н у рівняння одержуємо: Qp=H2−H1=ΔH Отже, в ізобаричному процесі підведена теплота дорівнює зміненню ентальпії системи. Змінення ентальпії системи внаслідок взаємодії речовин за умов постійного тиску називається тепловий ефект хімічної реакції.
Незалежність теплоти хімічної реакції від шляху процесу за ізобарно-ізотермічних умов (Р,Т=const) була встановлена на основі експериментальних досліджень і має назву закон Гесса, або другого закону термохімії: тепловий ефект хімічної реакції за умов сталого тиску і сталої температури не залежить від шляху її перебігу, а залежить лише від природи і фізичного стану вихідних речовин і продуктів реакції.
Перший фактор, який одержав назву ентальпійного, виявляється у зміненні ентальпії. Це пояснюється так: під час будь-якої хімічної реакції відбувається розрив зв'язків у молекулах вихідних реагентів, який потребує витрати енергії, і одночасно – утворення нових зв'язків у молекулах продуктів реакції, яке супроводжується виділенням енергії.
Оскільки між газами NO2 і N2 не відбувається взаємодії (зв’язки не руйнуються і не утворюються), то тепловий ефект відсутній, ΔH=0. З цього випливає, що ентальпійний фактор не може вважатися рушійною силою такого процесу.
Ентропія – це термодинамічна функція, яка є мірою невпорядкованості і характеризує відносну імовірність стану системи.Основною властивістю ентропії є її збільшення (ΔS>0)у будь-якій замкнутій системі, що змінює свій стан у напрямку рівноваги, якій притаманні максимальна невпорядкованість частинок і найбільші значення ентропії(ΔSрівноваги = 0).
