
- •Какие функциональные группы аминокислот участвуют в образовании пептидной связи?
- •Участвуют в формировании третичной структуры белковой молекулы
- •Что лежит в основе метода разделения белков афинной хроматографией?
- •Из приведенных аминокислот выберите ту, радикал которой может участвовать в образовании водородных связей
- •Какое значение концентрации белка в сыворотке крови является нормой
Из приведенных аминокислот выберите ту, радикал которой может участвовать в образовании водородных связей
Серин
Какие аминокислоты преобладают в составе белка, если его изоэлектрическая точка находится в слабокислой среде (рН 5,5-6,5)
глутамат, аспартат
Какое значение концентрации белка в сыворотке крови является нормой
65-85 г\л
Выберите наиболее полное и правильное определение четвертичной структуры белка.
Количество протомеров, их расположение относительно друг друга и характер связей между ними в олигомерном белке
В плазме методом электрофореза на ацетатцеллюлозе можно выделить … белковых фракций:
5 белковых фракций:
Выберите белки которые НЕ ОТНОСЯТСЯ к гемопротеинам
трансферин, альбуминъ
Ферменты, катализирующие расщепление внутримолекулярных связей при участии воды, называются:
гидролазы
Одна единица активности фермента (1 МЕ) соответствует:
количеству фермента, которое катализирует превращение 1мкМ субстрата за 1 мин при оптмальных условиях
Фермент алкогольдегидрогеназа с индексом КФ 1.1.1.1 относят к
оксидоредуктазам
В ходе ферментативного катализа при образовании фермент-субстратного комплекса:
усиливается комплементарность между субстратом и ферментом
коэнзим А (KоA) принимает участие в переносе группы:
CH3CO ─
Специфичность действия ферментов определяется:
структурой активного центра
К изофункциональным ферментам относят:
гексокиназу
Зависимость скорости реакции от концентрации фермента можно выявить только при условии:
при избытке субстрата
Какова будет скорость ферментативной реакции, если концентрация субстрата численно равна Км
половина максимальной скорости
К термостабильным ферментам можно отнести:
Tag –полимеразу
При каком заболевании отмечается наиболее выраженное повышение активности фермента АсАт:
инфаркт миокарда
Действие конкурентного ингибитора можно устранить:
добавлением избытка субстрата
Выберите утверждение, правильно характеризующее изоферменты:
Это различные формы фермента, катализирующие одну реакцию
Скорость ферментативной реакции это:
изменение количества молекул субстрата или продукта за единицу времени
Какие изоформы лактатдегидрогеназы (ЛДГ) применяются для дифференциальной диагностики инфаркта миокарда:
ЛДГ – 1, ЛДГ – 2
Подберите соответствия:
Определение ВВ изоформы креатинкиназы используют для диагностики:
не имеет диагностического значения
ПКА является:
гетероолигомерным белком
Протеинкиназа А:
фосфорилирует белки
Кальмодулин приобретает сродство к кальмодулин-зависимой киназе гликогенфофорилазы в результате:
связывания ионов кальция
Какой из перечисленных ферментов принимает участие в процессе ковалентной модификации ферментов путем фосфорилирования:
протеинкиназа
Какое из ниже перечисленных веществ является специфическим ингибитором сульфгидрильных групп в ферментах?
Монойодацетат
Установите соответствия между ферментом и способом его активации:
Необратимый ингибитор:
его эффективность не изменяется при добавлении субстрата
прочно (ковалентно) связывается с активным или аллостерическим центром
Выберите неверное утверждение для обратимых ингибиторов: Обратимые конкурентные ингибиторы являются суицидальными субстратамим
Активатором для протеинкиназы А является: цАМФ
Выберите пару аллостерических эффекторов, являющихся антагонистами:
АТФ и АДФ
Какие свойства белка обусловлены наличием в их структуре карбоксильных и аминогрупп?
амфотерность и способность к электрофорезу
В составе коллагена чаще всего встречается аминокистота: глицин
Определите, как будут вести себя при электрофорезе в нейтральной среде следующие аминокислоты
Фенилаланин → Останутся на линии старта,
Глутамат → Двигается к аноду,
Лизин → Двигается к катоду,
Аспартат → Двигается к аноду
Выберите утверждение, НЕПРАВИЛЬНО характеризующее активный центр белка.
образуется при формировании вторичной структуры
Какие функциональные группы аминокислот участвуют в образовании пептидной связи? аминогруппа и карбоксильная группа
Какие связи не могут быть разрушены при денатурации белка? Пептидные
Качественной реакцией на пептидную связь является
биуретовая реакция
Для каких радикалов предпочтительное расположение – на поверхности белковой молекулы:
полярные анионные радикалы аминокислот
Конформационная лабильность белка это...
изменение конформации за счет разрыва одних и образования других слабых связей
Нингидриновую реакцию используют для обнаружения:
остатки альфа-аминокислот
Какое значение концентрации белка в сыворотке крови характеризует гипопротеинемию? 35-60 г\л
Для нативной и денатурированной аспартатаминотрансферазы общим является
первичная структура
Активность каких изоферментов лактатдегидрогеназы (ЛДГ) повышается при заболеваниях печени:
ЛДГ -4,5
2. При постоянной концентрации фермента скорость реакции с увеличением количества субстрата:
увеличивается, затем остается постоянной
3. Выберите общее свойство для ферментов и неорганических катализаторов
способность катализировать прямую и обратную реакции
4.Выберите и расположите нужные ферменты в порядке увеличения времени достижения их максимальной концентрации в крови при инфаркте миокарда:
АСТ=3
Кратиатинкиназа МВ=1
Амилаза = не имеет диагностич значения
5. Подберите соответствия:
Трипсин – применяют для лечения гнойных ран |
Фибролизин – применяют при тромбоэмболии |
6. Увеличение активности отдельных фракций изоферментов наблюдается при:
увеличения их синтеза в тканях
повреждения клеток тканей, где они в основном синтезируютя
7. Кривая зависимости скорости ферментативной реакции от концентрации субстрата имеет следующий характер:
Гиперболический
8. Отклонение от гиперболического характера кривой зависимости скорости ферментативной реакции от концентрации субстрата наблюдается при следующем условии:
При аллостерической природе фермента
9. Установите соответствие: Ни один |
- Ответ 1 |
Vmax |
Ответ 3 |
10. При каком заболевании отмечается наиболее выраженное повышение активности фермента АсАт:
инфаркт миокарда
11. Температурный оптимум для работы большинства ферментов составляет:
36-38 градусов
12. К термостабильным ферментам можно отнести:
Tag –полимеразу
13. Аллостерические эффекторы изменяют активность фермента так как:
связываются с участком фермента, отличным от каталического центра И ЧТО ТО ЕЩЕ
14. Отпимум рН для работы ферментов -это:
значение рН, при котором активность фермента будет максимальной
15. Диастаза в моче определяется при:
Панкреатите
16. Изофермент креатинкиназы, использующийся как маркер повреждения сердечной мышцы:
КК – МВ
17. Активность ММ изоформы креатинкиназы в крови может увеличиваться при:
травме и повреждении скелетных мышц
18. Отклонение от оптимального значения рН приводит к снижению ферментативной активности, вследствии: изменения ионизации функциональных групп
19. Выберите способ регуляции активности ферментов, который является необратимым:
частичный протеолиз
20. Выберите пару аллостерических эффекторов, являющихся антагонистами:
АТФ и АДФ
21. Необратимый ингибитор:
прочно (ковалентно) связывается с активным или аллостерическим центром И ЧТО ТО ЕЩЕ
22. При добавлении субстрата ингибирование фермента конкурентным ингибитором:
Уменьшается
23. Частичным протеолизом активируются следующие ферменты
сериновые протеазы системы свертывания крови
трипсин
24. Протеинкиназа А:
фосфорилирует белки
25. Регуляторные ферменты чаще всего катализируют:
начальные реакции метаболических путей И ЧТО ТО ЕЩЕ
26. Какие из перечисленных аминокислот являются субстратами для реакций фосфорилирования:
тирозин
серин
27. Выберите верные утверждения. Фосфопротеинфосфатазы... дефосфорилируют белки И ЧТО ТО ЕЩЕ
28. Аллостерический центр это:
место присоединения неконкурентного ингибитора
29. Верно ли, что конкурентные ингибиторы ферментов способны изменять величину максимальной скорости ферментативной реакции (Vmax)?
Неверно
30. Все положения, характеризующие особенности строения и функционирования аллостерических ферментов правильные, кроме:
Проявляют регуляторные свойства только при диссоциации молекулы на протомеры
31. Выберите возможные причины конформационных изменений, приводящих к активации аллостерических ферментов
кооперативное взаимодействие субъединиц
32. Аденилатциклаза:
катализирует реакцию образования цАМФ
33. Что характерно для гомотропной регуляции?
субстрат и активатор - одно вещество
34. Какой из перечисленных ферментов принимает участие в процессе ковалентной модификации ферментов путем фосфорилирования:
Протеинкиназа
35. Степень ингибирования конкурентными ингибиторами можно снизить:
увеличением концентрации субстрата
Молекулы белка в изоэлектрической точке:
Электронейтральны
Пространственная структура белка, образованная за счет взаимодействия между радикалами аминокислот это:
третичная структура
Под первичной структурой белка понимают:
Последовательность аминокислотных остатков в полипептидной цепи, детерминированную генетически
Определите направление движения трипептида арг-про-лиз в нейтральной среде при электрофорезе.
к катоду
структурными мономерами белков являются
аминокислоты
Что представляют собой контактные поверхности протомеров в олигомерном белке
поверхностные участки протомеров, комплементарные друг другу, в результате пространственного и химического соответствия между двумя поверхностями образуется большое количество слабых связей
Одна молекула иммуноглобулина-G способна связывать антигены в количестве:
Два
В состав кофермента ФАД входит витамин:
В2
Какие изменения в ходе реакции происходят с веществом, называемым ферментом?
действует в качестве катализатора
Ферменты, катализирующие реакции декарбоксилирования органических веществ, относятся к классу
Лиазы
Аминокислоты, входящие в активный центр фермента, располагаются
в разных участках полипептидной цепи
К классу оксидоредуктаз относят:
Оксидазы И ЧТО ТО ЕЩЕ
коэнзим А (KоA) принимает участие в переносе группы:
CH3CO ─
Коферменты, образующиеся из витамина В2, называются
Флавиновые
Для ферментов характерны все виды специфичности, КРОМЕ:
Конформационной
Аэробные дегидрогеназы относятся к классу:
Оксидоредуктазы
Субстратом фермента амилазы является:
Крахмал
Конкурентный ингибитор может связываться с:
активным центром
Изофермент креатинкиназы, использующийся как маркер повреждения сердечной мышцы:
КК – МВ
Отпимум рН для работы ферментов -это:
значение рН, при котором активность фермента будет максимальной
Какой из ниже перечисленных ферментов используют в диагностике инфаркта миокарда:
Креатинкиназа
Какие изоформы лактатдегидрогеназы (ЛДГ) применяются для дифференциальной диагностики инфаркта миокарда:
ЛДГ – 2
ЛДГ – 1
Ферменты, в качестве лекарственных средств, применяют при:
их недостаточности
тромбозах и тромбоэмболимях
обработке гнойных ран
К термостабильным ферментам можно отнести:
Tag –полимеразу
Какой из перечисленных ферментов принимает участие в процессе ковалентной модификации ферментов путем фосфорилирования:
Протеинкиназа
Степень ингибирования конкурентными ингибиторами можно снизить:
Увеличением концентрации субстрата
Регуляторные ферменты чаще всего катализируют:
начальные реакции метаболических путей И ЧТО ТО ЕЩЕ
Разные формы фермента, катализирующие одну реакцию, отличающиеся физико-химическими свойствами и первичной структурой, называютсяОтвет Изоферменты
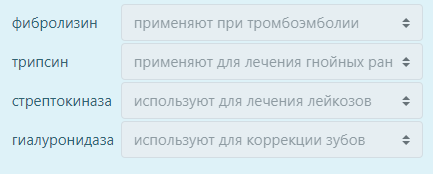
Подберите соответствия:
Фибролизин - применяют при тромбоэмболии
Гиалуронидаза - используют для коррекции зубов
Трипсин - применяют для лечегния гнойных ран
Стрептокиназа – используют для лечения лейкозов
Концентрация субстрата, при которой скорость реакции равна 1/2 Vmax - это :
константа Михаэлиса
Ферменты, в качестве лекарственных средств, применяют при:
обработке гнойных ран, тромбозах и тромбоэмболимях, их недостаточности
Определение ВВ изоформы креатинкиназы используют для диагностики:
не имеет диагностического значения
При каком значении Км фермент проявляет наибольшее сродство к субстрату:
Км = 1,0*10-6 М
Увеличение активности отдельных фракций изоферментов наблюдается при:
повреждения клеток тканей, где они в основном синтезируютя
увеличения их синтеза в тканях
Установите соответствия:
изоформа КК ВВ |
Ответ Синтезируются в основном в головном мозге |
изоформа КК МВ |
Ответ содержится в основном в сердце
|
изоформа КК ММ |
Ответ: встречается с основном в мышцах |
Какова будет скорость ферментативной реакции, если концентрация субстрата численно равна Км
половина максимальной скорости
Какой из ниже перечисленных ферментов используют в диагностике инфаркта миокарда:
Креатинкиназа
Кривая зависимости скорости ферментативной реакции от концентрации субстрата имеет следующий характер:
Гиперболический
При каком заболевании отмечается наиболее выраженное повышение активности фермента АсАт:
инфаркт миокарда
Отклонение от оптимального значения рН приводит к снижению ферментативной активности, вследствии:
изменения ионизации функциональных групп
Отпимум рН для работы ферментов -это:
значение рН, при котором активность фермента будет максимальной
К термостабильным ферментам можно отнести:
Tag -полимеразу
Выберите верное утверждение:
изоферменты катализируют один и тот же тип реакции, но отличаются по физико-химическим свойствам
Какие изоформы лактатдегидрогеназы (ЛДГ) применяются для дифференциальной диагностики инфаркта миокарда:
ЛДГ - 2
ЛДГ - 1
Скорость ферментативной реакции это:
изменение количества молекул субстрата или продукта за единицу времени
Изофермент креатинкиназы, использующийся как маркер повреждения сердечной мышцы: КК - МВ
Активность ММ изоформы креатинкиназы в крови может увеличиваться при:
травме и повреждении скелетных мышц
Отклонение от гиперболического характера кривой зависимости скорости ферментативной реакции от концентрации субстрата наблюдается при следующем условии:
При аллостерической природе фермента
При постоянной концентрации фермента скорость реакции с увеличением количества субстрата:
увеличивается, затем остается постоянной
В качестве аналитических реагентов используют следующие ферменты:
глюкозоксидазу
уреазу
Какой метод нельзя использовать для разделения смеси ферментов?
Диализ
Диастаза в моче определяется при:
панкреатите
Выберите общее свойство для ферментов и неорганических катализаторов
способность катализировать прямую и обратную реакции
Активность каких изоферментов лактатдегидрогеназы (ЛДГ) повышается при заболеваниях печени:
ЛДГ -4,5
Выберите утверждение, правильно характеризующее изоферменты:
Это различные формы фермента, катализирующие одну реакцию
Конкурентный ингибитор может связываться с:
активным центром
Температурный оптимум для работы большинства ферментов составляет:
36-38 градусов
Прозерин:
Используется при лечении мышечных дистрофий
Является структурным аналогом ацетилхолина
Связывается нековалентно с активным центром фермента
Аденилатциклаза:
катализирует реакцию образования цАМФ
Выберите способ регуляции активности ферментов, который является необратимым:
частичный протеолиз
Выберите неверное утверждение для обратимых ингибиторов:
Обратимые конкурентные ингибиторы являются суицидальными субстратами
Выберите субстрат для аденилатциклазы
АТФ
Зависимость скорости реакции от концентрации субстрата для ферментов с аллостерической регуляцией имеет вид:
S-образной кривой
Все положения, характеризующие особенности строения и функционирования аллостерических ферментов правильные, кроме:
Проявляют регуляторные свойства только при диссоциации молекулы на протомеры
Какой из перечисленных ферментов принимает участие в процессе ковалентной модификации ферментов путем фосфорилирования:
протеинкиназа
Установите соответствия:
Оба - учавствует в регуляции энергетического обмена
иснулин - активирует сигнальный путь, приводящий к дефофорилированию ферментов
глюкагон – действует в период между приемами пищи
ни один – синтезируется клетками печени
Необратимый ингибитор
прочно (ковалентно) связывается с активным или аллостерическим центром
Какое из ниже перечисленных веществ является специфическим ингибитором сульфгидрильных групп в ферментах?
Монойодацетат
Выберите возможные причины конформационных изменений, приводящих к активации аллостерических ферментов:
Конформационные изменения пространственно удаленных участков фермента
Кооперативное взаимодействие субъединиц
Индуцируемыми называются ферменты:
биосинтез которых активируется под влиянием определенного субстрата и условий
Частичным протеолизом активируются следующие ферменты
сериновые протеазы системы свертывания крови
трипсин
Какие из перечисленных аминокислот являются субстратами для реакций фосфорилирования:
тирозин
серин
Аллостерический центр это:
место присоединения неконкурентного ингибитора
Выберите верное утверждение:
Конкурентный ингибитор взаимодействует с активным центром
Выберите правильные утверждения. Протеинкиназы...
относятся к классу трансфераз
фосфорилируют белки
Кальмодулин приобретает сродство к кальмодулин-зависимой киназе гликогенфофорилазы в результате:
связывания ионов кальция
Выберите соответствие:
Неконкурентный ингибитор - не является аналогом субстрата
Конкурентный ингибитор – связывается с активным центром фермента
Ни один – образует ковалентные связи с субстратом, и тем самым ингибирует ферментативную реакцию
Высаливание белков осуществляется под действием
нейтральных солей щелочных и щелочноземельных металлов
Что лежит в основе метода разделения белков афинной хроматографией?
различия по величине заряда и по молекулярной массе
В формировании вторичной структуры белков принимают участие:
ни один из видов радикалов аминокислот
Высаливание белков осуществляется под действием
нейтральных солей щелочных и щелочноземельных металлов
В каком из перечисленных процессов применяется диализ?
Очистка белков от низкомолекулярных соединений
Белки являются...
полимерными биомакромолекулами
Определите, как будут вести себя при электрофорезе в нейтральной среде следующие аминокислоты
Лизин – двигается к катоду
Фенилаланин – останутся на линии старта
Аспартат – двигается к аноду
Глутамат – двигается к аноду
При поведении электрофореза в условиях, где рН буферного раствора выше, чем изоэлектрическая точка белка, последний:
Мигрирует к аноду
Метод разделения белков гель-фильтрацией основан на:
различии по молекулярной массе
К изофункциональным ферментам относят:
гексокиназу
К классу оксидоредуктаз относят:
дегидрогеназы
оксидазы
Ферменты, катализирующие расщепление внутримолекулярных связей при участии воды, называются:
гидролазы
Полипептидная часть фермента называется
апофермент
Аэробные дегидрогеназы относятся к классу:
оксидоредуктазы
Ферменты выполняют каталическую функцию, так как:
снижают энергию активации
Участок молекулы фермента, к которому присоединяется вещество, способное вызвать изменение ее конфигурации, называется
аллостерическим центром
Подберите к каждому из перечисленных классов ферментов витамины, производные которых могут быть кофакторами данного класса ферментов
|
Лиазы В1, В6
Трансферазы В5, В6
Изомеразы В12
Оксидоредуктазы В2, В3
Лигазы Н
Витамин В1 является предшественником кофермента:
ТПФ
Определение ВВ изоформы креатинкиназы используют для диагностики:
не имеет диагностического значения
Активность каких изоферментов лактатдегидрогеназы (ЛДГ) повышается при заболеваниях печени:
ЛДГ -4,5
Кривая зависимости скорости ферментативной реакции от концентрации фермента:
имеет линейный характер
Действие конкурентного ингибитора можно устранить:
добавлением избытка субстрата
Конкурентный ингибитор может связываться с:
активным центром
Какие требования предъявляются к ферментам, которые можно использовать в целях энзимодиагностики. Все утверждения верны, КРОМЕ:
Высокая активность ферментов в сыворотке крови в норме
Ферменты, в качестве лекарственных средств, применяют при:
обработке гнойных ран
их недостаточности
тромбозах и тромбоэмболимях
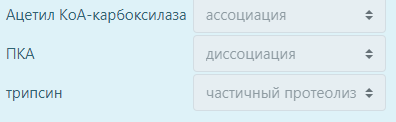
Установите соответствия между ферментом и способом его активации:
|
Ацетил КоА – карбоксилаза – ассоциация
Трипсин – частичный протеолиз
ПКА - диссоциация
В комплексе с ГДФ G-белок:
ассоциирован с рецептором
Кальмодулин приобретает сродство к кальмодулин-зависимой киназе гликогенфофорилазы в результате:
связывания ионов кальция
Какие из перечисленных аминокислот являются субстратами для реакций фосфорилирования:
тирозин
серин
С помощью биуретовой реакции обнаруживают:
-СО-NH- группировку атомов пептидной связи
В плазме методом электрофореза на ацетатцеллюлозе можно выделить … белковых фракций:
5 белковых фракций:
Выберите белки которые НЕ ОТНОСЯТСЯ к гемопротеинам
альбумин
трансферин
Дайте наиболее полное определение комплементарности
пространственное и химическое соответствие взаимодействующих поверхностей
Какой метод НЕ используют для определения количества ОБЩЕГО БЕЛКА в биопробах?
взаимодействие с БКЗ
Белки денатурируют в клетке в результате:
Разрыва слабых связей, поддерживающих конформацию белка
Молекулы белка в изоэлектрической точке:
Электронейтральны
Участвуют в формировании третичной структуры белковой молекулы
оба вида радикалов аминокислот
Вторичная структура этого белка представлена только альфа-спиралями
оба
Какие изменения в ходе реакции происходят с веществом, называемым ферментом?
действует в качестве катализатора
Большинство ферментов проявляют максимальную активность при pH
близком к нейтральному
Мультиферментные комплексы состоят из:
нескольких ферментов, катализирующих превращения одного субстрата в нескольких реакциях
Фермент уреаза катализирует гидролиз:
мочевины
Активность ферментов рекомендуется измерять в следующих условиях:
в буфере с оптимальным значением рН
Сравните взаимодействие фермента с субстратом и эффектором
|
Связывание вызывает конформационные изменения фермента – субстрат
Связывается с регуляторным центром – аллостерический эффектор
Всегда является низкомолекулярным соединением - аллостерический эффектор
Претерпевает структурные изменения в ходе катализа – субстрат
Зависимость скорости реакции от концентрации фермента можно выявить только при условии:
при избытке субстрата
Ферменты, катализирующие реакции декарбоксилирования органических веществ, относятся к классу
лиазы
При постоянной концентрации фермента скорость реакции с увеличением количества субстрата:
увеличивается, затем остается постоянной
При каком значении Км фермент проявляет наибольшее сродство к субстрату:
Км = 1,0*10-6 М
Изофермент креатинкиназы, использующийся как маркер повреждения сердечной мышцы:
КК - МВ
Неодинаковая скорость протекания одного и того же метаболического пути в разных органах обусловлена следующими различиями. Все утверждения правильные, КРОМЕ:
Ферментным составом
Температурный оптимум для работы большинства ферментов составляет:
36-38 градусов
При каком заболевании отмечается наиболее выраженное повышение активности фермента АсАт:
инфаркт миокарда
Какой метод нельзя использовать для разделения смеси ферментов?
Диализ
Отклонение от оптимального значения рН приводит к снижению ферментативной активности, вследствии:
изменения ионизации функциональных групп
окисление дисульфидных связей
Степень ингибирования конкурентными ингибиторами можно снизить:
Увеличением концентрации субстрата
Какие положения верно характеризуют активный центр ферментов:
между активным центром и субстратом имеется комплементарность
это участок, непосредственно взаимодействующий с субстратом и участвующий в катализе
Реакцию превращения цАМФ в АМФ катализирует фермент:
Фосфодиэстераза
Активатором для протеинкиназы А является:
цАМФ
Выберите субстрат для аденилатциклазы
АТФ
Укажите способ регуляции активности фермента в следующей реакции: Гликогенсинтетаза (неактивная) + ? → Н3РО4 + гликогенсинтетаза (активная).
путем фосфорилирования и дефосфорилирования
Чем обусловлена S-образная зависимость скорости ферментативной реакции от концентрации субстрата аллостерических ферментов в присутствие эффекторов?
кооперативным эффектом
Выберите правильные утверждения. Протеинкиназы...
фосфорилируют белки
относятся к классу трансфераз
Аспирин
Является необратимым ингибитором циклооксигеназы
Снижает образование простагландинов
Связывается с активным центром
В качестве аналитических реагентов используют следующие ферменты: уреазу глюкозоксидазу
|


