
- •Какие функциональные группы аминокислот участвуют в образовании пептидной связи?
- •Участвуют в формировании третичной структуры белковой молекулы
- •Что лежит в основе метода разделения белков афинной хроматографией?
- •Из приведенных аминокислот выберите ту, радикал которой может участвовать в образовании водородных связей
- •Какое значение концентрации белка в сыворотке крови является нормой
Выберите наиболее правильное определение третичной структуры белка
Правильный ответ: конформация полипептидной цепи, обусловленная взаимодействием радикалов аминокислот
С помощью биуретовой реакции обнаруживают:
Правильный ответ: -СО-NH- группировку атомов пептидной связи
Какой из белков содержит одну полипептидную цепь?
Правильный ответ: миоглобин
Белки являются...
Правильный ответ: полимерными биомакромолекулами
Пространственная структура белка, образованная за счет взаимодействия между радикалами аминокислот это:
Правильный ответ: третичная структура
Конформация белка - это
Правильный ответ: пространственное взаиморасположение атомов в белковой молекуле
Из приведенных аминокислот выберите ту, радикал которой может участвовать в образовании водородных связей
Правильный ответ: Серин
Образование доменов в молекуле белка происходит на уровне...
Правильный ответ: третичной структуры
Сродство к кислороду:
Правильный ответ: больше у миоглобина, чем у гемоглобина
какое значение концентрации белка в сыворотке крови является нормой
Правильный ответ: 65-85 г\л
Пространственная организация фрагмента белка, которая стабилизируется водородными связями между атомами пептидного остова это:
Правильный ответ: вторичная структура
Метод разделения белков гель-фильтрацией основан на:
Правильный ответ: различии по молекулярной массе
Домен - это.
Правильный ответ:
элемент третичной структуры белка, выполняющий какую-либо его функцию
Дайте наиболее полное определение комплементарности
Правильный ответ: пространственное и химическое соответствие взаимодействующих поверхностей
Метод разделения белков ионообменной хроматографией основан на:
Правильный ответ: различиях в величине заряда
Качественной реакцией на пептидную связь является
Правильный ответ: биуретовая реакция
Высаливание белков осуществляется под действием
Правильный ответ:
нейтральных солей щелочных и щелочноземельных металлов
Под первичной структурой белка понимают:
Правильный ответ: Последовательность аминокислотных остатков в полипептидной цепи, детерминированную генетически
Молекулы белка в изоэлектрической точке:
Правильный ответ: электронейтральны
Какая из перечисленных аминокислот содержит гетероцикл?
Правильный ответ: триптофан
Определите направление движения трипептида арг-про-глу в щелочной среде при электрофорезе
Правильный ответ: к аноду
Конформация белка это
Пространственное расположение атомов в белковой молекуле
Денатурация белков сопровождается:
Правильные ответы: изменением нековалентных связей, потерей способности взаимодействовать с природным лигандом, нарушением пространственной структуры
Под денатурацией белка понимают:
Правильный ответ: нарушение структуры и функции белка
Определите направление движения трипептида арг-про-лиз в нейтральной среде при электрофорезе.
Правильный ответ: к катоду
Какая группа определяет гидрофильность белковой молекулы
Правильный ответ: -COO
При поведении электрофореза в условиях, где рН буферного раствора выше, чем изоэлектрическая точка белка, последний:
Правильный ответ: Мигрирует к аноду
Какой из перечисленных радикалов придает гидрофобность белковой молекуле
Правильный ответ: -CH2-CH3
Водородные связи принимают участие в стабилизации уровней структурной организации белковой молекулы:
Правильный ответ: вторичной, третичной и четвертичной
Гемоглобины А и S:
Правильный ответ: являются вариантами одного индивидуального белка
Расположите элементы структуры белковой молекулы в той последовательности, в которой они возникают при синтезе белка и формировании его нативной конформации
Образование пептидных связей → 1,
Образование гидрофобных, водородных и ионных связей между радикалами аминокислот → 3,
Формирование α-спиралей и β-складчатых участков → 2,
Объединение протомеров в олигомерный белок → 4
Для каждой аминокислоты подберите соответствующее свойство ее радикала
Правильный ответ: аспарагиновая кислота → гидрофильный с анионной группой, триптофан → гидрофобный, серин → гидрофильный незаряженный, аргинин → гидрофильный с катионной группой
Какие функциональные группы аминокислот участвуют в образовании пептидной связи?
Правильный ответ: аминогруппа и карбоксильная группа
Трансмембранные домены интегральных белков богаты
Правильные ответы: изолейцином, валином
Участвуют в формировании третичной структуры белковой молекулы
Правильный ответ: оба вида радикалов аминокислот
Что лежит в основе метода разделения белков афинной хроматографией?
Правильный ответ: комплементарность
На сколько основных белковых фракций может быть разделена плазма крови с использованием электрофореза на полосках ацетата целлюлозы?
Правильный ответ: 5
Для нативной и денатурированной аспартатаминотрансферазы общим является
Правильный ответ: первичная структура
Какие связи не могут быть разрушены при денатурации белка?
Правильный ответ: пептидные
Секвенированием называется:
Правильный ответ: Определение последовательности аминокислот в полипептидной цепи
Температурный оптимум для работы большинства ферментов составляет:
36-38 градусов
При постоянной концентрации фермента скорость реакции с увеличением количества субстрата:
увеличивается, затем остается постоянной
Какой метод нельзя использовать для разделения смеси ферментов?
диализ
При каком заболевании отмечается наиболее выраженное повышение активности фермента АсАт:
инфаркт миокарда
Диастаза в моче определяется при:
панкреатите
Установите соответствия: изоформа

Какие изоформы лактатдегидрогеназы (ЛДГ) применяются для дифференциальной диагностики инфаркта миокарда:
ЛДГ – 1, ЛДГ – 2
Разные формы фермента, катализирующие одну реакцию, отличающиеся физико-химическими свойствами и первичной структурой, называются
Ответ изоферменты
Какие требования предъявляются к ферментам, которые можно использовать в целях энзимодиагностики. Все утверждения верны, КРОМЕ:
Высокая активность ферментов в сыворотке крови в норме
В качестве аналитических реагентов используют следующие ферменты:
уреазу, глюкозоксидазу
Отклонение от гиперболического характера кривой зависимости скорости ферментативной реакции от концентрации субстрата наблюдается при следующем условии:
При аллостерической природе фермента
Выберите утверждение, правильно характеризующее изоферменты:
Это различные формы фермента, катализирующие одну реакцию
Скорость ферментативной реакции это:
изменение количества молекул субстрата или продукта за единицу времени
Скорость каталитической реакции зависит от:
концентрации кофактора
Концентрация субстрата, при которой скорость реакции равна 1/2 Vmax - это : константа Михаэлиса
Конкурентный ингибитор может связываться с:
активным центром
Какое из ниже перечисленных положений соответствует определению понятия Кm:
это концентрация субстрата, при которой скорость реакции равна 1/2 Vmax
Выберите верное утверждение:
изоферменты катализируют один и тот же тип реакции, но отличаются по физико-химическим свойствам
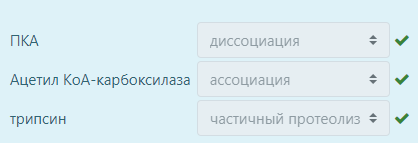
Установите соответствия между ферментом и способом его активации: ПКА,трипсин
При добавлении субстрата ингибирование фермента конкурентным ингибитором:
Уменьшается
Необратимый ингибитор:
прочно (ковалентно) связывается с активным или аллостерическим центром,
его эффективность не изменяется при добавлении субстрата
Выберите способ активации фермента по типу ковалентной модификации:
фосфорилирование, метилирование
Какие из перечисленных аминокислот являются субстратами для реакций фосфорилирования:
тирозин, серин
Индуцируемыми называются ферменты:
биосинтез которых активируется под влиянием определенного субстрата и условий
Фосфолипаза С:
катализирует реакцию образования ДАГ и ИФ3
Зависимость скорости реакции от концентрации субстрата для ферментов с аллостерической регуляцией имеет вид:
S-образной кривой
Выберите возможные причины конформационных изменений, приводящих к активации аллостерических ферментов
кооперативное взаимодействие субъединиц
Какое из ниже перечисленных веществ является специфическим ингибитором сульфгидрильных групп в ферментах?
Монойодацетат
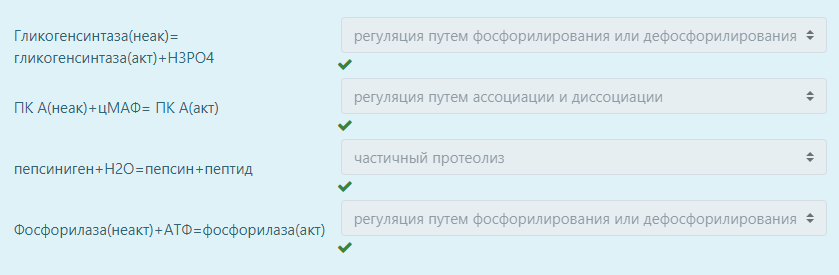
Для каждого фермента выберите способ регуляции его активности
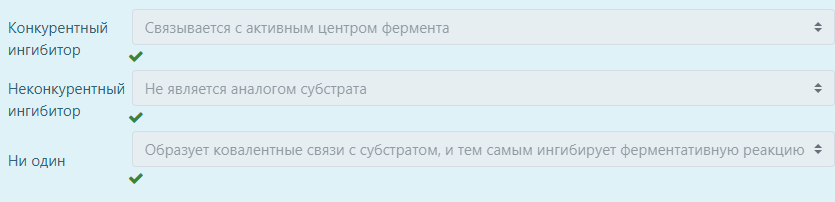
Выберите соответствие:
цАМФ активирует:
протинкиназу А
Какие положения верно характеризуют активный центр ферментов:
это участок, непосредственно взаимодействующий с субстратом и участвующий в катализе,
между активным центром и субстратом имеется комплементарность
Выберите правильные утверждения. Протеинкиназы...
фосфорилируют белки, относятся к классу трансфераз
Выберите верное утверждение:
Конкурентный ингибитор взаимодействует с активным центром
Выберите способ регуляции активности ферментов, который является необратимым:
частичный протеолиз
Какие функциональные группы аминокислот участвуют в образовании пептидной связи?
аминогруппа и карбоксильная группа
В каком из перечисленных процессов применяется диализ?
Очистка белков от низкомолекулярных соединений
В каком из перечисленных процессов применяется диализ?
Очистка белков от низкомолекулярных соединений
Что представляет собой центр узнавания белка лигандом ?
Участок белка, комплементарный лиганду
