
Сизенцов А.Н. Общая вирусология с основами таксономии вирусов позвоночных
.pdfдля обеспечения стандартности проведения анализов произведена разработка«су-
хих» тест-систем третьего поколения. Их несомненным преимуществом по сравне-
нию с аналогичными «жидкими» тест-системами является возможность хранения и транспортировки при любой температуре (от минус 40 °С до 30 °С), ускорение и уп-
рощение работы исполнителя. При этом тест-системы третьего поколения позволя-
ют использовать все преимущества тест-систем первого и второго поколений в раз-
личных модификациях.
В настоящее время метод ПЦР адаптирован для выявления большинства бак-
терий, простейших и вирусов, имеющих медицинское значение. Особенное место данный метод приобрел в вирусологии. Благодаря своим высоким диагностическим качествам ПЦР является общепризнанным дополнением к традиционным методам,
использующимся в вирусологии: размножению вируса в культуре клеток, серологи-
ческому выявлению вирусных антигенов, электронной микроскопии. Существен-
ным преимуществом данного метода является возможность выявлять вирусы при латентных инфекциях (цитомегаловирус, вирус герпеса) и вирусы, которые трудно или пока невозможно культивировать(вирус иммунодефицита человека, вирус Эп-
штейна-Борр, вирус папилломы человека, вирус гепатита В и др.). С методом ПЦР связываются перспективы изучения таких заболеваний, как болезнь Крейтцфельда-
Якоба, Альцгеймера, рассеянный склероз.
10.2 Вирусологический метод
Вирусологическая диагностика — основана на выделении из исследуемого материала вируса и его последующей идентификации.
Вирусы в отличие от бактерий размножаются лишь в живых клетках. В связи с этим культивирование вирусов может осуществляться на уровне организма - под опытного животного (куриный эмбрион как развивающийся организм относят к подопытным животным) или живой клетки, выращиваемой вне организма, т.е. на уровне культуры клеток.
251
10.2.1 Работа с клеточными культурами
Как известно, вирусы являются генетическими внутриклеточными паразита-
ми, способными к размножению только в живых системах. Следовательно, первым этапом вирусологической диагностики является получение и подготовка одной из живых систем: культур клеток, куриных эмбрионов или чувствительных лаборатор-
ных животных. Наиболее трудоемкой является работа с клеточными культурами, на которой следует остановиться подробнее.
На практике используют первичные, полуперевиваемые (диплоидные) и пере-
виваемые клеточные культуры.
Первичные клеточные культуры. Эти культуры получают непосредственно из ткани животного или человека путем разрушения протеолитическими ферментами
(трипсин, коллагеназа, проназа) межклеточного вещества. Разобщенные (дисперги-
рованные) клетки, помещенные в питательную среду, способны прикрепляться к по-
верхности культурального сосуда и размножаться, образуя так называемый моно-
слой – слой толщиной в одну клетку. С помощью специальных реактивов (трипсина,
версена) клетки можно снять с поверхности одного сосуда и пересадить в другой.
Такая манипуляция называется пассажем. Поскольку первичные культуры получают из уже сформировавшихся, высокодифференцированных клеток, их способность к делению и размножению ограниченна. Первичные культуры выдерживают от5 до
10 пассажей.
Первичные клеточные культуры готовят из любой эмбриональной ткани жи-
вотных и человека, поскольку эмбриональные клетки обладают повышенной спо-
собностью к росту и размножению. Чаще культуры клеток готовят из смеси -не скольких тканей, например кожной, костной и мышечной. Так получают фибробла-
сты эмбриона человека (ФЭЧ) и кур (КФ), клетки почек человека (КПЧ) и др. Для получения клеточных культур используют эмбриональную ткань человека(в случае прерывания беременности), а также 8-12-дневные куриные эмбрионы.
Культивирование клеток осуществляют в стеклянных или пластмассовых со-
судах различной формы и размера, желательно одноразового пользования, при стро252
гом соблюдении асептики на всех этапах.
Приготовление клеточной взвеси. Ткань, доставленную в лабораторию, отмы-
вают от крови, жировых компонентов, клеточного детрита и других примесей в рас-
творе Хенкса или фосфатного буфера с антибиотиками, измельчают ножницами и продолжают отмывать до полной прозрачности раствора. Затем ее заливают трипси-
ном (на 100 г ткани – от 200 мл до 300 мл раствора трипсина) и диспергируют при помощи магнитной мешалки или пипетированием. Надосадочную жидкость, содер-
жащую трипсинизированные клетки, сливают и помещают в холодильник при 4 °С.
Трипсинизацию повторяют несколько раз. Взвесь клеток центрифугируют при
600 об/мин в течение от5 до 10 мин, ресуспендируют в питательной среде и окра-
шивают фуксином, метиленовой синью или другими красителями, а затем опреде-
ляют их концентрацию в камере Горяева. Клеточную взвесь разводят питательной средой до концентрации от 4 ´ 105 до 8 ´ 105 клеток в 1 мл, разливают в культураль-
ные сосуды, плотно закрывают резиновыми пробками и культивируют в термостате при температуре от 35 °С до 37 °С в течение времени от 48 до 96 ч (пробирки кладут под углом 5°), после чего отбирают культуры с хорошо сформировавшимся моно-
слоем.
Пассирование клеточных культур. Во флаконы с клетками после отсасывания питательной среды наливают подогретый до37 °С раствор 0,25 %-го трипсина или
0,02 %-го версена и помещают их на промежуток времени от 3 до 5 мин в термостат.
Затем версен или трипсин удаляют, в культуральный сосуд добавляют небольшое количество питательной среды и, интенсивно взбалтывая, добиваются суспензиро-
вания клеток в питательной среде. После этого подсчитывают количество клеток,
доводят их до необходимой концентрации и разливают в новые флаконы.
Перевиваемые (пассажные) клеточные культуры. Такие культуры способны выдерживать неограниченное число пассажей. Они происходят из опухолевых кле-
ток, утративших дифференциацию, и не имеющих ограничений роста. Перевивае-
мые (стабильные) клеточные культуры получены из разнообразных нормальных и опухолевых тканей человека: амниона (А-0, АЛ, FL), почек (Rh, ППЧ), карциномы шейки матки (HeLa), раковой опухоли гортани (НЕр-2), костного мозга больного ра-
253
ком легких (Detroit), рабдомиосаркомы эмбриона человека (RD) и др.
Клетки перевиваемых линий сохраняют замороженными в жидком азоте, при необходимости их оттаивают и используют для исследований.
Помимо стационарного способа культивирования с регулярными пассажами,
описанного выше для первичных культур, для большинства перевиваемых клеточ-
ных культур возможно применение метода суспензионных культур, при котором клетки находятся в жидкой среде во взвешенном состоянии. Модификацией данного метода является проточное культивирование, при котором в специальный аппарат
(ферментер или роллерный культиватор) непрерывно добавляют свежую питатель-
ную среду и удаляют отработанную. Подобный метод позволяет в любой момент получить значительные количества клеточной массы для культивирования вирусов;
он применяется, как правило, в крупных лабораториях или при промышленном про-
изводстве вакцин.
Полуперевиваемые (диплоидные) культуры. В результате нескольких после-
довательных пассажей иногда формируется так называемая диплоидная культура– популяция фибробластоподобных клеток, которые способны к быстрому размноже-
нию, выдерживают от 30 до 60 пассажей и сохраняют исходный набор хромосом.
Диплоидные клетки человека высокочувствительны к ряду вирусов и широкоис пользуются в вирусологии, занимая промежуточное положение между первичными и перевиваемыми клеточными культурами.
Получены культуры диплоидных клеток человека(PW-38, MRC-5, MRC-9, IMR-90 и др.), а также коровы, свиньи, овцы, ягненка.
Питательные среды для культур клеток. В составе этих сред имеется полный набор аминокислот, витамины, ростовые факторы. Наряду с сухими средами и от-
дельными компонентами выпускают готовые жидкие среды(199, Игла, гидролизат лактальбумина, сухие среды и концентраты), которые перед использованием обычно разводят в воде.
Культуральные среды делят на ростовые и поддерживающие. Для выращива-
ния клеточных культур применяются ростовые среды, обогащенные сыворотками животных и человека, например бычья сыворотка, фетальная (эмбриональная) коро-
254
вья сыворотка и др. Количество сыворотки в питательной среде обычно составляет от 2 % до 30 % и зависит от свойств культуры клеток и состава среды.
Поддерживающие среды. Их применяют для сохранения выросших монослоев клеток после заражения их вирусами. Эти среды содержат меньшее количество сы-
воротки или добавляются к культуре без нее. Перед использованием среды в нее вносят антибиотики для предотвращения роста случайно попавших микроорганиз-
мов. Культуральные среды стерилизуют, а при наличии нестабильных компонен-
тов – фильтруют. Оптимальные значения рН питательных сред(от 7,2 до 7,6) под-
держивают с помощью буферных систем(чаще всего используют бикарбонатный буфер). В среды добавляют индикатор феноловый красный, который становится оранжево-желтым при закислении и малиновым при защелачивании среды.
Культивирование клеток вне организма требует выполнения ряда условий.
Одним из них является строгое соблюдение стерильности при работе, .к. исполь-
зуемые питательные среды служат отличным питательным субстратом также для бактерий и грибов. Клетки тканей обладают весьма высокой чувствительностью к солям тяжелых металлов. Поэтому необходимо придавать исключительное значение качеству различных ингредиентов, входящих в состав солевых растворов и пита-
тельных сред, а также способам обработки посуды и резиновых пробок, применяе-
мых при культивировании клеток.
Одним из обязательных условий успешной работы с клетками является высо-
кое качество дистиллированной воды(проверяется 2 раза в неделю). Для работы с клетками используют бидистиллированную или деионизированную воду. Лучшими дистилляторами являются приборы из стекла или легированной стали: из такой ап-
паратуры не вымываются ионы тяжелых металлов, являющиеся токсичными для клеток. Деионизированную воду получают на специальных установках, где очистка воды от солей осуществляется при ее последовательном прохождении через колонки с анионитом и катионитом.
При культивировании клеток особенно большие требования предъявляют к подготовке и стерилизации посуды и пробок. Во многих случаях именно неправиль-
ные их мойка и стерилизация служат причиной неприкрепления клеток к стеклу или
255
быстрой дегенерации клеточного монослоя. Обработка стеклянной посуды для культур клеток состоит из нескольких этапов.
1 Тщательное мытье с помощью ерша в горячей воде нейтральным моющим средством.
2 Многократное промывание (с трехкратной сменой) дистиллированной во-
дой.
3 Сушка в сушильном шкафу при температуре от 80 °С до 100 °С.
4 Матрацы для культивирования клеток закрывают фольгой или бумагой; пи-
петки с тупого конца закрывают ватой, обёртывают бумагой и укладывают в метал-
лические пеналы по 10 или 30 шт. Пробирки закрывают фольгой, укладывая в пачки по 10 шт., и заворачивают в бумагу. Чашки Петри обёртывают бумагой по 1, 2, 3 шт.
Стеклянную посуду стерилизуют сухим жаром от 3 до 4 ч при 180 °С в сухожаровом шкафу.
Новую стеклянную посуду моют теплой водой с моющим порошком, ополас-
кивают раствором хромпика, тщательно промывают водопроводной водой в течение
15 мин. После этого обрабатывают посуду по приведенной методике.
Использованную посуду автоклавируют при130 °С в течение 30 мин, затем заливают на 24 ч 5 % раствором хлорамина. Затем промывают не менее 3 раз водо-
проводной водой и обрабатывают по приведенной ранее методике.
Металлические инструменты моют в горячей воде с мылом, промывают водо-
проводной и дистиллированной водой. Стерилизуют кипячением в дистиллирован-
ной воде в течение 30 мин. Во время работы в стерильном боксе металлические ин-
струменты держат в стакане с 96 % этиловым спиртом, перед использованием обжи-
гают. Новые резиновые пробки кипятят в2 % растворе соды в течение30 мин и 5
раз промывают водопроводной водой, дважды повторяя кипячение и промывку. За-
тем кипятят 30 мин в дистиллированной воде, сушат при комнатной температуре,
укладывают в пачки, стерилизуют в паровом стерилизаторе.
Пробки, бывшие в употреблении, кипятят 30 мин в водопроводной воде с ней-
тральным порошком, промывают водопроводной и дистиллированной водой, затем кипятят в дистиллированной воде 30 мин и обрабатывают по приведенной методике.
256
Для роста и размножения клеток вне организма необходим сложный комплекс физико-химических факторов: определенная температура, концентрация водород-
ных ионов, неорганические соединения, углеводы, аминокислоты, белки, витамины,
кислород и углекислота. Чтобы обеспечить все эти требования для культивирования вирусов в культурах клеток, используют сложные по составу питательные среды. По характеру компонентов, входящих в их состав, эти среды делят на две группы.
1 Среды, представляющие смеси солевых растворов (Хенкса, Эрла и др.) и ес-
тественных компонентов (сыворотка крови животных и человека, гидролизат аль-
бумина). Количество каждого из этих компонентов в разных прописях сред значи-
тельно варьирует.
2 Синтетические и полусинтетические среды, состоящие из солевых растворов
(Эрла, Хенкса и др.) с добавлением аминокислот, витаминов, коэнзимов и нуклеоти-
дов (среды Игла, 199 и др.). В синтетических средах клетки могут существовать в жизнеспособном состоянии непродолжительное время(до 7 дней). Для более дли-
тельного поддержания их в жизнеспособном состоянии, а также для создания луч-
ших условий роста и размножения клеток к синтетическим средам добавляют сыво-
ротку животных (коров, телят и др.).
Для выделения вирусов могут быть использованы разные методы культивиро-
вания клеток вне организма. Однако в настоящее время наибольшее практическое применение получили однослойные культуры первично-трипсинизированных и пе-
ревиваемых линий клеток. Однослойные культуры клеток выращивают в стеклян-
ных плоскостенных сосудах-матрацах вместимостью1 л, 250 мл и 100 мл или в обычных бактериологических пробирках, обработанных соответствующим спосо-
бом.
При использовании первично-трипсинизированных культур клеток сущность метода заключается в разрушении межклеточных связей в тканях протеолитически-
ми ферментами и разобщении клеток для выращивания монослоя на поверхности стекла. Источником получения клеток могут служить ткани и органы эмбрионов че-
ловека и животных, забитых животных и птиц, а также извлеченные у человека при операции. Используют нормальные и злокачественные перерожденные ткани, эпи257
телиальные, фибробластического типа и смешанные. Способность к размножению клеток, извлеченных из организма, тесно связана со степенью дифференциации тка-
ни. Чем меньше дифференцирована ткань, тем более интенсивной способностью пролиферации обладают ее клетки in vitro. Поэтому клетки эмбриональных и опухо-
левых тканей значительно легче культивировать вне организма, чем нормальные клетки взрослых животных. Схема получения культуры клеток из куриных эмбрио-
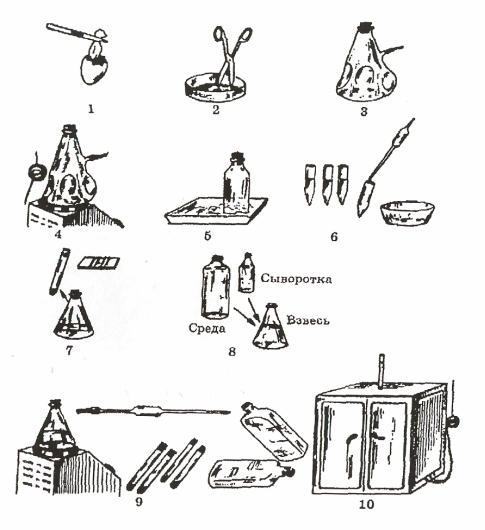
нов представлена на рисунке 43.
1 – извлечение эмбриона; 2 – отсечение головы, измельчение; 3 – многократ-
ное промывание; 4 – трипсинизация; 5 – объединение взвеси клеток в сосуде на тающем льду; 6 – центрифугирование и удаление трипсина; 7 – ресуспензирование осадка в небольшом количестве среды, подсчет; 8 – доведение до нужной концен-
трации; 9 – посев клеток в сосуды; 10 – термостатирование.
Рисунок 43 – Схема получения культуры клеток
258
Ткань, подготовленную к трипсинизации, переносят в чашку Петри и в асеп-
тических условиях измельчают ножницами до размера от2 мм до 4 мм. Кусочки тщательно отмывают от крови солевым раствором и пинцетом переносят в колбу для трипсинизации. Наибольший выход жизнеспособных клеток при диспергирова-
нии тканей дает трипсин в0,25 % концентрации. Кусочки ткани в колбе заливают двойным объемом 0,25 % раствора трипсина, подогретого до температуры от 32 °С
до 37 °С, и помещают в термостат. Ткани взрослых животных инкубируют при
37 °С – 30 мин, эмбрионов – 10 мин. Во время инкубации ткань периодически пере-
мешивают путем вращения колбы. Надосадочную жидкость, содержащую взвесь клеток, отсасывают в центрифужные пробирки, а ткань заливают повой порцией трипсина. Дробную трипсинизацию проводят до полного истощения ткани, о чем судят по прозрачности надосадочной жидкости. Собранные порции надосадочной жидкости центрифугируют при 1000 об/мин в течение 5 мин. После центрифугиро-
вания надосадочную жидкость удаляют, а осадок клеток однократно отмывают со-
левым раствором. Взвесь клеток контролируют на стерильность путем посева по
0,1 мл в пробирки с сахарным бульоном. Затем подсчитывают клетки в камере Го-
ряева. После подсчета взвесь клеток разводят питательной средой с таким расчетом,
чтобы в 1 мл содержалось от 2 ´ 105 до 3 ´ 105 клеток, и разливают в пробирки от
1 мл до 1,5 мл; в матрацы, вместимостью 1 л, 250 мл и 100 мл, вносят соответствен-
но 100 мл, 40 мл и 15 мл взвеси клеток.
Пробирки и матрацы с суспензией клеток плотно закрывают резиновым пробками (для предупреждения улетучивания СО, и защелачивания среды) и поме-
шают в термостат при 37 °С. Матрацы располагают в горизонтальном положении, а
пробирки укладывают на лотки или специальные подставки под углом от 5° до 10°.
Ежедневно культуры просматривают под малым увеличением микроскопа для определения характера их роста. Если клетки не пролиферируют, они выглядят ок-
руглыми, зернистыми, темными и отслаиваются от стекла, это свидетельствует о плохой обработке посуды или токсичности ингредиентов питательной среды.
Наряду с первично-трипсинизированными тканями, для культивирования ви-
259
русов широко используют культуры перевиваемых клеток, .е. культуры клеток,
способных к размножению вне организма неопределенно длительное время. Наибо-
лее часто применяют культуры клеток, полученные из нормальных и раковых тка-
ней человека. Широкую известность приобрела линия клетокHeLa, полученная из опухоли шейки матки, Нер-2 – из карциономы гортани, KB – из ткани рака полости рта. Готовят такие культуры клеток и из нормальных тканей животных– почки обезьяны, кролика и эмбриона свиньи.
Для пересева перевиваемых клеток питательную среду отсасывают пипеткой и выливают. Сформировавшийся тонкий слой клеток разрушают0,25 % раствором трипсина или 0,02 % раствором версена и освобожденные таким образом клетки пе-
реносят в новый сосуд со свежим питательным раствором, где вновь образуется мо-
нослой клеток.
10.2.2 Инфицирование живых систем вируссодержащим материалом
10.2.2.1 Культуры клеток
При выделении вирусов из различных инфекционных материалов в каждом случае применяют культуры клеток, обладающие наибольшей чувствительностью к предполагаемому вирусу. Для выделения вируса отбирают пробирки со сформиро-
ванным монослоем, сливают питательную среду и промывают клетки несколько раз раствором Хенкса для удаления сывороточных антител и ингибиторов. В каждую пробирку вносят от 0,1 мл до 0,2 мл материала, специально подготовленного для ви-
русологического исследования.
В 4, 5, 6 пробирок с культурами клеток каждой пробы исследуемого материала вводят вирусы. Чтобы исследуемый материал (фекалии и др.) не оказывал токсиче-
ского действия на монослой клеток, его предварительно разводят в1 мл питатель-
ной среды. После контакта вируса с клетками от 30 до 60 мин при комнатной темпе-
ратуре в пробирки вносят 1,5 мл поддерживающей среды (питательная среда без до-
бавления сыворотки крови телят). Заражение культуры инкубируют при температу260
