
Сизенцов А.Н. Общая вирусология с основами таксономии вирусов позвоночных
.pdfноглобулины класса IgG – основные антитела со строго выраженной специфично-
стью, в то время как иммуноглобулины класса IgA играют роль в формировании ме-
стного иммунитета слизистых оболочек(секреторные иммуноглобулины). Имму-
ноглобулины класса IgE фиксируются на клетках и имеют большое значение в раз-
витии аллергических реакций (гиперчувствительности). Иммуноглобулины IgD обу-
словливают развитие аутоиммунных процессов и, возможно, препятствуют возник-
новению толерантности.
Т- и В-лимфоциты. В иммунной системе существуют две независимые, но функционирующие совместно клеточные популяции: Т-лимфоциты (тимусзависи-
мые) и В-лимфоциты (не зависимые от тимуса). В-лимфоциты обеспечивают выра-
ботку антител и ответственны, таким образом, за большинство явлений гуморально-
го иммунитета. Клеточный иммунитет обеспечивают Т-лимфоциты, одновременно осуществляющие функцию регуляции как -,Втак и Т-системы. Эта функция Т-
лимфоцитов опосредуется существованием ряда морфологических и функциональ-
ных субпопуляций, основными из которых являются Т-помощники(хелперы), Т-
супрессоры, Т-киллеры и Т-индукторы. Отдельную ветвь представляют макрофаги.
Иммуногенез обеспечивают восемь типов клеток– четыре типа Т-лимфоцитов, три типа В-лимфоцитов и макрофаги. Среди лимфоцитов периферической крови чело-
века от 55 % до 60 % составляют Т-лимфоциты и от 25 % до 30 % – В-лимфоциты;
от 10 % до 20 % лимфоцитов (нулевые клетки), по-видимому, являются предшест-
венниками Т- или В-лимфоцитов.
Антителогенез. Предшественники В-клеток в костном мозге превращаются в В-лимфоциты, которые поступают в периферические лимфоидные органы и явля-
ются предшественниками трех типов плазматических клеток, продуцирующих анти-
тела классов IgM, IgG и IgA. Подача Т-лимфоцитом включающего сигнала контро-
лируется генами иммунного ответа. Молекула антигена распознается также и - Т
сулрессорами, ограничивающими пролиферацию В-клеток на различных стадиях иммунного процесса. Т-супрессоры являются также клетками, обеспечивающими
«запрет» на образование аутоантител к собственным антигенам организма, т.е. им-
мунологическую толерантность. Огромное разнообразие антител обеспечивается
171
существованием в организме млекопитающих не менее1 млн. лимфоидных клеток,
способных дать пролиферацию независимому иммунокомпетентному клону, и обу-
словлено комбинацией вариабельных фрагментов легких и тяжелых цепей имму-
ноглобулинов.
Моноклональные антитела. Моноклональные антитела получают путем гиб-
ридизации лимфоцитов селезенки мышей, иммунизированных определенным анти-
геном, с клетками злокачественной опухоли иммунной системы мышей– миеломы.
Этот метод, предложенный в 1975 г. Милстейном и соавт, основан на способности таких гибридных клеток(гибридомы) к быстрому размножению с образованием клона специфичесих антител. Гибридные клетки можно поддерживать в перевивае-
мой культуре, а клонируя отдельные гибридные клетки, можно получить клоны,
продуцирующие большое количество идентичных антител к одной антигенной -де терминанте. Размноженный в культуре клон вводят мышам интра-яеритонеально и затем пассируют развившиеся опухоли. Асцитическая жидкость таких опухолей со-
держит моноклональные антитела в высоких титрах. Моноклональные антитела по-
зволяют изучать отдельные детерминанты, а применение нескольких клонов позво-
ляет дать исчерпывающую характеристику изучаемой группе вирусов.
Иммуногенез Т-лимфоцитов. Исходным событием иммуногенеза-
лимфоцитов также является взаимодействие антигена с макрофагом. Антиген взаи-
модействует со структурами главного антигена гисто совместимости(HLA) макро-
фага и в таком виде распознается Т-лимфоцитами; В-лимфоцит также распознает антиген и получает дополнительный сигнал включения от стимулированного- Т
лимфоцита. Взаимная активация лимфоцитов происходит благодаря специфическим к неспецифическим гуморальным факторам– лимфокинам и интерлейкинам. В ре-
зультате происходит пролиферация и дифференцировка Т-клеток с образованием клонов эффекторных Т-лимфоцитов, которые распознают измененную клетку и уничтожают ее. Таким образом, основой иммунного процесса служит кооператив-
ное функционирование клеточной «троицы»: Т- и В-лимфоцитов и макрофага.
Иммунологическая память. Иммунологической памятью называют способ-
ность организма давать ускоренные иммунологические реакции на повторное вве172
дение антигена. Иммунологическая память в ряде случаев сохраняется многие годы и свойственна как гуморальному, так и клеточному иммунитету. Клетками памяти является часть дочерних В- и Т-лимфоцитов, стимулированных данным антигеном,
однако более длительную иммунологическую память имеют Т-лимфоциты.
Факторы неспецифической резистентности. Помимо иммунной системы, в
организме существуют факторы неспецифической резистентности. К ним относятся кожные и слизистые покровы, являющиеся механическим препятствием для про-
никновения возбудителей инфекционных болезней и антигенов; лизоцимы, выде-
ляемые слизистыми оболочками и циркулирующие в крови; пропердиновая система;
мукопротеины клеток слизистых оболочек. К факторам неспецифической рези-
стентности относится также система комплемента, состоящая из 12 белков нормаль-
ной сыворотки, которая непосредственно взаимодействует с иммунной системой.
7.1 Формирование противовирусного иммунитета
Развитие вирусной инфекции начинается с проникновения вируса в организм и заражения им клеток. Приникают вирусы в клетку после взаимодействия со спе-
цифическими рецепторами на их поверхности. На сегодня известно, что вирус Эп-
штайн-Барра связывается с С2-рецептором комплемента, вирус бешенства – с аце-
тилхолиновыми рецепторами нейронов, вирус иммунодефицита человека – с CD4-
молекулой, экспрессируемой на Т-клетках. Вирус, проникнув в клетку, использует ее ресурсы для собственной репликации. Вне клеток вирусы не размножаются.
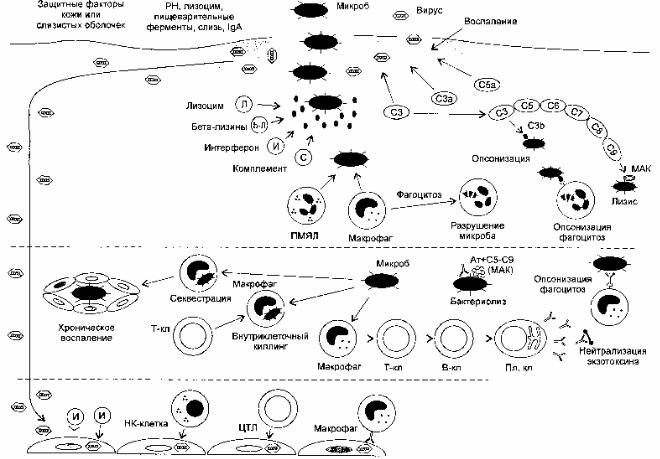
В борьбе с вирусной инфекцией организм использует неспецифические фак-
торы защиты и иммунные механизмы (рисунок 29).
Среди факторов неспецифической защиты основная роль принадлежит
1) интерферону, который способен блокировать репродукцию вирусов в клет-
ке; 2) вируцидной функции НК-клеток и активированным макрофагам. Иногда мак-
рофаги становятся средой для размножения вирусов и способствуют их распростра-
нению по организму.
Интерфероны – это группа белков сыворотки крови, обладающих антивирус173
ной активностью. Существуют 3 типа интерферонов: альфа-интерфероны, продуци-
руемые лейкоцитами крови, представлены 25 подтипами; бета-интерфероны, проду-
цируемые фибробластами, представлены 2 подтипами; гамма-интерферон, продуци-
руемый главным образом Т-лимфоцитами. Заметная активация продукции интерфе-
ронов происходит при вирусной инфекции. Выработанные на одну вирусную ин-
фекцию, интерфероны способны подавлять развитие любой другой вирусной - ин фекции.
Рисунок 29 – Схема механизмов иммунных и неспецифических факторов за-
щиты
ИНФ-α/β, связываясь с соответствующими рецепторами на инфицированных клетках (экспрессия этих молекул усиливается под влиянием инфекции), вызывает в них активацию синтеза 2’-5’-олигоаденилатсинтетазы (2’-5’(А) синтетаза), которая,
174

в свою очередь, переводит эндогенную рибонуклеазу (РНК-азу) из неактивной в ак-
тивную форму, а последняя, в силу своей биологической активности при воздейст-
вии на вирусную (м)РНК вызывает ее деградацию.
Параллельно с этим процессом происходит активирование РНК-зависимой
протеинкиназы, которая подавляет в инфицированных клетках белковый синтез. Та-
ким образом, оба пути блокируют в клетках вирусную репликацию. Кроме того, ин-
терфероны альфа и бета, воздействуя на НК-клетки, повышают их литическую ак-
тивность в отношении вирус-инфицированных клеток.
Это свидетельствует о том, что одним из подходов к усилению противовирус-
ного иммунитета являются средства и препараты, способные усиливать выработку эндогенного интерферона, а также препараты интерферонов, которые способны иг-
рать заместительную роль, выступать в качестве активаторов выработки интерферо-
нов, а также активировать киллерную активность НК-клеток.
Специфическая защита от вирусной инфекции осуществляется механизмами
как гуморального, так и клеточного иммунитета. Антительная защита организма яв-
ляется существенной только при тех вирусных инфекциях, которые распространя-
ются гематогенно или имеют длительный инкубационный период. Этот тип защит-
ных реакций наблюдается при инфекциях, вызванных энтеровирусами (полиомие-
лита, Коксаки, ЕСНО и др.) и риновирусами. Также следует помнить, что антитела способны выступать в качестве основного препятствия распространения вируса по организму в острый период заболевания и при реинфекции. Защитные механизмы гуморального иммунитета суммированы в таблице 4.
Таблица 4 – Гуморальные механизмы противовирусного иммунитета
|
Антитела |
Эффекты |
1. Секреторный IgА |
Блокирование связывания вируса с клеткой хозяина(предо- |
|
|
|
храняют от инфицирования и реинфекции) |
2. |
IgА, IgМ, IgG |
Блокирование проникновения вируса внутрь клетки-хозяина |
3. |
IgМ |
Агглютинация вирусных частиц |
4. |
IgМ, IgG |
Усиление фагоцитоза вирусных частиц (опсонизация вирус- |
|
|
ных частиц). |
|
|
Активация комплемента и лизис вирусных частиц |
175
Как следует из таблицы, антитела способны:
1)блокировать прикрепление вируса к клетке(в случае, если они направлены
кэпитопам рецепторов вирусов);
2)блокировать проникновение вируса внутрь клетки(в случае, если антитела взаимодействуют с эпитопами вируса, обеспечивающими слияние вирусной оболоч-
ки с плазматической мембраной клетки-хозяина);
3)агглютинировать вирусные частицы;
4)выступать в качестве опсонинов, способствуя фагоцитозу вирусных частиц;
5)активировать систему комплемента, компоненты которой способны высту-
пать в качестве опсонинов, а также лизировать вирусные частицы в результате атаки МАК.
Следует помнить, что антитела не способны влиять на развитие и размноже-
ние вирусов внутри клетки. Антитела малоэффективны в защите организма от хро-
нических и медленных инфекций. Это указывает на то, что стимуляция антителооб-
разования при большинстве вирусных инфекций является неоправданной и не при-
водит к существенному повышению противовирусного иммунитета. В известной мере эта процедура оправдана только для предупреждения реинфекции.
Основной формой защиты организма от вирусных инфекций является клеточ-
ный иммунитет. Из клинических наблюдений известно, что больные с дефектами гуморального иммунитета хорошо переносят вирусные инфекции, а лица, имеющие дефекты в Т-звене иммунитета, страдают вирусными заболеваниями, которые и яв-
ляются клиническим проявлением этой формы иммунодефицита.
Основными эффекторами клеточного противовирусного иммунитета являются Т-цитотоксические лимфоциты (CD8+-клетки). Кроме этих клеток, в клеточной за-
щите организма принимают участие НК-клетки и макрофаги. Динамика выработки антивирусных защитных факторов приведена на При большинстве вирусныхин фекций специфические Т-киллеры появляются через3-4 дня после инфицирования,
а пик их количества наблюдается к7-10 дню. Это связано с тем, что процесс транс-
формации наивных Т-киллеров в эффекторные Т-киллеры сопряжен со сложными метаболическими и структурно-функциональными преобразованиями, которые со-
176
провождаются пролиферацией и дифференцировкой клеток.
Установлено, что трансформация наивных Т-киллеров в эффекторные- Т
киллеры происходит под влиянием 2 активационных сигналов. Одного – антигенно-
го, который наивная Т-клетка киллер получает от взаимодействия с инфицирован-
ной клеткой, и второго – в виде ИЛ-2, который она получает от Т-клетки хелпера
(Тн1, CD4+). Под влиянием ИЛ-2 (который является ростовым и дифференцирую-
щим фактором для наивных Т-цитотоксических клеток) происходит количествен-
ный рост клоноспецифических Т-клеток и трансформация их в эффекторные- Т
киллеры. В отсутствие ИЛ-2 не происходит формирование Т-киллеров. Это хорошо продемонстрировано на примере конгенных линий мышей, дефектных по гену, ко-
дирующему ИЛ-2, а также мышей, дефектных по гену, кодирующему рецептор к этому интерлейкину.
Источником ИЛ-2 могут быть как активированные антигеном Т-хелперы (Тн1-
клетки, CD4+), так и сами активированные АГ Т-цитотоксические клетки. В послед-
нем случае образование Т-киллеров будет происходить под контролем аутокринного механизма регуляции иммунных реакций.
Сформированные в результате отмеченных преобразований эффекторные - Т
киллеры способны как лизировать в прямой цитотоксической реакции - вир инфицированные клетки, так и вызывать при этом деградацию вирусной ДНК, та-
ким образом, предотвращая распространение вируса по организму и инфицирование других клеток.
В месте взаимодействия Т-киллера с клеткой-мишенью Т-лимфоциты посред-
ством механизма экзоцитоза продуцируют два рода веществ: перфорины и фрагмен-
тины (грензимы). Перфорины на поверхности клетки-мишени, полимеризуясь, фор-
мируют трансмембранные поры диаметром 5-20 нм, через которые в клетку устрем-
ляется вода, в результате чего клетка гипергидратируется и гибнет. Через образо-
вавшиеся поры в клетку-мишень также поступают фрагментины(протеиназы, грен-
зимы), которые вызывают фрагментацию ДНК-клетки и деградацию вирусной ДНК.
Разрушение клеточной ДНК является вторым механизмом гибели инфицированных клеток. Гибель клеток-мишеней также может быть вызвана через индукцию в них
177
апоптоза. Этот процесс индуцируется в результате взаимодействия лигандFas
(ФНОβ-мембранного) лимфоцита с Fas-рецепторами клетки-мишени. Fas-лиганды на лимфоцитах всегда экспрессируются под влиянием вирусной инфекции. В боль-
шинстве случаев клетки-мишени подвергаются действию комбинации этих меха-
низмов.
Таким же механизмом НК-клетки лизируют клетки-мишени. Литическая ак-
тивность НК-клеток существенно повышается, как было отмечено выше, под влия-
нием ИНФα и ИНФβ, а также ИЛ-12, синтезируемого активированными макрофа-
гами. Повышенная продукция этого интерлейкина наблюдается на самых ранних стадиях инфекционного процесса.
Важную роль в подавлении вирусной инфекции играют Т-хелперы(Тн1, CD4+-клетки). Первое – Т-хелперы участвуют в формировании клонов Т-киллеров.
Второе – активированные Т-хелперы продуцируют такие цитокины, как ИЛ-2, ИНФ-
гамма, ФНОα. ИНФ-гамма, воздействуя на интактные клетки, индуцирует устойчи-
вость их к вирусному заражению, а также повышает вируцидную активность мак-
рофагов. Вместе ИНФ-гамма и ИЛ-2 существенно повышают цитолитическую ак-
тивность НК-клеток. Следует заметить, что с помощью Т-лимфоцитов(специфиче-
ских Т-цитотоксических клеток) может быть перенесен противовирусный иммуни-
тет. Это может использоваться в адоптивной иммунотерапии.
Учитывая закономерности развития клеточного иммунитета и формирования эффекторных Т-киллеров и механизма активирования НК-клеток, можно констати-
ровать, что стимуляция клеточного иммунитета и противовирусной защиты орга-
низма может быть достигнута путем индукции эндогенного ИЛ-2, либо введения препаратов, содержащих ИЛ-2. В настоящее время для повышения активности ци-
толитических клеток применяют комплекс препаратов, содержащих ИЛ-2 и ИНФ-
гамма Развитие вирусной инфекции всегда сопряжено с борьбой микроорганизма с
макроорганизмом, с подавлением его защитных механизмов. Многие вирусы спо-
собны ингибировать как неспецифические, так и специфические факторы защиты организма. Известно, что вирус гепатита С обладает механизмами, блокирующими
178
действие РНК-зависимой протеинкиназы, что позволяет ему избегать действия ИНФα/β.
Другой механизм защиты использует вирус простого герпеса(ВПГ). Он инги-
бирует презентацию собственных антигенов на инфицированных клетках. ВПГ-1 и –
2 на ранних стадиях репликации вирионов синтезирует белокICP-47, который спо-
собен подавлять молекулы-транспортеры ТАР, важные для процессинга антигена.
Подавление ТАР блокирует соединение вирусного пептида (АГ) с молекулами ГКГ I
класса, что нарушает презентацию вирусного антигена Т-цитотоксическим клеткам.
В результате не происходит формирование эффективного клеточного иммунитета.
Аденовирусы в борьбе с защитными силами организма используют молеку-
лярные механизмы подавления экспрессии молекулI класса ГКГ на поверхности инфицированных клеток, вирус кори – механизмы, подавляющие экспрессию моле-
кул 2 класса ГКГ, цитомегаловирус – механизмы, подавляющие экспрессию 1 и 2
класса молекул ГКГ. В первом случае снижается качество презентации вирусных пептидов для ЦТЛ (CD8+-клетки), во втором – для Т-хелперов (Тн1, CD4+-клетки),
что в общем затрудняет формирование полноценного иммунного ответа.
Ряд вирусов способны подавлять систему комплемента. Известно, что активи-
рованный комплемент способен вызывать как прямой лизис вирионов, так и высту-
пать в качестве опсонинов, облегчая их фагоцитоз. Так, вирус коровьей оспы секре-
тирует белки, которые, соединяясь с С4b (в силу тропности), ингибируют классиче-
ский путь активации комплемента. Вирус простого герпеса содержит гликопротеин,
который, соединяясь с С3b, ингибирует классический и альтернативный пути акти-
вации комплемента.
Многие вирусы избегают иммунной атаки в результате высокой антигенной изменчивости. Это свойство особо присуще вирусам гриппа, риновирусам, вирусу иммунодефицита человека.
Часть вирусов способна индуцировать генерализованную иммуносупрессию.
Среди них вирусы эпидемического паротита, кори, Эпштейна-Барр, цитомегалови-
рус, вирус иммунодефицита человека. При этом нарушение иммунных реакций мо-
жет быть следствием как инфицирования иммунокомпетентных клеток и подавле179
ния их функций, так и результатом нарушения механизмов аутокринной и пара-
кринной регуляции. Первый механизм характерен для вируса иммунодефицита че-
ловека, второй – наблюдается при инфекции, вызванной вирусом Эпштейна-Барр
(ВЭБ). Установлено, что ВЭБ продуцирует белокBCRF1, гомологичный ИЛ-10. BCRF1, как и ИЛ-10, подавляет продукцию Т-хелперами/Тн1-клетками ИЛ-2, ФНОα и ИНФ-гамма, которые, как отмечено выше, важны для формирования противови-
русного иммунитета.
Вирусы способны уклоняться от иммунных механизмов путем встраивания своего генома в геном клетки-хозяина, без экспрессии на поверхности инфициро-
ванных клеток своих антигенов. Это делает вирус иммунологически невидимым и позволяет ему персистировать в организме. Вирусы гепатита В, герпес-вирусы мо-
гут находиться в латентном состоянии годы и только при определенных ситуациях активизироваться и вызывать соответствующую симптоматику.
7.2Эпидемиология вирусных инфекций
Вэпидемиологии вирусных инфекций господствует антропоцентрический принцип, и эпидемиология вирусных инфекций или, по крайней мере, большинства из них, не имеет существенных отличий от эпидемиологии бактериальных или про-
тозойных инфекций.
В соответствии с ее положениями, эпидемический (эпизоотический) процесс представляет непрерывную цепь заражений(инфекционных процессов), сопровож-
дающихся выходом возбудителя во внешнюю среду, В этой цепи следует различать источники инфекции, факторы передачи и заражаемые восприимчивые организмы.
Источниками инфекции может быть человек или животное. Соответственно все болезни, вызываемые возбудителями, способными паразитировать только в ор-
ганизме человека, называются «антропонозы». Если же человек заражается от жи-
вотного, такие болезни обозначают как «зоонозы». Примерами антропонозов среди вирусных инфекций являются грипп, корь, оспа, герпес, полиомиелит. Примерами зоонозов являются клещевой энцефалит, лихорадка флеоботомная (москитная лихо-
180
