
BIOCHIMIE5
.docLE COURS 5. LA NATURE CHIMIQUE ET LA CLASSIFICATION DES ENZYMES
Les enzymes - les substances de la nature protéique possédant l'activité catalytique.
La science qui étudie les enzymes – l`enzymologie.
Le seul moyen de l`obtention – l`élimination des objets biologiques.
La nature chimique des enzymes
Les preuves de la nature protéique des enzymes:
1. À l'hydrolyse ils se désagrègent en aminoacides.
2. Sous l`effet du bouillage et d`autres facteurs ils se soumettent à la dénaturation et perdent l'activité catalytique.
3. On a réalisé l`élimination des enzymes en forme des cristaux de la protéine.
4. Les enzymes exercent une action hautementspécifique.
On distingue les enzymes simples comprenant une seule chaîne polypeptidique: la pepsine, la trypsine, l`uréase, la ribonucléase, la phosphatase etc.
La plupart des enzymes naturels - les protéines complexes. Leurs composants non protéiques s'appellent les cofacteurs. Les cofacteurs des enzymes sont les vitamines ou les liaisons, construites avec leur participation (le coenzyme A, NAD +, FAD); les éthers phosphoriques de certains monosaccharides, les ions des métaux. Les cofacteurs jouent le rôle des transporteurs intermédiaires des atomes ou des groupes.
Le coenzyme - le facteur non protéique, se séparant facilement de la partie protéique – de l`apoenzyme - à la dissociation.
Le groupe prostétique – le composant non protéique lié par la liaison covalente à la chaîne protéique; ne se sépare pas à l`élimination et à la purification de l`enzyme.
L`enzyme et le groupe prostétique ensemble forment le choloenzyme. Seulement le groupement de l`apoenzyme et du coenzyme assure l'activité du choloenzyme.
Le substrat – la substance, qui se soumett aux transformations sous l'effet de l`enzyme.
Le site actif - c`est une région spécifique à la surface de l`enzyme, qui se lie à la molécule du substrat et participe directement à la catalyse. Les sites actifs des enzymes se forment au niveau de la structure tertiaire. Les groupes prostétiques des enzymes complexes font partie du site actif.
On distingue deux sections du site actif. Le site de substrat (fonction de liaison) – la section responsable de l'addition du substrat. On l`appelle la plate-forme de contact, ou «d'ancre» de l`enzyme. Le site catalytique qui est responsable de la transformation chimique du substrat. La sérine, la cystéine, l'histidine, la tyrosine, la lysine font partie du site catalytique de la plupart des enzymes. Le site de substrat peut coïncider (ou être bloqué) avec le site catalytique.
Le site allostérique – la section de la molécule de l`enzyme en dehors de son site actif, qui est capable de se lier à une telle ou telle substance (un ligand). Finalement la structure tertiaire, et souvent et la structure quaternaire de la molécule protéique changent. La configuration du site actif et l'activité catalytique de l`enzyme varie. C'est la régulation allostérique de l'activité des enzymes. Les enzymes, dont l'activité du centre catalytique se soumet au changement sous l'influence des effecteurs allostériques, s`appellent les enzymes allostériques.
Certains enzymes sont multifonctionnels: ils possèdent quelques activités enzymatiques, mais une seule chaîne polypeptidique. Leur chaîne protéique forme plusieurs domaines, dont chacun se caractérise par son activité catalytique. Par exemple, l`alcooldéhydrogénase catalyse non seulement la réaction de l'oxydation des alcools, mais aussi les réactions de la neutralisation de la série des xénobiotiques.
Les isoenzymes catalysent une seule réaction, mais ils se distinguent l'un de l'autre par les propriétés physiques et chimiques: l'affinité au substrat, l'activité, la mobilité électrophorétique.
Par exemple, la lactate-déhydrogénase (LDG) catalyse la transformation réversible de l`acide pyruvique à l`acide lactique. Elle comprend 4 sous-unités et contient deux types des chaînes polypeptidiques: Н - le type cordial (de l`anglais Heart - le coeur) et М - le type musculaire (de l`anglais Muscle - le muscle). Cet enzyme grâce aux combinaisons variées des sous-unités existe sous 5 formes. Pour chaque tissu dans la norme son rapport des formes est typique (le spectre isoenzymatique) de LDG. Par exemple, dans le myocarde prédomine Н4 (LDG1), dans les muscles de squelette et le foie – М4 (LDG5). L'examen de l'apparition des isoenzymes LDG dans le sérum du sang permet de juger de la place du procès pathologique et du degré de la lesion de l'organe ou du tissu.
Les complexes multimoléculaires enzymatiques maintiennent le procès unitaire à plusieurs degrés des transformations biochimiques, on les appelle les métabolonnes (la chaîne respiratoire des mitochondries).
La classification et la nomenclature des enzymes
La classification et la nomenclature modernes des enzymes sont élaborées par la Commission des enzymes de l'Union Internationale biochimique et sont affirmées au V Congrès International biochimique en 1961 à Moscou.
À la base de la classification se trouvent 3 principes:
1. La nature chimique de l`enzyme.
2. La nature chimique du substrat.
3. Le type de la reaction catalysée.
D`après la classification moderne, les enzymes sont divisés en six classes.
1. Les oxydoréductases – elles catalysent les réactions d'oxydoréduction:
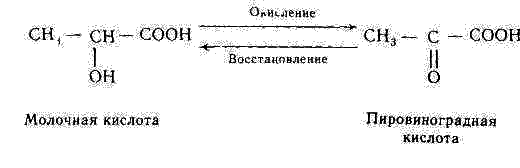
- Les déshydrogénases aérobies (les oxydases) catalysent le transfert des protons (des électrons) à l'oxygène;
- Les déshydrogénases anaérobies accélèrent le transfert des protons (des électrons) au substrat intermédiaire, et non à l'oxygène.
Les oxydoréductases, qui contiennent le nicotinamideadéninedinucléotide (NAD +) comme le groupe actif sont bien répandues. Excepté NAD + les pyridinenzymes contiennent le nicotinamideadéninedinucléotidephosphate (NADP +) comme le coenzyme. Les coenzymes des oxydoréductases sont les flavoprotéines – le flavine-mononucléotide (FMN) et le flavine- adéninedinucléotide (FAD).
2. Les transférases catalysent les réactions du transfert intermoléculaire des divers atomes, des groupes des atomes et des radicaux.
Les phosphotransférases accélèrent le transfert du reste de l'acide phosphorique. Les éthers phosphoriques des combinaisons organiques possèdent l'activité chimique élevée. Le donneur des restes phosphatés est dans la plupart des cas l`ATP.
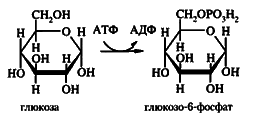
Les transaminases (les amino-transférases) accélèrent la réaction du transfert de l'aminogène de l'aminoacide à l`-cétoacide.

Les protéine-kinases accélèrent le transfert du reste du phosphate de l` АТP aux protéines, en changeant leur activité biologique.
Les glycosyltransférases accélèrent les réactions du transfert гликозильных des restes glycosidiques.
Les acyltransférases catalysent le transfert des acyles (les restes des acides carboxyliques).
3. Les hydrolases décomposent les liens intramoléculaires des matières organiques avec la participation de la molécule de l'eau. On les nomme selon la forme «le substrat-hydrolase».
Les estérases catalysent l'hydrolyse des éthers complexes des alcools avec les acides organiques et inorganiques. Par exemple, la lipase accélère l'hydrolyse des triacylglycérines (des graisses):
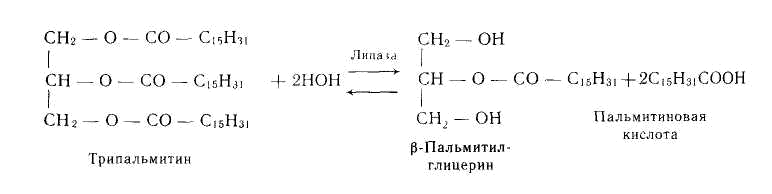
Les phosphatases catalysent l'hydrolyse des éthers phosphoriques:
Glucose-6-phosphate + Н2О ® le glucose + Н3РО4
Les glycosidases catalysent l'hydrolyse des glycosides. Parmis les glycosidases, qui agissent les polysaccharides, on connaît les amylases.
Les peptidehydrolases accélèrent l'hydrolyse des liens peptidiques des protéines et des peptides. On distinguent des protéinases, qui sont des endopéptidases, rompant les liens peptidiques au milieu de la molécule de la protéine, et les peptidases, qui sont des exopeptidases (rompent les lienspeptidiques formés par les aminoacides terminaux).
4. Les lyases catalysent la rupture des liens С—О, С—С, С—N, ainsi que les reactions réversibles de l`élimination de divers groupes des substrats par la voie non hydrolytique. Ces réactions sont accompagnées par la formation de la liaison double et le dégagement des produits les plus simples (СО2, H2O, NH3).
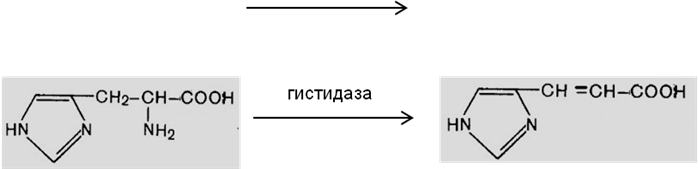
Les carbone-carbone-lyases – les décarboxylases; С—N-lyase (l`histidase) :

Certains lyases accélèrent les réactions d'addition de l'eau, de l'ammoniaque et par la liaison double. Pour distinguer ces lyases des enzymes de la classe des ligases (qui accélèrent seulement les réactions de la synthèse et s'appellent les synthétases), on les appelle les synthases.
5. Les isomérases catalisent les interconversions des isomères structuraux, optiques et géométriques. La mutarotase accélère la réaction de la transformation α-D – glucopyranose en β-D - glucopyranose:
6. Les ligases (les synthétases) catalisent la synthèse des matières organiques de deux molécules initiales avec l'utilisation de l'énergie de la désagrégation de l`ATP ou d'autres substances.
L`une des carboxylases les plus importantes c`est la pyruvatecarboxylase:
СН3-СО-СООН
+ СО2
Н![]() ООС-СН2-СО-ООН
ООС-СН2-СО-ООН
l`acide pyruvique l`acide oxalo-acétique
