
- •Федеральное агентство по образованию
- •СОдержАние
- •I. Теоретическая часть предмет биохимии
- •1. Химия белков
- •1.1. Методы выделения и очистки белков
- •1.2. Функции белков
- •1.3. Аминокислотный состав белков
- •1.4. Структурная организация белков
- •1.5. Физико-химические свойства белков
- •1.6. Классификация белков
- •1.6.1. Простые белки
- •1. Альбумины и глобулины.
- •2. Протамины и гистоны.
- •3. Проламины и глютелины.
- •1.6.2. Сложные белки
- •Структура нуклеиновых кислот
- •Контрольные вопросы
- •2. Ферменты
- •2.1. Химическая природа ферментов
- •2.2. Механизм действия ферментов
- •2.3. Кинетика ферментативных реакций
- •2.4. Свойства ферментов
- •2.5. Регуляция активности ферментов
- •1. Контроль количества фермента.
- •2. Контроль активности фермента.
- •2.2. Химическая модификация фермента
- •2.3. Аллостерическая регуляция
- •2.6. Классификация и номенклатура ферментов
- •2.7. Ферменты в медицине
- •2. Приобретенные энзимопатии.
- •Контрольные вопросы
- •3. Витамины
- •3.1. Жирорастворимые витамины
- •3.2. Водорастворимые витамины
- •Контрольные вопросы
- •4. Основные принципы организации биомембран
- •4.1. Строение и функции мембран
- •1. Фосфолипиды (до 90%) – глицерофосфолипиды и сфингофосфолипиды: фосфатидилхолин
- •Церамид
- •Галактозилцерамид
- •4.2. Транспорт веществ через мембрану
- •2. Облегченная диффузия
- •Контрольные вопросы
- •5. Механизмы передачи гормонального сигнала
- •Трансмембранная передача гормонального сигнала
- •Контрольные вопросы
- •6. Введение в метаболизм
- •6.1. Общая схема катаболизма
- •6.2. Биоэнергетика
- •6.3. Организация и функционирование дыхательной цепи
- •6.4. Разобщение окисления и фосфорилирования
- •6.5. Генерация свободных радикалов в клетке
- •6.6. Реакции общего пути катаболизма
- •6.6.1. Окислительное декарбоксилирование пвк
- •6.6.2. Цикл трикарбоновых кислот
- •Регуляция общего пути катаболизма
- •Контрольные вопросы
- •7. Обмен углеводов
- •7.1. Переваривание углеводов
- •7.2. Обмен гликогена
- •7.3. Гликолиз
- •7.4. Включение фруктозы и галактозы в гликолиз
- •7.5. Челночные механизмы
- •7.6. Цикл кори
- •7.7. Спиртовое брожение
- •7.8. Пентозофосфатный путь превращения глюкозы
- •7.9. Глюконеогенез
- •7.10. Регуляция обмена углеводов
- •Глюкоза → глюкозо-6-фосфат.
- •Пируват → оксалоацетат → фосфоенолпируват
- •7.11. Нарушения углеводного обмена Нарушение гидролиза и всасывания углеводов.
- •Гликогенозы
- •Нарушения промежуточного обмена углеводов
- •Гипер- и гипогликемия
- •Глюкозурия
- •Контрольные вопросы
- •II. Лабораторный практикум Работа 1. Анализ аминокислот и белков
- •1. Качественный анализ аминокислотных смесей методом бумажной хроматографии.
- •2. Цветные реакции на белки.
- •3. Реакции осаждения белков.
- •3. 1. Осаждение белков при нагревании.
- •3.2. Осаждение белков солями тяжелых металлов.
- •3.3. Осаждение белков концентрированными минеральными кислотами.
- •3.5. Осаждение белков органическими кислотами.
- •Контрольные вопросы
- •Работа 2. Сложные белки – фосфопротеины и гликопротеины
- •2. Гликопротеины.
- •1.2. Реакция с дифениламином.
- •2.Хромопротеины.
- •2.1. Бензидиновая проба на геминовую группировку гемоглобина.
- •Контрольные вопросы
- •4. Специфичность действия ферментов амилазы и сахаразы.
- •Контрольные вопросы
- •Работа 5. Определение активности ферментов
- •1. Действие активаторов и ингибиторов на α-амилазу слюны.
- •2. Определение активности α-амилазы слюны по Вольгемуту.
- •Контрольные вопросы
- •Работа 6. Витамины
- •9.1. Взаимодействие витамина с с к3[Fe(cn)6].
- •9.2. Реакция с метиленовой синью.
- •Контрольные вопросы
- •Работа 7. Оксидоредуктазы
- •1. Обнаружение дегидрогеназы (ксантиноксидаза, альдегиддегидрогеназа, кф 1.1.3.22) в молоке (реакция Шардингера).
- •2. Сопоставление редокс-потенциалов рибовлавина и метиленового синего.
- •3. Определение каталазы по а.Н. Баху и а.И. Опарину.
- •Контрольные вопросы
- •Работа 8. Обмен углеводов
- •3.1. Реакция Троммера с гидроксидом меди.
- •3.2. Выявление фруктозурии пробой Селиванова.
- •3.3. Энзиматический метод полуколичественного определения глюкозы в моче с помощью тест-полоски "glucophan".
- •Контрольные вопросы
- •Литература
Контрольные вопросы
1. Дайте характеристику аминокислотам как структурным мономерам белков. В чем состоят особенности образования пептидной связи?
2. Дайте определение первичной структуры белка. В чем состоит определяющая роль первичной структуры в формировании более высоких уровней организации белковой молекулы?
3. Какие связи стабилизируют вторичную структуру белка? Укажите виды вторичной структуры белка.
4. Что понимают под третичной структурой белка? Какие связи ее стабилизируют?
5. Охарактеризуйте четвертичную структуру белка. Что такое мономеры и олигомеры?
6. В чем состоит взаимосвязь структуры и функции белков?
7. Перечислите основные функции белков в организме.
8. Какие методы позволяют определить молекулярную массу белка?
9. Зависит ли растворимость белков от их аминокислотного состава?
10. Что понимают под денатурацией и ренатурацией белков? Какие агенты вызывают денатурацию?
11. Что такое изоэлектрическая точка белка?
12. Как используется процесс высаливания белков в медицине?
13. Перечислите функции альбуминов и глобулинов плазмы крови.
14. Приведите примеры фибриллярных белков.
15. Приведите классификацию сложных белков.
16. Рассмотрите структуру и функции гемоглобина А.
2. Ферменты
Ферменты, или энзимы - вещества белковой природы, обладающие каталитической активностью. Термин «энзим» - от греч. en zyme- в дрожжах, «фермент» - от лат. fermentatio - брожение.
Учение о ферментах выделено в самостоятельную науку энзимологию.
Хотя уже осуществлен лабораторный синтез ряда ферментов — рибонуклеазы, лизоцима, единственный способ получения ферментов — это выделение их из биологических объектов.
2.1. Химическая природа ферментов
Доказательства белковой природы ферментов:
1. Ферменты при гидролизе распадаются на аминокислоты.
2. Под действием кипячения и др. факторов ферменты подвергаются денатурации и теряют каталитическую активность.
3. Осуществлено выделение ферментов в форме кристаллов белка.
4. Ферменты оказывают высокоспецифическое действие.
Прямым доказательством белковой природы ферментов является лабораторный синтез первого фермента – рибонуклеазы.
Выделяют простые ферменты, состоящие только из полипептидной цепи: пепсин, трипсин, уреаза, рибонуклеаза, фосфатаза и др.
Большинство природных ферментов - сложные белки. Их небелковые компоненты называются кофакторами и необходимы для выполнения ферментом его каталитической роли. Кофакторами ферментов являются витамины или соединения, построенные с их участием (коэнзим А, НАД+, ФАД); фосфорные эфиры некоторых моносахаридов, ионы металов.
Кофермент - небелковый фактор, который легко отделяется от белковой части - апофермента при диссоциации.
Простетическая группа – ковалентно связанный с белковой цепью небелковый компонент, который не отделяется при выделении и очистке фермента.
Весь фермент вместе с простетической группой назыывают холоферментом. Только объединение апофермента и кофермента обеспечивает активность холофермента.
Субстрат – вещество, подвергающееся превращениям под действием фермента.
Активный центр - специфический участок на поверхности фермента, связывающийся с молекулой субстрата и непосредственно участвующий в катализе. Активные центры ферментов образуются на уровне третичной структуры. У сложных ферментов в состав активного центра входят также простетические группы. Кофакторы ферментов выполняют роль промежуточных переносчиков атомов или групп.
В активном центре различают два участка. Субстратный (связывающий) центр - участок, отвечающий за присоединение субстрата. Его называют контактной, или «якорной» площадкой фермента. Каталитический центр отвечает за химическое превращение субстрата. В состав каталитического центра большинства ферментов входят такие аминокислоты, как серин, цистеин, гистидин, тирозин, лизин. Субстратный центр может совпадать (или перекрываться) с каталитическим центром.
Аллостерический центр - участок молекулы фермента вне его активного центра, который способен связываться с тем или иным веществом (лигандом). В результате изменяется третичная, а часто и четвертичная структура белковой молекулы. Как следствие изменяется конфигурация активного центра и каталитическая активность фермента. Это т. н. аллостерическая регуляция активности ферментов. Ферменты, активность каталитического центра которых подвергается изменению под влиянием аллостерических эффекторов, называют аллостерическими.
Некоторые из ферментов являются полифункциональными, т. е. обладают несколькими энзиматическими активностями, но всего лишь одной полипептидной цепью. Их белковая цепь образует несколько доменов, каждый из которых характеризуется своей каталитической активностью. Например, алкогольдегидрогеназа не только катализирует реакцию окисления спиртов, но также реакции обезвреживания ряда ксенобиотиков.
Изоферменты - это множественные формы фермента, катализирующие одну и ту же реакцию, но отличающиеся друг от друга по физическим и химическим свойствам - сродству к субстрату, активности, электрофоретической подвижности.
Например, фермент лактатдегидрогеназа катализирует обратимое превращение пировиноградной кислоты в молочную. Она состоит из 4 субъединиц и содержит два типа полипептидных цепей: Н- сердечный тип (от англ. heart- сердце) и М - мышечный тип (от англ. muscle- мышца). Этот фермент благодаря различным сочетаниям субъединиц может существовать в 5 формах:
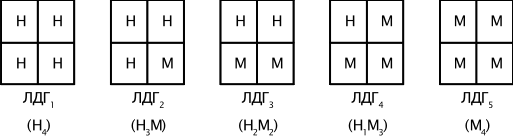
Для каждой ткани в норме характерно свое соотношение форм (изоферментный спектр) ЛДГ. Например, в сердечной мышце преобладает Н4, т.е. ЛДГ1, а в скелетных мышцах и печени – М4 (ЛДГ5). Изучение появления изоферментов ЛДГ в сыворотке крови позволяет судить о месте патологического процесса и о степени поражения органа или ткани.
Особую группу ферментов составляют мультимолекулярные ферментные комплексы. Существование таких комплексов ускоряет химические превращения. Если мультиэнзимный комплекс обслуживает единый, многоступенчатый процесс биохимических превращений, его называют метаболоном. Таковы метаболоны гликолиза, цикла Кребса, дыхательная цепь митохондрий и др.
