- •Федеральное агентство по образованию
- •СОдержАние
- •I. Теоретическая часть предмет биохимии
- •1. Химия белков
- •1.1. Методы выделения и очистки белков
- •1.2. Функции белков
- •1.3. Аминокислотный состав белков
- •1.4. Структурная организация белков
- •1.5. Физико-химические свойства белков
- •1.6. Классификация белков
- •1.6.1. Простые белки
- •1. Альбумины и глобулины.
- •2. Протамины и гистоны.
- •3. Проламины и глютелины.
- •1.6.2. Сложные белки
- •Структура нуклеиновых кислот
- •Контрольные вопросы
- •2. Ферменты
- •2.1. Химическая природа ферментов
- •2.2. Механизм действия ферментов
- •2.3. Кинетика ферментативных реакций
- •2.4. Свойства ферментов
- •2.5. Регуляция активности ферментов
- •1. Контроль количества фермента.
- •2. Контроль активности фермента.
- •2.2. Химическая модификация фермента
- •2.3. Аллостерическая регуляция
- •2.6. Классификация и номенклатура ферментов
- •2.7. Ферменты в медицине
- •2. Приобретенные энзимопатии.
- •Контрольные вопросы
- •3. Витамины
- •3.1. Жирорастворимые витамины
- •3.2. Водорастворимые витамины
- •Контрольные вопросы
- •4. Основные принципы организации биомембран
- •4.1. Строение и функции мембран
- •1. Фосфолипиды (до 90%) – глицерофосфолипиды и сфингофосфолипиды: фосфатидилхолин
- •Церамид
- •Галактозилцерамид
- •4.2. Транспорт веществ через мембрану
- •2. Облегченная диффузия
- •Контрольные вопросы
- •5. Механизмы передачи гормонального сигнала
- •Трансмембранная передача гормонального сигнала
- •Контрольные вопросы
- •6. Введение в метаболизм
- •6.1. Общая схема катаболизма
- •6.2. Биоэнергетика
- •6.3. Организация и функционирование дыхательной цепи
- •6.4. Разобщение окисления и фосфорилирования
- •6.5. Генерация свободных радикалов в клетке
- •6.6. Реакции общего пути катаболизма
- •6.6.1. Окислительное декарбоксилирование пвк
- •6.6.2. Цикл трикарбоновых кислот
- •Регуляция общего пути катаболизма
- •Контрольные вопросы
- •7. Обмен углеводов
- •7.1. Переваривание углеводов
- •7.2. Обмен гликогена
- •7.3. Гликолиз
- •7.4. Включение фруктозы и галактозы в гликолиз
- •7.5. Челночные механизмы
- •7.6. Цикл кори
- •7.7. Спиртовое брожение
- •7.8. Пентозофосфатный путь превращения глюкозы
- •7.9. Глюконеогенез
- •7.10. Регуляция обмена углеводов
- •Глюкоза → глюкозо-6-фосфат.
- •Пируват → оксалоацетат → фосфоенолпируват
- •7.11. Нарушения углеводного обмена Нарушение гидролиза и всасывания углеводов.
- •Гликогенозы
- •Нарушения промежуточного обмена углеводов
- •Гипер- и гипогликемия
- •Глюкозурия
- •Контрольные вопросы
- •II. Лабораторный практикум Работа 1. Анализ аминокислот и белков
- •1. Качественный анализ аминокислотных смесей методом бумажной хроматографии.
- •2. Цветные реакции на белки.
- •3. Реакции осаждения белков.
- •3. 1. Осаждение белков при нагревании.
- •3.2. Осаждение белков солями тяжелых металлов.
- •3.3. Осаждение белков концентрированными минеральными кислотами.
- •3.5. Осаждение белков органическими кислотами.
- •Контрольные вопросы
- •Работа 2. Сложные белки – фосфопротеины и гликопротеины
- •2. Гликопротеины.
- •1.2. Реакция с дифениламином.
- •2.Хромопротеины.
- •2.1. Бензидиновая проба на геминовую группировку гемоглобина.
- •Контрольные вопросы
- •4. Специфичность действия ферментов амилазы и сахаразы.
- •Контрольные вопросы
- •Работа 5. Определение активности ферментов
- •1. Действие активаторов и ингибиторов на α-амилазу слюны.
- •2. Определение активности α-амилазы слюны по Вольгемуту.
- •Контрольные вопросы
- •Работа 6. Витамины
- •9.1. Взаимодействие витамина с с к3[Fe(cn)6].
- •9.2. Реакция с метиленовой синью.
- •Контрольные вопросы
- •Работа 7. Оксидоредуктазы
- •1. Обнаружение дегидрогеназы (ксантиноксидаза, альдегиддегидрогеназа, кф 1.1.3.22) в молоке (реакция Шардингера).
- •2. Сопоставление редокс-потенциалов рибовлавина и метиленового синего.
- •3. Определение каталазы по а.Н. Баху и а.И. Опарину.
- •Контрольные вопросы
- •Работа 8. Обмен углеводов
- •3.1. Реакция Троммера с гидроксидом меди.
- •3.2. Выявление фруктозурии пробой Селиванова.
- •3.3. Энзиматический метод полуколичественного определения глюкозы в моче с помощью тест-полоски "glucophan".
- •Контрольные вопросы
- •Литература
2.4. Свойства ферментов
Ферменты отличаются от обычных катализаторов рядом свойств.
Термолабильность, или чувствительность к повышению температуры (рис. 13).
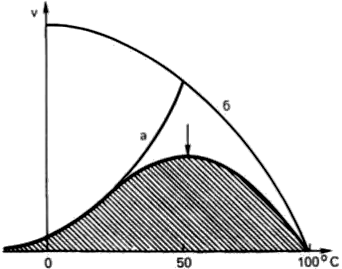
Рис. 13. Зависимость скорости ферментативной реакции от температуры.
При температуре, не превышающей 45–50°С, скорость большинства биохимических реакций повышается в 2 раза при повышении температуры на 10°С (правило Вант-Гоффа). При температуре выше 50°С на скорость реакции большое влияние начинает оказывать тепловая денатурация белка-фермента, приводящая к полному прекращению ферментативного процесса.
Температура, при которой каталитическая активность фермента максимальна, называется его температурным оптимумом. Температурный оптимум для большинства ферментов млекопитающих лежит в пределах 37—40°С. При низких температурах (0°С и ниже) ферменты, как правило, не разрушаются, хотя активность их падает почти до нуля.
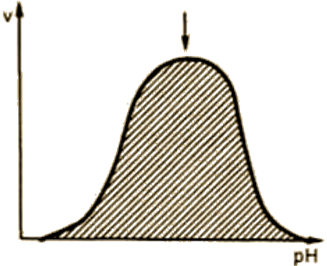
Зависимость активности фермента от значения рН среды (рис. 14).
Для каждого фермента существует оптимальное значение рН среды, при котором он проявляет максимальную активность. рН-оптимум действия ферментов лежит в пределах узкой зоны концентрации водородных ионов, соответствующей для животных тканей выработанным в процессе эволюции физиологическим значениям рН среды 6,0-8,0. Исключения составляют пепсин – 1,5-2,5; аргиназа – 9,5-10.
Согласно современным представлениям, влияние изменений рН среды на молекулу фермента заключается в воздействии на третичную структуру белка.
|
|
|
Рис. 14. Зависимость скорости ферментативной реакции от рН среды.
|
Специфичность. Высокая специфичность действия ферментов обусловлена конформационной и электростатической комплементарностью между молекулами субстрата и фермента и уникальной структурной организацией активного центра, обеспечивающими избирательность протекания реакции.
Абсолютная специфичность – способность фермента катализировать единственную реакцию. Например, уреаза катализирует реакцию гидролиза мочевины до NH3 и СО2.
Относительная (групповая) специфичность – способность фермента катализировать группу реакций определенного типа. Относительной специфичностью, например, обладают гидролитические ферменты пептидазы, гидролизующие пептидные связи в молекулах белков и пептидов.
Стереохимической специфичностью обладают ферменты, катализирующие превращения только одного из пространственных изомеров. Фермент фумараза катализирует превращение в малат только транс-изомера фумарата и не действует на цис-изомер малеиновую кислоту.
Высокая специфичность действия ферментов обеспечивает протекание лишь определенных химических реакций из всех возможных превращений.
2.5. Регуляция активности ферментов
Активность фермента определяют по скорости реакции, катализируемой ферментом, при стандартных условиях измерения (оптимальных условиях температуры, рН среды и полном насыщении фермента субстратом). О скорости ферментативной реакции судят или по скорости убыли субстрата, или по скорости образования продукта реакции.
Одна стандартная единица активности фермента (Е или U) — такое количество фермента, которое катализирует превращение 1 мкмоль вещества за 1мин.
В связи с введением Международной системы единиц (СИ) предложено выражение активности фермента в каталах (кат, kat): 1 кат есть каталитическая активность, способная осуществлять реакцию со скоростью, равной 1 моль/с. 1 U(Е) фермента соответствует 16,67 нкат.
Существует два основных способа контроля скорости ферментативных реакций.