- •Органическая, биологическая и физколлоидная химия
- •Часть I. Строение органических соединений
- •Оглавление
- •Предисловие
- •Лекция 1. Предмет и задачи биоорганической химии
- •Биополимеры и их структурные компоненты
- •Сравнительная характеристика органических и неорганических соединений и реакций с их участием
- •1861 Г. А.М. Бутлеров
- •Лекция 2. Изомерия органических соединений
- •Лекция 3. Химическая связь в органических соединениях
- •Валентные состояния атома углерода
- •Лекция 4. Концепция электронных смещений
- •Лекция 5. Методы исследования органических соединений
- •Основные понятия и термины
- •Библиографический список
Сравнительная характеристика органических и неорганических соединений и реакций с их участием
|
Неорганические соединения |
Органические соединения |
|
Высокополярны. Часто солеобразны. Хорошо растворимы в воде. Их растворы и расплавы электропроводны. Имеют высокие Тпл, Ткип. В реакции вступают легко, реагируют очень быстро. Для успешного осуществления реакций не требуются особые условия (температура, катализатор и др.). Выходы в реакциях высокие. |
Малополярны. Не растворимы в воде. Неэлектролиты. Имеют низкие Тпл, Ткип. В реакции вступают плохо, реагируют очень медленно. Для успешного осуществления реакций требуются особые условия (температура, катализатор, облучение и др.) – дополнительная энергия для разрыва и образования ковалентных связей. Выходы в реакциях низкие. Часто образуется смесь изомеров, т.к. одновременно протекают несколько конкурирующих реакций по разным реакционным центрам субстрата. |
|
Основная причина отличий в свойствах – природа связи в молекулах | |
|
Ионная |
Ковалентная |
Теория строения органических соединений.
1861 Г. А.М. Бутлеров
«Химическая натура сложной частицы определяется натурой элементарных составных частей, количеством их и химическим строением».
Положения теории:
1. Атомы в молекулах соединяются друг с другом в определённой последовательности, согласно их валентности. Эта последовательность атомов называется химическим строением.
Структурная формула – изображение химических связей в молекуле с учетом их валентности.
2. Свойства органических веществ зависят не только от их качественного и количественного состава, но и от того, в каком порядке соединены атомы в молекулах, т.е. от химического строения.
3. Атомы в молекулах взаимно влияют друг на друга.
4. Свойства органических веществ определяются их строением, и, наоборот, зная свойства, можно прогнозировать строение веществ.
Физические и химические свойства органических соединений определяются составом их молекул, а также химическим, пространственным и электронным строением.
Лекция 2. Изомерия органических соединений
|
1. Понятие и виды изомерии; 2. Структурная изомерия; 3. Таутомерия; 4. Геометрическая изомерия; |
5. Оптическая изомерия; 6. Конформационная изомерия; 7. Конфигурационная изомерия. |
Изомерия – явление существования веществ с одинаковым качественным и количественным составом, но различными свойствами
(1830 г. Берцелиус).
Причина изомерии стала понятной лишь после появления теории химического строения А.М. Бутлерова (1861 г.) – различное строение молекул, обусловленное способностью атома углерода к образованию 4-х ковалентных связей, в том числе и с др. атомами углерода.
|
Виды изомерии | |
|
Структурная - обусловлена разным порядком соединения атомов в молекуле.
|
Пространственная (стереоизомерия) - обусловлена различным расположением заместителей относительно друг друга в пространстве. |
|
1. С-скелета; |
1. Геометрическая; |
|
2. Положения: |
2. Оптическая; |
|
а) кратных связей; |
3. Конформационная; |
|
б) заместителей; |
4. Конфигурационная. |
|
в) функциональных групп; | |
|
3. Межклассовая; | |
|
4. Таутомерия. | |
Структурная изомерия
Количество изомеров С-скелета очень быстро возрастает с увеличением числа С-атомов:
|
Гексан (6) Гептан (7) Октан (8) Нонан (9) Декан (10) Эйкосан (20) |
5 изомеров 9 изомеров 18 изомеров 35 изомеров 75 возможных изомеров 366315 возможных изомеров |
|
В случае циклоалканов изомерия скелета может быть обусловлена различным числом атомов углерода в кольце: |
|
Изомерия положения
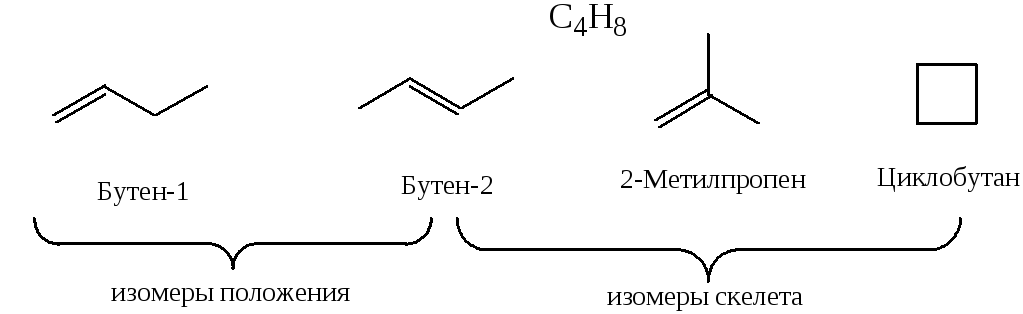
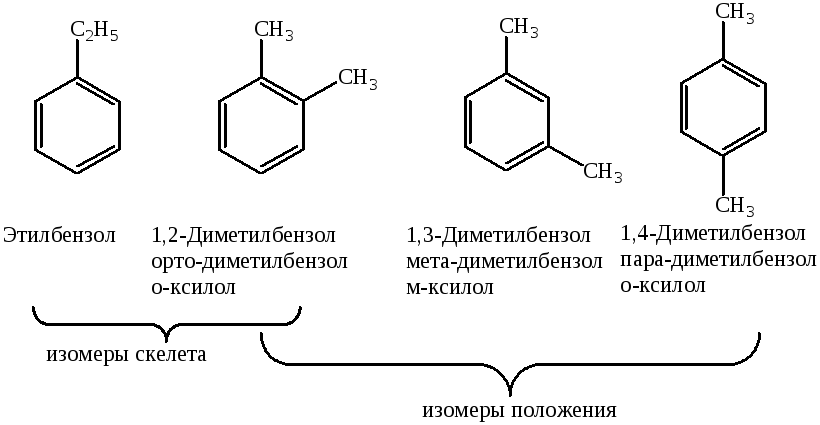
У органических соединений, содержащих гетероатомы, изомерия положения обусловлена расположением гетероатома как в цепи, так и в кольце:
Свойства структурных изомеров
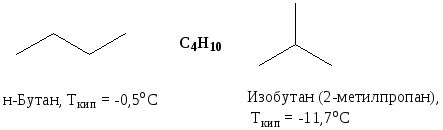
Структурные изомеры существенно различаются между собой физическими, химическими и физиологическими свойствами.
- Ткип у разветвленных алканов ниже, чем у неразветвленных.
- Т пл выше у тех изомеров, которые имеют более симметричную структуру.
|
Разные физиологические свойства |
Разные химические свойства |
|
|
|
Таутомерия
«таутос» - тот же самый, «мерос» - доля, часть (греч.).
Таутомерия – явление динамического обратимого превращения изомеров, протекающее с разрывом и образованием связей и сопровождающееся перемещением атомов (чаще всего протона) и реже групп атомов.
Изомерные формы – таутомеры.
В отличие от структурных изомеров, таутомеры, как правило, не могут существовать отдельно друг от друга. Независимое их получение невозможно.
Основным признаком таутомерных веществ является их двойственное реагирование – способность к образованию двух рядов производных как результат раздельного и самостоятельного реагирования двух находящихся в равновесии изомерных форм одного соединения.
Виды таутомерии
|
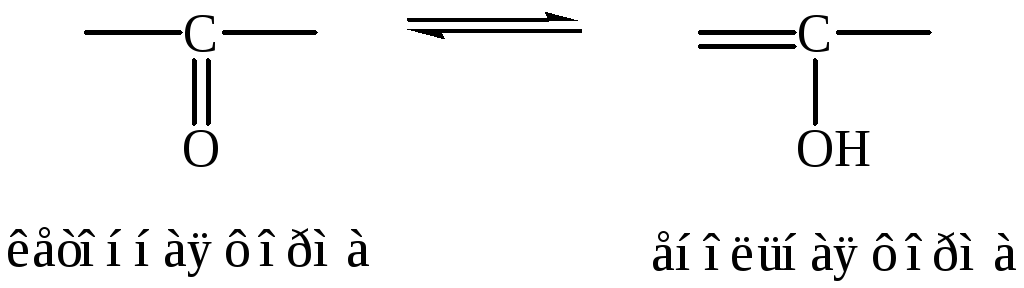
1. Кето-енольная таутомерия: |
|

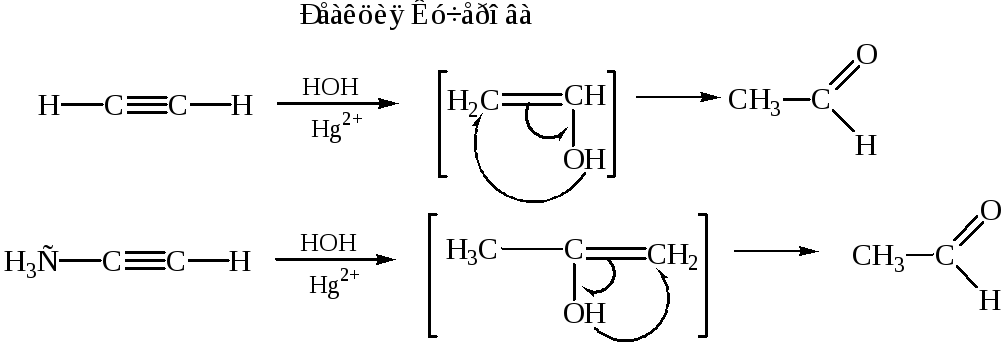


|
2. Амид-имидольная таутомерия: |
|
|
|
|
|
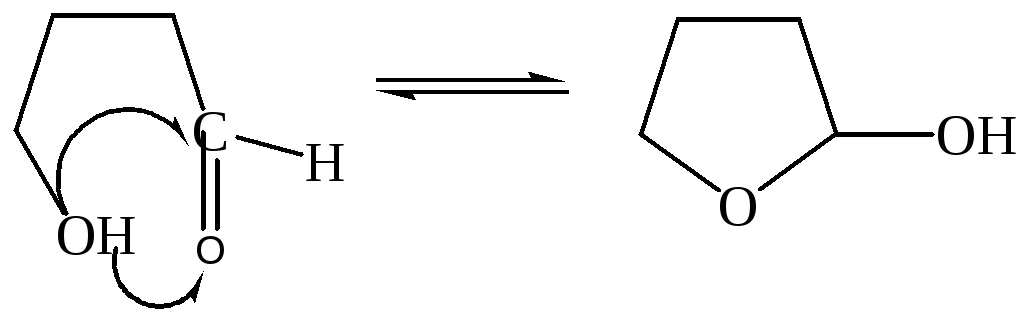
3. Кольчато-цепная таутомерия – равновесие линейной и кольчатой (полуацетальной форм) |
|

Геометрическая изомерия
- разновидность стереоизомерии, которая определяется различием пространственного расположения в молекулах пары заместителей относительно плоскости двойной связи или цикла.
Обусловлена тем, что в молекулах этих веществ свободное вращение атомов вокруг σ-связей (циклоалканы) и относительно π-связей (алкены) оказывается невозможным.
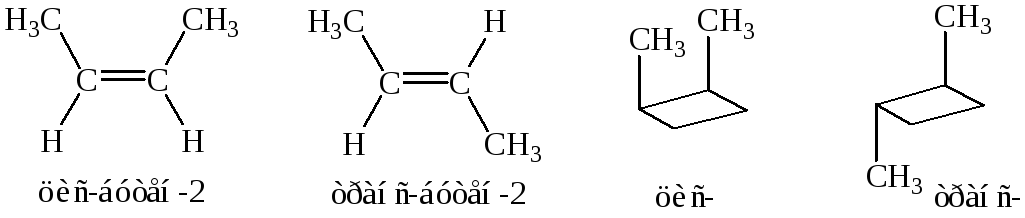
Z, E-номенклатура (для три- и тетразамещенных алкенов).
Конфигурацию изомера определяют по относительному расположению старших заместителей. По одну сторону плоскости – Z-изомер; по разные – Е-изомер.
В основе определения старшинства находится атомный номер элемента. В случае одинаковых атомов старшинство группы определяет «вторая оболочка» атомов:
-СН3 < -СН2СН3 < -СН(СН3)2 < -СН2NН2 < -CH2OH < -CH2F
В случаях групп с различным типом связи старшинство увеличивается в рядах:
-CH2OH < -COH < COR < COOH
-CH2NH2 < -CH=NH < -CN

Вследствие того, что расстояния между заместителями в молекулах изомеров различны, последние существенно различаются своими химическими и физическими свойствами. Они могут быть разделены и существовать индивидуально.

Переход одного изомера в другой – изомеризация протекает обычно при нагревании или облучении.
Цис-транс- фотоизомеризация лежит в основе фоторецепции:
![]()
Конформационная изомерия
- разновидность стереоизомерии, которая определяется различием пространственного расположения в молекулах заместителей, возникающее в результате свободного вращения вокруг σ-связей.
Такие изомеры различаются между собой стабильностью. Более стабильные конформации, которые фиксируются физико-химическими методами, называются конформерами.
|
Конформер – это молекула в конформации, в которую её атомы самопроизвольно возвращаются после небольших сдвигов. |
|
Изображение конформеров – проекции Ньюмена:

Чем больше сила взаимного отталкивания атомов водорода, тем выше энергия системы; поэтому заторможенной конформации будет соответствовать минимум потенциальной энергии молекулы.
Принимая различные конформации, молекулы остаются химически однородными; конформации не являются типичными изомерами. Однако, в некоторых случаях (при тесной упаковке молекул), можно разделить различные формы.
Конформации биоорганических молекул (ферменты, витамины, белки, нуклеиновые кислоты) играют определяющую роль в проявлении последними биологической активности.
Коформации в ряду циклических углеводородов:
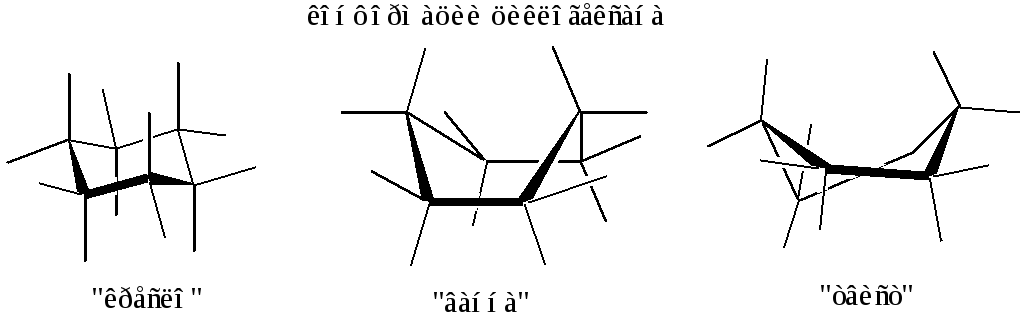
Конфигурационная изомерия
Объёмные структуры циклических соединений содержат разные по природе положения заместителей:
|
|
а – аксиальные (попеременно направлены в противоположные стороны от плоскости кольца); е – экваториальные (направлены радиально от плоскости и попеременно в противоположные стороны) |
Оптическая изомерия
Некоторые органические соединения являются оптически активными. Они способны изменять плоскость поляризации света при прохождении его через образец вещества (1815 г. Ж. Био).
Свет – электромагнитные волны, колебания которых перпендикулярны направлению их распространения. В естественном (солнечном) свете эти колебания происходят в различных плоскостях.
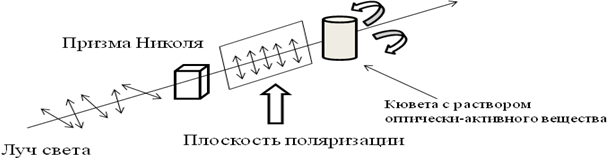
Оптически активные соединения поворачивают плоскость поляризации на определённый угол вправо (правовращающие) или влево (левовращающие).
Изомеры, вращающие плоскость поляризации в разные стороны, но на один и тот же угол – антиподы (энантиомеры).
Рацемическая смесь (рацемат) – смесь, состоящая из равных количеств лево- и правовращающих изомеров. Рацемат оптически не активен.
Оптическая активность характерна для соединений содержащих sp3 гибридный атом (объёмные молекулы). Если такой атом связан с четырьмя различными заместителями, то возникают изомерные пары, в которых молекулы изомеров относятся по своей пространственной организации одна к другой так же, как соотносятся между собой предмет и зеркальное изображение.

Изображение энантиомеров
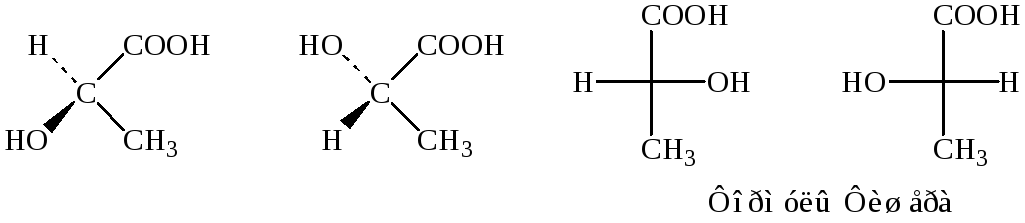
Для того, чтобы связать строение с вращением, было предложено выбрать соединение-стандарт и сравнить с ним все другие соединения, содержащие хиральный центр. В качестве стандарта был выбран 2,3-диоксипропаналь (глицериновый альдегид):

R,S- номенклатура
Для отнесения стереоизомера необходимо определить в нем старшинство заместителей (порядковый номер элемента – как в случае Z,E-изомерии). Взгляд наблюдателя направляется по оси С-младший заместитель (Н). После такой ориентации смотрят, как три заместителя располагаются в ряд в направлении от старшего к младшему. В случае R-конфигурации этот порядок соответствует направлению движения по часовой стрелке, в случае S-конфигурации – против часовой стрелки.
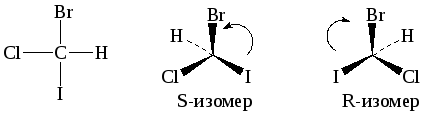
Если молекуле имеется несколько хиральных центров, то число изомеров возрастает и равняется 2n, где n-число хиральных центров.
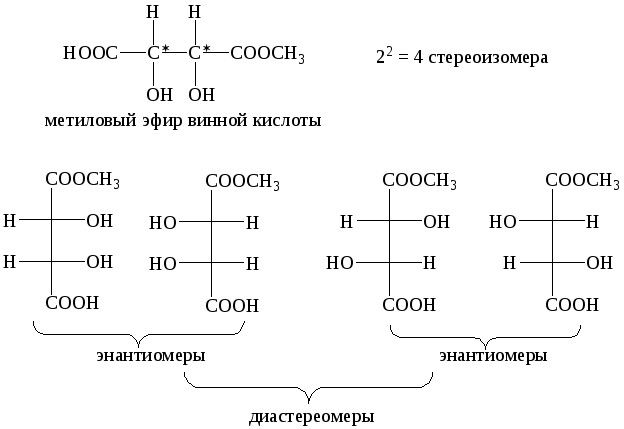
В отличие от структурных изомеров энантиомеры идентичны один другому в большинстве своих свойств. Они отличаются только по своему взаимодействию с плоскополяризованным светом и взаимодействием с веществамии, которые также являются хиральными.
В организме реакции протекают с участием биокатализаторов - ферментов. Ферменты построены из хиральных молекул α-аминокислот. Поэтому они играют роль хиральных реагентов, чувствительных к хиральности взаимодействующих с ними субстратов (стереоспецифичность биохимических процессов). Это приводит к тому, что хиральные природные соединения представлены, как правило, лишь одной стереоизомерной формой (D-углеводы, L-аминокислоты).
Стереоспецифичность лежит в основе проявления биологического действия одним из энантиомеров, в то время, как другой изомер может быть неактивным, а иногда оказывать иное или даже противоположное действие.