
Элементы современной физики атомов и молекул_1
.pdfЭлементы современной физики атомов и молекул
Атом водорода в квантовой механике

Потенциальная энергия взаимодействия электрона с
ядром: |
Z e2 |
|
U r |
||
4 0 r |
где r — расстояние между электроном и ядром.
Уравнение Шредингера для электрона в атоме водорода:
|
2m |
|
Z e2 |
|
|
|
(E |
|
) 0 |
2 |
|
|||
|
|
4 r |
||
|
|
|
0 |
|
где m - масса электрона, Е - полная энергия электрона в атоме.
имеет |
решения, |
удовлетворяющие |
требованиям |
однозначности, конечности и непрерывности волновой функции, только при собственных значениях энергии:
E |
|
|
1 Z 2me4 |
|
||||
|
n |
|
|
2 |
|
2 |
2 |
n = 1, 2, 3, .. |
|
|
|
n |
|
|
8h |
0 |
|
|
|
|
|
|
|
|||
т.е. для дискретного набора отрицательных значений энергии
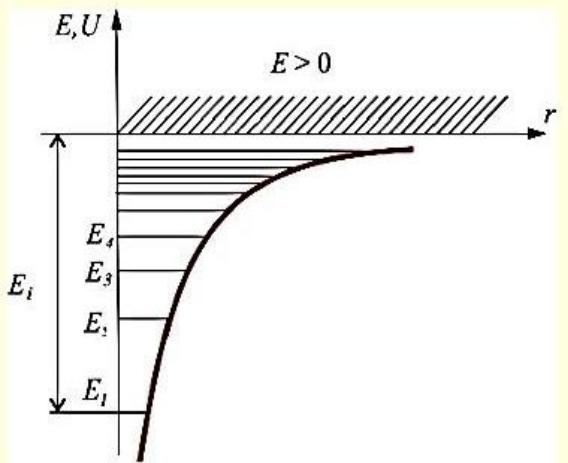
Самый нижний уровень Е1, c минимальной возможной энергией, - основной,
все остальные (Еn > Е1, n = 2, 3, ...) – возбужденные.
При Е < 0 движение электрона является связанным.
n |
E 0 |
|
|
|
При Е > 0 движение электрона является свободным. |
||||
Энергия ионизации атома водорода: Ei E1 |
me4 |
|
13,55эВ |
|
8h2 |
2 |
|||
|
|
0 |
|
|
Квантовые числа
n - главное квантовое число
определяет энергетические уровни электрона в атоме (полную энергию электрона в атоме) и размер электронного облака (атома).
n 1,2,3,....,
E |
|
|
1 |
|
Z 2me4 |
|
|
|
|
|
|
n |
n2 8h2 02 |
|
|
|
|
|
|||||
|
|
n |
1 |
2 |
3 |
4 |
|||||
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
состояние |
K |
L |
M |
N |
|
|
|
|
|
|
|
(символ) |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
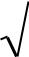
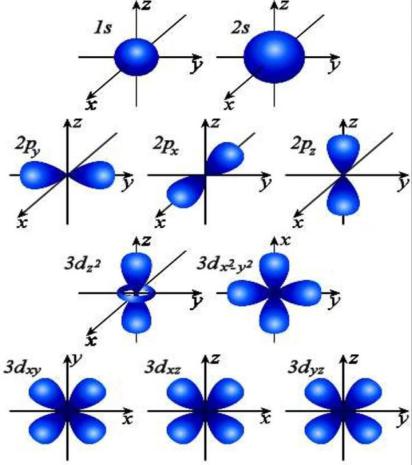
l – орбитальное (азимутальное) квантовое число
определяет форму электронного облака (орбитали) и характеризует величину орбитального момента импульса электрона в атоме.
Момент импульса электрона относительно ядра:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Le |
l(l 1) |
||
l = 0, 1, 2, …, n – 1. |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
l |
0 |
1 |
2 |
3 |
4 |
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
символ |
s |
p |
d |
f |
g |
|
h |
|
|
|
|
|
|
|
|
|
|
|
|
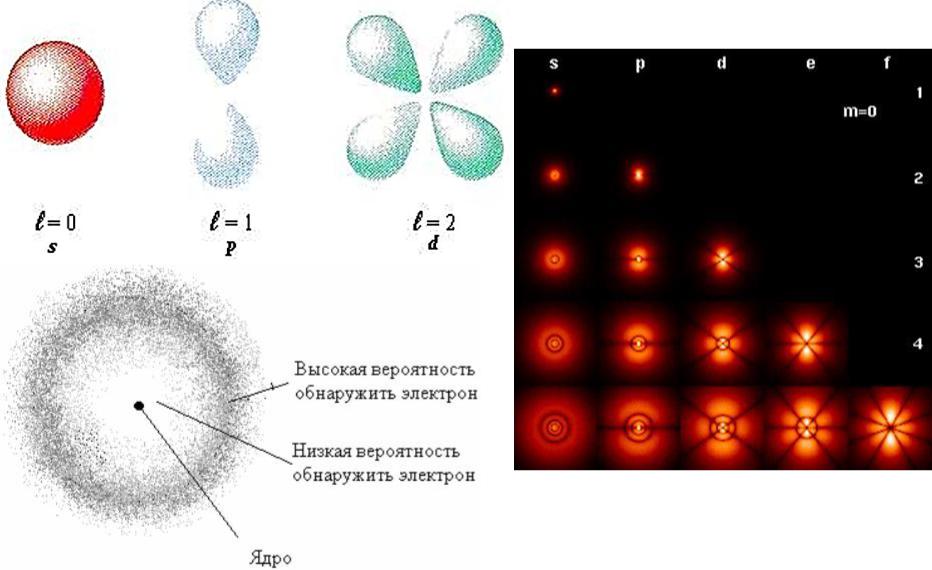
Область пространства, в которой высока вероятность обнаружить электрон (не менее 0,95%), называется
орбиталью.
m - магнитное квантовое число
определяет проекцию вектора орбитального момента импульса электрона атома на направление внешнего магнитного поля (ориентацию орбитали в пространстве).
(Ll )z m
m = 0, ±1, ±2, …, ±l.
Всего таких ориентаций в пространстве, т.е. состояний электрона, будет 2l + 1
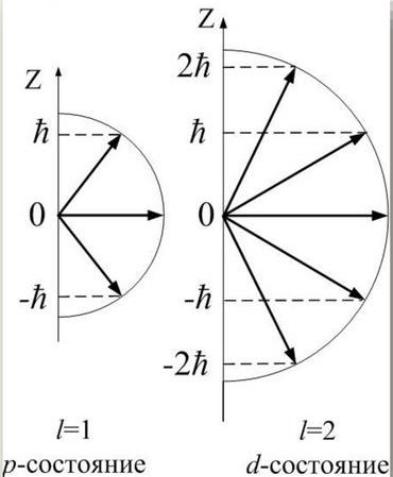
Эффект Зеемана – в магнитном поле уровень с главным квантовым числом n расщепляется на 2l + 1 подуровней.
Общее число состояний:
n 1
N (2l 1) n2
l 0
Общее число состояний при заданном n с учетом спина:
N 2n2

Опыты Штерна и Герлаха
(экспериментальное доказательство квантования проекции магнитного момента атома на направление магнитного поля)
Если бы момент импульса атома |
(его |
|
магнитный момент |
) мог принимать |
|
произвольные |
ориентации |
в |
пространстве (т.е. в магнитном поле), то
наблюдалось |
бы |
непрерывное |
|
распределение |
попаданий |
атомов |
|
серебра на фотопластинку с |
большой |
||
плотностью попаданий в середине.
Но на фотопластинке получились две резкие полосы – все атомы отклонялись в магнитном поле двояким образом, соответствующим лишь двум возможным ориентациям магнитного момента.
Этим доказывался квантовый характер магнитных моментов электронов.
