
Элементы современной физики атомов и молекул_1
.pdf
Правило Хунда
Заполнение |
электонами |
орбиталей внутри |
подуровня |
происходит так, |
чтобы алгебраическое |
значение суммарного спина было максимальным, т.е. внутри подуровней электроны заполняют все максимально возможные свободные орбитали.
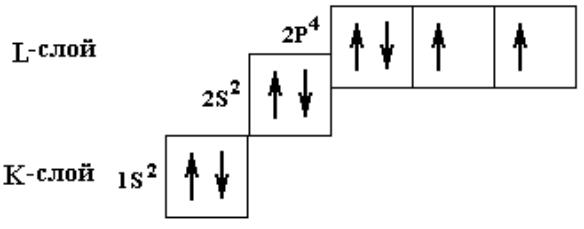
Связь распределения электронов по орбиталям с
периодической таблицей Менделеева
Периодическая система элементов Д. И. Менделеева
Совокупность электронов с одинаковым n (но разными l,m,mS) образует электронный слой или электронную оболочку в атоме.
n |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
|
|
|
|
|
|
слой |
K |
L |
M |
N |
O |
P |
Q |
|
|
|
|
|
|
|
|
N = 2n2 |
2 |
8 |
18 |
32 |
50 |
72 |
98 |
В атоме водорода Н 1s1 n = 1, l=0
один электрон находится в s-состоянии
В атоме гелия Не 1s2
Li 1s22s1 |
|
|
|
1 |
|
|
|
||||
|
|
|
n 2, l 0, m 0, m |
|
|
|
|
|
|||
|
|
|
S |
|
|
|
|||||
Ве 1s |
2 |
2s |
2 |
|
2 |
|
|
|
|||
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|||
Nа 1s22s22p63s1 |
n 3, l 0,1, m 0, mS |
|
1 |
||||||||
2 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
||


Связь между положением элемента в ПС и
строением атома:
1.Порядковый номер элемента соответствует заряду ядра и общему заряду электронов.
2.Номер периода соответствует числу электронных уровней атома.
3.У элементов главных подгрупп число электронов на внешнем электронном уровне (оболочке) равно номеру группы.
Элементы в ПС расположены в последовательности увеличения зарядов их ядер.
С увеличением зарядов ядер изменяется структура внешних электронных уровней внутри периода (переход элементов от металлов к неметаллам). В периодах слева направо, с увеличением зарядов ядер элементов, усиливается притяжение электронов к ядру и происходит сжатие атома, т. е. уменьшение атомного радиуса элементов.
В начале каждого периода располагаются элементы, имеющие больший атомный радиус и меньшее число электронов на внешнем электронном слое. Чем больше атомный радиус, тем слабее притяжение электронов внешнего слоя и тем легче элементу отдавать электроны.
С увеличением атомного номера элементов увеличивается заряд ядра и число электронов во внешнем слое и уменьшается легкость отдачи электронов с этого слоя.
Номер группы указывает число электронов на внешней электронной оболочке атомов элементов данной группы. Чем больше атомный радиус, тем дальше от ядра электроны внешнего слоя и тем слабее они удерживаются ядром.
Элементарная квантовая теория испускания
атомами электромагнитного излучения
Возбуждение |
атомов |
может |
инициироваться различными способами:
•за счет столкновений с элементарными частицами – ударное возбуждение,
•при столкновениях с атомами – тепловое
возбуждение,
•при поглощении атомами электромагнитного
излучения.

Е h En E1
n |
|
13,6 |
эВ |
|
|
1 |
|
||
|
|
|
|
1 |
|
, |
|||
|
h |
|
|
n2 |
|||||
|
|
|
|
|
|
|
|
||
n 2, 3, 4 ... |
|
|
|
|
|||||

Спонтанное и вынужденное излучения
Спонтанные (самопроизвольные) переходы происходят с более высоких на более низкие уровни и сопровождаются испусканием фотона (самопроизвольное излучение в отсутствие внешних воздействий).
Т.к. спонтанные переходы взаимно не связаны, то спонтанное излучение некогерентно.
