
Протисты / Карпов С.А. Строение клеток протистов
.pdf
ГЛАВА 4. СТРОЕНИЕ КЛЕТКИ ПРОТИСТОВ
(в частности, корешков). Первоначально гомология корешков была установлена у инфузорий. Их кинетида обычно характеризуется наличием трех корешков: одного фибриллярного (кинетодесмальный филамент) и двух микротрубочковых (трансверсальная фибрилла и постцилиодесма) (рис. 4.29). В пределах этого таксона была прослежена трансформация дериватов кинетосом и показаны пути их эволюции. В результате была произведена ревизия всей макросистемы инфузорий, опиравшейся ранее на признаки ротовой цилиатуры, и предложена новая классификация. Интересно, что сходные результаты при построении системы инфузорий были независимо получены в США Д.Линном (D. Lynn) и в России Л.Н.Серавиным и З.П.Герасимовой примерно в одно и то же время (1976–1981 годы).
Âконце 70-х была продемонстрирована гомология микротрубочковых корешков у зеленых водорослей (рис. 4.26) и жгутиковых клеток высших растений (Stewart, Mattox, 1975, Moestrup, 1978, Melkonian, 1982, Sluiman, 1983), что привело,
âконечном счете, к перестройке всей системы зеленых водорослей и признанию монофилетичности всей группы: Chlorophyta, Charophyta и Plantae.
Позднее были получены доказательства гомологии дорсального и вентрального корешков у эвгленовых и кинетопластид. У тех и других они расположены латерально, начи- наются соответственно от кинетосомы переднего и заднего жгутиков и укрепляют стенки жгутикового кармана или резервуара (Brugerolle et al., 1979, Kivik, Walne, 1984, Frolov, Karpov, 1995).
Âначале 90-х была показана гомология микротрубочковых корешков у хризофитовых и близких к ним гетероконтных водорослей и зооспоровых грибов (Andersen, 1991). Для каждой кинетосомы характерно наличие пары микротрубочковых корешков, причем от кинетосомы опушенного жгутика обычно отходит ребристый корешок (рис. 4.27).
Âпоследнее время показана гомология корешков у церкомонад, протостелид и миксогастриевых (Karpov, 1997). В настоящее время усиленно ведутся поиски гомологичных корешков, объединяющих все группы протистов (Moestrup, 2000).
170

4.2. ЦИТОСКЕЛЕТ
Рис. 4.29. Организация кинетиды и кинетома у инфузорий. (По: Lynn, Small, 1981.)
А – структура соматической кинетиды, Б – строение соматических кинет, В – организация кинетома (соматической и оральной цилиатуры). кд– кинетодесмальный филамент, кн – кинетосомы соматической цилиатуры, оц – оральная цилиатура, пц – постцилиарная фибрилла, т – трансверсальная фибрилла.
Понятие кинетиды
Для общего определения жгутикового/ресничного аппарата часто используется понятие «кинетида». Определение этого понятия для протистов не вполне четкое, т.к. первоначально было разработано только для инфузорий. Весь двигательный аппарат инфузорий обычно называется кинетом. Он состоит из рядов ресничек, которые определяются как кинеты. Кинетида же представляет собой «элементарную» структурно-функциональ- ную единицу кинеты или всего кинетома (рис. 4.29). Для жгутиконосцев, имеющих 1–2 жгутика, понятие кинетома и кинетиды совпадают. Наиболее консервативная часть кинетиды – кинетосомы, количество которых в кинетиде подавляющего большинства протистов равно двум. Двухкинетосомальное состояние кинетиды распространено наиболее широко, хотя есть
171

ГЛАВА 4. СТРОЕНИЕ КЛЕТКИ ПРОТИСТОВ
и истинно одножгутиковые формы (см. выше) и некоторые многожгутиковые (опалиниды), у которых кинетосомы непарные.
Для полимастигин (дипломонады, оксимонады, парабазалии) характерно объединение жгутиков с ядром в единый мор- фо-функциональный комплекс (рис. 4.30). Его принято называть кариомастигонтом. Обычно кариомастигонт содержит 4 жгутика и 4 кинетосомы, объединенные попарно. Поскольку пары кинетосом часто не связаны друг с другом морфологиче- ски, можно считать, что кариомастигонт содержит две кинетиды и одно ядро. Такая ситуация характерна для многих четырехжгутиковых протистов. По-видимому, такой кинетом сформировался в процессе эволюции путем удвоения двухкинетосомальной кинетиды.
У протистов наблюдаются как процессы редукции двухкинетосомальной кинетиды, так и ее полимеризация. Их можно проследить в рамках того или иного монофилетичного таксона. Так, было показано, что исходной для зеленых водорослей является двухкинетосомальная кинетида. В результате ее удвое-
Рис. 4.30. Схема строения переднего конца тела трихомонады
Ditrichomonas honigbergii. (По: Farmer, 1993.) аг – аппарат Гольджи, ак – аксостиль, п – пельта, пф – парабазальные фибриллы, р – кинетосома рекуррентного жгутика, ум – ундулирующая
мембрана, я – ядро. Пронумерованы кинетосомы, от которых отходят жгутики.
172
4.2. ЦИТОСКЕЛЕТ
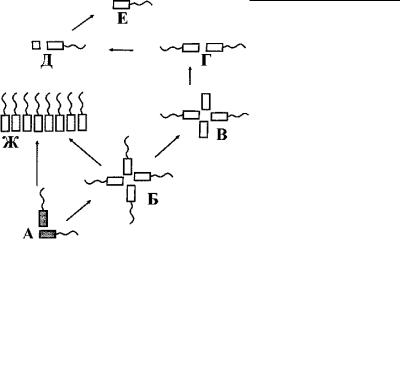
ния появился наиболее распространенный среди них четырехжгутиковый тип кинетиды, подвергшийся в дальнейшем процессам редукции как жгутиков, так и кинетосом вплоть до истинно одножгутиковой кинетиды Micromonas (рис. 4.31). Эта же двухкинетосомальная кинетида дала начало и кинетому гамет и зооспор эдогониевых водорослей, насчитывающему десятки жгутиков (Pickett-Heaps, 1971).
Рис. 4.31. Предполагаемые пути эволюции кинетиды у зеленых водорослей. (По: Карпов, 1993.)
А – исходная двухкинетосомальная кинетида (современные спермии харовых водорослей), Б – удвоение кинетиды (современные празинофитовые – Pyramimonas), В – редукция жгутиков (современные празинофитовые), Г – редукция кинетосом (современные Chlamydomonas), Д – полная редукция жгутика и частичная редукция одной из кинетосом (Pedinîmonas), Е – полная редукция одной из кинетосом (Micromonas), Ж – полимеризация жгутиков (современные зооспоры и спермии эдогониевых).
Полимеризация кинетиды у полимастигин (дипломонад, оксимонад и парабазалий) – генеральная линия эволюции. Исходным для них, по-видимому, должен считаться кариомастигонт с двумя парами кинетосом, которые тесно связаны с ядром (рис. 4.32). У дипломонад происходит удвоение кариомасти-
173

ГЛАВА 4. СТРОЕНИЕ КЛЕТКИ ПРОТИСТОВ
гонта, что приводит к появлению двухлучевой или даже билатеральной симметрии у особей, обладающих двумя ядрами и 8 жгутиками. Дальнейшее развитие этого пути полимеризации кариомастигонта находит отражение у оксимонад (рис. 4.32). В некоторых родах оксимонад число кариомастигонтов достигает сотен на одну клетку.
Такой же тип полимеризации всего кариомастигонта характерен также для трихомонад из отряда Calonymphyda. Для большинства же их отмечена полимеризация только кинетиды, что имеет место у многожгутиковых гипермастигин с одним ядром (рис. 4.32).
Недавно была обнаружена свободноживущая анаэробная трихомонада Ditrichomonas honigbergii (Farmer,1993), ó êîòî-
Рис. 4.32. Предполагаемые пути полимеризации кинетиды у полимастигин. (Ориг.).
А–Б – путь полимеризации кинетиды у дипломонад и оксимонад. А – исходная двухкинетосомальная кинетида (гипотети- ческая), Б – удвоение кинетиды (ретортамонады), что приводит в дальнейшем к образованию устойчивой связи кинетиды с ядром и формированию двух кариомастигонтов (2 КМ) у дипломонад и поликариомастигонтов (ПКМ) у оксимонад. В–Ж – путь полимеризации кинетиды у парабазалий. В – исходная двухкинетосомальная кинетида (гипотетическая), Г – удвоение кинетиды (Ditrichomonas), Д – переориентация кинетосом, что приводит к образованию устойчивого кариомастигонта (трихомонады) и дальнейшей его полимеризации с формированием поликариомастигонта (ПКМ) у калонимфид, Е – увеличение числа передних жгутиков (трихомонады), Ж – полимеризация кинетиды (гипермастигины).
174

4.2. ЦИТОСКЕЛЕТ
рой 4 кинетосомы расположены попарно (рис. 4.30). Это попарное расположение кинетосом указывает, по-видимому, как
èу других полимастигин, на исходное двухкинетосомальное состояние кинетиды у предков всех полимастигин.
Полимеризация кинетиды от 2 исходных кинетосом отмечается также у протеромонад и ведет к многожгутиковости опалинат. Наиболее яркий пример такого типа полимеризации кинетиды демонстрируют инфузории (рис. 4.29). Их кинетом формируется на основе полимеризации двух кинетосом (Lynn, 1991) и подвергается в дальнейшем глубокой морфологической и функциональной дифференцировке, часто ведущей к олигомеризации кинетома (Догель, 1951).
Обобщая, можно заключить, что полимеризация кинетиды у протистов чаще всего начинается с бикинетосомального состояния, и первый этап этой полимеризации в подавляющем большинстве случаев ведет к удвоению кинетиды. В дальнейшем, если устанавливается прочная связь с ядром и формируется кариомастигонт, полимеризации подвергается весь кариомастигонт, что приводит к появлению многоядерных и многожгутиковых протистов. Если же связь с ядром непрочная, полимеризация кинетиды идет независимо от ядра.
Принято считать, что поскольку бикинетосомальное состояние наиболее широко распространено среди протистов, то оно
èявляется наиболее древним. Как мы видели, оно действительно наиболее консервативно, т.к. почти во всех группах протистов полимеризация начинается именно с 2 кинетосом. Кинетосомы и центриоли имеют одинаковое строение, поэтому и происхождение кинетосом легко объяснить, если предположить, что центриолярный аппарат клетки был первичен. Тогда в эволюционном смысле кинетосомы – это центриоли, у которых выросли жгутики. Это наиболее общепринятая в настоящее время точка зрения на происхождение жгутиков и ресничек.
Однако помимо этого широко представленного пути полимеризации кинетиды у протистов имеет место и другой, идущий, по-видимому, на основе одной кинетосомы (Карпов, 1993). Он характерен для некоторых хитридиевых грибов, протостелид (Myxomycetes) и шизопиренид (Heterolobosea). Их жгутико-
175

ГЛАВА 4. СТРОЕНИЕ КЛЕТКИ ПРОТИСТОВ
вые стадии имеют, как правило, непостоянное для вида число кинетосом, при этом каждая кинетосома обладает индивидуальным набором корешков. Эти примеры свидетельствуют о возможном пути становления кинетиды протистов на основе однокинетосомального состояния.
Такое положение противоречит общепринятым представлениям о происхождении кинетиды из центриолей. Однако и его нельзя исключать из возможных путей становления кинетиды у эукариот. В конце концов, появление центриолей тоже должно быть объяснено. Кроме того, эволюционно консервативные состояния (в данном случае бикинетосомальное) не обязательно должны быть наиболее древними, а предковая форма (однокинетосомальное состояние) может встречаться весьма редко. Поэтому следует признать вполне вероятным и путь становления кинетиды эукариот на основе однокинетосомального состояния кинетиды.
4.2.2. Функции жгутика/реснички
Основная функция жгутика – движение. В активной работе жгутика движущим началом являются периферические микротрубочки и их динеиновые ручки, обладающие АТФ-азной активностью. На изолированных дублетах микротрубочек аксонемы показано, что при добавлении АТФ происходит скольжение дублетов относительно друг друга. Находясь в составе жгутика, дублеты связаны друг с другом и с центральными микротрубочками, формируя длинный цилиндр. Поэтому скольжение дублетов относительно друг друга, вызванное работой динеиновых ручек, приводит к изгибанию аксонемы. Центральные микротрубочки выполняют при этом опорную функцию. Исследования мутантов Chlamydomonas reinhardtii показали, что внутренние динеиновые ручки вызывают изгибание жгутика и определяют размер и форму волны биения. Наружные ручки усиливают этот эффект и увеличивают частоту биения. Недавно было установлено, что центральные микротрубочки выполняют не только опорную функцию, но вместе с радиаль-
176

4.2. ЦИТОСКЕЛЕТ
ными спицами взаимодействуют с внутренними ручками, контролируя форму биения жгутика (Porter, Sale, 2000).
Формы движения жгутика различны, но обычно это волнообразное изгибание с частотой до 50 колебаний в секунду. У большинства протистов биение жгутика происходит в одной плоскости. У инфузорий и многожгутиковых протистов движение ундулиподий организовано по типу метахрональных волн. При этом биение отдельной реснички состоит из двух этапов: рабочий удар и возвратное движение (рис. 4.33). Во время рабочего удара прямая ресничка совершает гребное движение спереди назад, а при возвратном движении она мягко волнообразно изгибается, возвращаясь назад уже по другой траектории (рис. 4.33), максимально приближенной к поверхности тела, и сводя к минимуму тормозное влияние. Таким образом, рабо- чий удар ресничек направляет движение клетки в противоположную сторону.
Рис. 4.33. Кинетика биения ресничек и жгутиков. (По: Sleigh, 1991.)
При рабочем ударе (А) ресничка захватывает бульшую массу воды (ограничено пунктирной линией), чем при возвратном (Б) движении. В – форма биения жгутиков у плывущей хламидомонады. Стрелками показано рабочее движение жгутиков.
177

ГЛАВА 4. СТРОЕНИЕ КЛЕТКИ ПРОТИСТОВ
Следует подчеркнуть, что с точки зрения физики передвижение в жидкости малых объектов, какими являются жгутиконосцы и инфузории, существенно отличается от движения крупных организмов (например, рыб). Вообще к движущемуся в воде или воздухе телу приложимы следующие силы: силы инерции движущегося тела и силы вязкости, связанные со скольжением слоев жидкости относительно друг друга. Отношение сил инерции к силам вязкости выражается числом Рейнольдса (R), которое прямо пропорционально размерам движущегося тела. Например, для крупной рыбы число R может составлять 1000, тогда как для жгутиконосца оно будет менее 0,01. Таким образом, если для рыбы силы вязкости пренебрежительно малы по сравнению с силами инерции, то для жгутиконосца, наоборот, силы инерции в сто раз меньше сил вязкости, и уже силами инерции можно пренебречь. Другими словами, как только жгутики или реснички перестают работать, клетка сразу же останавливается.
По сравнению с размерами тела клетки, прилегающий к ее поверхности ламинарный слой жидкости имеет значительную толщину. Поэтому во время рабочего удара расправленная ресничка захватывает и перемещает сравнительно большой объем жидкости (рис. 4.33). Во время возвратного движения реснич- ка пригибается к поверхности клетки и проходит вблизи него, поэтому объем захватываемой и перемещаемой жидкости зна- чительно меньше, чем при рабочем ударе (рис. 4.33). Это и обеспечивает поступательное движение клетки. Метахрональные волны, пробегающие по поверхности тела многожгутиковых и ресничных протистов, могут быть организованы различным образом. В зависимости от направления рабочего удара по отношению к направлению распространения метахрональной волны различают симплектическую (рабочий удар направлен по ходу метахрональной волны), антиплектическую (рабочий удар направлен против волны) и диаплектическую (рабочий удар направлен под углом к волне) формы метахронии (рис. 4.34).
Диаплектическая форма метахрональной волны, в свою оче- редь, делится на 2 вида (рис. 4.34): леоплектическую (рабочий удар реснички направлен влево, если смотреть по ходу распро-
178

4.2. ЦИТОСКЕЛЕТ
Рис. 4.34. Основные формы биения ресничек. (По: Sleigh, 1989.)
Показана связь между направлением рабочего удара реснички (тонкая стрелка) и направлением метахрональной волны (толстая стрелка). На рис. В и Г (диаплектическая форма) рабочий удар реснички направлен на читателя. А – симплектическая форма, Б – антиплектическая, В – леоплектическая, Г – дексиоплектическая.
странения волны) и дексиоплектическую (рабочий удар реснички направлен вправо, если смотреть по ходу распространения волны). Большинство ресничных полей у инфузорий демонстрируют диаплектическую форму метахронии.
Жгутики и реснички часто используются также и для питания. При этом форма биения жгутика может меняться по сравнению с двигательным, а может оставаться неизменным. Формы биения жгутиков, вызываемых ими токов жидкости и направления движения клетки у различных протистов показаны на рисунке 4.35. Помимо движения и питания протисты используют жгутики для того, чтобы очищать поверхность тела от налипающих на него мелких посторонних частиц.
Многие хризомонады имеют редуцированный рулевой жгутик. Обычно в его основании расположено вздутие, представляющее часть фоторецепторного аппарата, т.е. жгутики могут выполнять и рецепторную функцию.
179
