
Травень В.Ф. - Органическая химия. В 3 т. Т. 1
..pdf
1.11. Кислоты и основания. Теория Брёнстеда |
81 |
1.11.КИСЛОТЫ И ОСНОВАНИЯ. ТЕОРИЯ БРЁНСТЕДА
От чего зависят относительные скорости и направления органических реакций? Это важнейший вопрос органической химии. Теоретические представления, отвечающие на этот вопрос, называют концепциями реакционной способности. С основными концепциями реакционной способности органических соединений удобнее всего познакомиться при рассмотрении наиболее распространенных органических реакций — реакций между кислотами и основаниями.
В органической химии известно несколько теорий, которые объясняют кислотно-основные свойства органических соединений. Прежде всего это теории Брёнстеда и Льюиса.
Согласно теории Брёнстеда (Й. Брёнстед, 1923 г.), кислота — это любое вещество, способное диссоциировать с отщеплением протона, а основание — любое соединение, способное присоединять протон:
H A |
H + A |
кислота |
сопряженное |
|
основание |
B + H |
BH |
основание |
сопряженная |
|
кислота |
1.11.1.Кислоты Брёнстеда
Мерой силы кислоты Брёнстеда является константа ее диссоциации Kа, определяемая по отношению к воде как основанию, или соответствующее значение pKа .
H |
|
A |
+ H2O |
|
|
|
|
A |
+ |
H3O |
(1) |
|||||
|
|
|
|
|||||||||||||
|
||||||||||||||||
|
|
|
|
|
||||||||||||
кислота |
основание |
|
сопряженное |
|
сопряженная |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
основание |
|
кислота |
|
|
Ka |
|
|
= |
[A ] [H3O ] |
, –lg Ka = pKa |
|
. |
|
||||||||
(H2O) |
|
[H |
|
A] |
(H2O) |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||

82 Глава 1. Природа ковалентной связи. Электронные эффекты. Кислоты и основания
Наиболее известные примеры органических кислот — алифатические и ароматические карбоновые кислоты.
|
|
O |
|
|
|
|
|
|
O |
|
CH3 |
|
C |
+ H2O |
|
|
|
CH3 |
|
C |
+ H3O (pKa 4,76) |
|
|
|
|
|
||||||
|
|
|
||||||||
|
|
OH |
|
|
|
|
|
|
O |
|
уксусная кислота |
|
|
|
|
ацетат-ион |
|
||||
O |
|
|
|
|
|
O |
|
|
|
|
|
||
C + H O |
|
|
|
|
|
C + H3O (pKa |
|
|
|||||
|
|
|
||||
2 |
|
|
|
|
|
O |
OH |
|
|
|
|
|
4,20)
бензойная кислота |
бензоат-ион |
Это кислоты средней силы. Для сравнения ниже даны значения рKа ряда неорганических и органических кислот. Здесь и далее приведены значения pKа для воды в качестве растворителя.
|
|
|
|
|
|
Реакция |
pKa |
|||||||
HI + H2O |
|
|
|
|
|
|
|
I + H3O |
—10,0 |
|||||
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|||||||||
HNO3 + H2O |
|
|
|
|
|
|
|
|
NO3 + H3O |
1,6 |
||||
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
||||||||
H2O + H2O |
|
|
|
|
|
|
|
OH + H3O |
15,7 |
|||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|||||||
CH3OH + H2O |
|
|
|
|
|
|
|
CH3O + H3O |
15,5 |
|||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
||||||||
Отщеплять протон могут органические соединения, относящиеся и к другим классам. Среди органических соединений различают OH-, SH-, NH- и CH-кислоты. В настоящее время изучены органические кислоты, имеющие значения рKа в интервале* от –15 до 50. Данные для некоторых кислот приведены в табл. 1.12. Отдельно следует отметить наиболее сильную из органических кислот — трифторметансульфоновую кислоту CF3SO3H, которая относится к группе так называемых суперкислот. Сила этой кислоты превышает кислотность сильных минеральных кислот, в том числе серной и соляной кислот (по некоторым данным, ее значение рКа достигает –15).
Чем определяется сила кислоты?
Как и во всех обратимых органических реакциях, определяющей является разность свободных энергий ( G°) продуктов и исходных веществ, выражаемая в килоджоулях или килокалориях на моль (кДж/моль или
* Очень слабые кислоты, имеющие значения pKa > 16, изучают в специальных условиях с применением сильных и сверхсильных оснований. Измеренные при этом значения констант кислотности пересчитывают затем для получения стандартных значений pKa (Н2О).

1.11. Кислоты и основания. Теория Брёнстеда |
83 |
|||
|
Таблица 1.12. Кислоты Брёнстеда |
|
|
|
|
|
|
|
|
|
Тип кислот |
Формула |
pKa |
|
|
ОН-кислоты: |
|
|
|
|
карбоновые кислоты |
HCOOH |
3,75 |
|
|
|
CH3COOH |
4,76 |
|
|
|
ClCH2COOH |
2,85 |
|
|
|
FCH COOH |
2,57 |
|
|
|
2 |
|
|
|
|
F3CCOOH |
0,23 |
|
|
|
N≡CCH COOH |
2,47 |
|
|
|
2 |
|
|
|
|
O2NCH2COOH |
1,68 |
|
|
|
C6H5COOH |
4,20 |
|
|
спирты и фенолы |
C6H5OH |
9,98 |
|
|
|
H2O |
15,7 |
|
|
|
CH OH |
15,5 |
|
|
|
3 |
|
|
|
|
C2H5OH |
15,9 |
|
|
|
(CH3)2CHOH |
16,5 |
|
|
NH-кислоты: |
(CH3)3COH |
18,0 |
|
|
|
|
|
|
|
амины и амиды |
CH3CONH2 |
15,0 |
|
|
|
NH3 |
33 |
|
|
|
(C2H5)2NH |
35 |
|
|
|
C6H5NH2 |
25 |
|
СН-кислоты |
CH3NO2 |
10,2 |
|
|
|
|
CH2(NO2)2 |
4,0 |
|
|
|
CH(NO3)3 |
0,0 |
|
|
|
CH2(COCH3)2 |
9,0 |
|
|
|
CH3COCH2COOC2H5 |
10,7 |
|
|
|
CH2(COOC2H5)2 |
13,3 |
|
|
|
C6H5COCH3 |
19,1 |
|
|
|
HC≡CH |
25 |
|
|
|
CH2=CH2 |
37 |
|
|
|
C6H6 |
43 |
|
|
|
CH3–CH3 |
50 |
|
ккал/моль). В процессе кислотной диссоциации речь идет о разности свободных энергий сопряженного основания и кислоты.
Энергия
G° прод
G° > 0
G° исх
Энергия
G° исх
G° < 0
G° прод

84 |
Глава 1. Природа ковалентной связи. Электронные эффекты. Кислоты и основания |
|
|
Чем устойчивее сопряженное основание, тем ниже свободная энергия |
|
диссоциации G°, тем более равновесие (1) смещено вправо, тем сильнее |
||
кислота. Зависимость между значениями |
G° и lgKa выражается уравнением |
|
|
G° = –2,303 RT lgKa , |
(2) |
где R = 8,31 10–3 кДж/(К моль), а T — температура в градусах Кельвина. Рассмотрим примеры, которые иллюстрируют закономерности измене-
ния кислотности в зависимости от строения кислоты.
1.Чем выше номер группы Периодической системы Д.И. Менделеева,
ккоторой относится элемент, тем сильнее он удерживает электроны в сопряженном основании, тем сильнее соответствующая кислота.
|
|
Реакция |
pKa |
|||||
|
|
(B) |
|
|
||||
HF |
|
|
|
|
|
H |
+ F |
3,17 |
|
|
|||||||
|
|
|
|
|||||
H2O |
|
(B) |
|
15,7 |
||||
|
|
|
|
|
H |
+ OH |
||
|
|
|
|
|||||
|
|
|
|
|||||
NH3 |
|
(B) |
|
33,0 |
||||
|
|
|
|
|
H |
+ N2H |
||
|
|
|
|
|||||
|
|
|
|
|
||||
CH4 |
|
(B) |
|
48,0 |
||||
|
|
|
|
|
H |
+ C3H |
||
|
|
|
|
|
||||
|
|
|
|
|
||||
2. Более высокая кислотность карбоновых кислот по сравнению со спиртами объясняется большей устойчивостью карбоксилат-иона по сравнению с алкоксид-ионом. Отрицательный заряд в карбоксилат-ионе, например в ацетат-ионе, резонансно делокализован на двух атомах кислорода:
|
|
|
|
|
|
|
1 |
|
||||||
|
|
O |
|
|
|
O |
|
|
|
|
O |
2 |
|
|
CH3 |
|
C |
|
CH3 |
|
C |
|
|
CH3 |
|
C |
1 |
|
|
|
|
|
|
|
||||||||||
|
|
|||||||||||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
||||||||||
|
O |
|
|
O |
|
|
|
O2 |
||||||
|
|
|
|
|
|
|
|
|
||||||
ацетат-ион
В алкоксид-ионе, например в метоксид-ионе, такая делокализация невозможна.
|
|
|
|
|
Кислота |
|
G°, кДж/моль |
pKa |
|||
|
|
|
|
|
|
|
|
|
|
(ккал/моль) |
|
CH3COOH |
|
|
|
|
|
H |
+ CH3COO |
21,1 (6,5) |
4,76 |
||
|
|
|
|
||||||||
|
|
|
|
|
|||||||
уксусная |
|
|
|
|
|
|
ацетат- |
|
|
||
кислота |
|
|
|
|
|
|
ион |
|
|
||
CH3OH |
|
|
|
|
|
H + |
CH3O |
91,2 (21,8) |
15,5 |
||
|
|
|
|
||||||||
|
|
|
|
|
|||||||
метанол |
|
|
|
|
|
метоксид- |
|
|
|||
|
|
|
|
|
|
|
|
|
ион |
|
|

1.11. Кислоты и основания. Теория Брёнстеда |
85 |
3. Введение электронодонорных заместителей дестабилизирует сопряженное основание и снижает силу кислоты.
|
Реакция |
pKa |
|
Реакция |
pKa |
|||||||||
CH3OH |
15,5 |
|
HCOOH |
3,75 |
||||||||||
CH3CH2OH |
15,9 |
|
CH3COOH |
4,76 |
||||||||||
|
|
|
|
1 |
|
1 |
|
|
||||||
|
CH3O > CH3CH2O |
|
|
O |
2 |
|
O |
2 |
|
|
||||
|
H C |
|
|
|
> CH3 C |
|
|
|
|
|
||||
|
снижение устойчивости |
1 |
|
|
1 |
|
|
|||||||
сопряженного основания |
|
O 2 |
|
O 2 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||
снижение устойчивости сопряженного основания
4. Введение электроноакцепторных заместителей стабилизирует сопряженное основание и повышает силу кислоты. Ниже на примере замещенных уксусных кислот показана стабилизация карбоксилат-ионов за счет индуктивного эффекта заместителя Х.
1 |
|
Х |
pKa |
Х |
pKa |
||||||
|
|
|
|
O |
2 |
|
H |
4,76 |
CN |
2,47 |
|
X |
|
CH2 |
|
C 1 |
|||||||
|
|
Cl |
2,85 |
NO2 |
1,68 |
||||||
|
|
|
|
O |
2 |
||||||
F2,57
CH3COOO < ClCH2COO
< ClCH2COO < FCH2COO
< FCH2COO < NCCH2COO
< NCCH2COO < O2NCH2COO
< O2NCH2COO
рост устойчивости сопряженного основания
5. Удаление по цепи электроноакцепторного заместителя от карбоксильной группы ведет к снижению силы кислоты.
Кислота |
pKa |
|
|
Кислота |
pKa |
||||||||
|
|
|
|
|
|
|
|
Cl |
|
||||
CH3CH2CH2 |
|
|
COOH |
4,88 |
|
CH3CHCH2 |
|
COOH |
4,06 |
||||
|
|
|
|
||||||||||
бутановая кислота |
|
3-хлорбутановая кислота |
|
||||||||||
CH3CH2CH |
|
COOH |
2,84 |
Cl |
|
CH2CH2CH2 |
|
COOH |
4,52 |
||||
|
|
|
|||||||||||
Cl |
|
4-хлорбутановая кислота |
|
||||||||||
2-хлорбутановая |
|
|
|
|
|
|
|
|
|
||||
кислота |
|
|
|
|
|
|
|
|
|
||||
Эти данные свидетельствуют о быстром затухании отрицательного индуктивного эффекта хлора с увеличением длины углеводородной цепи.
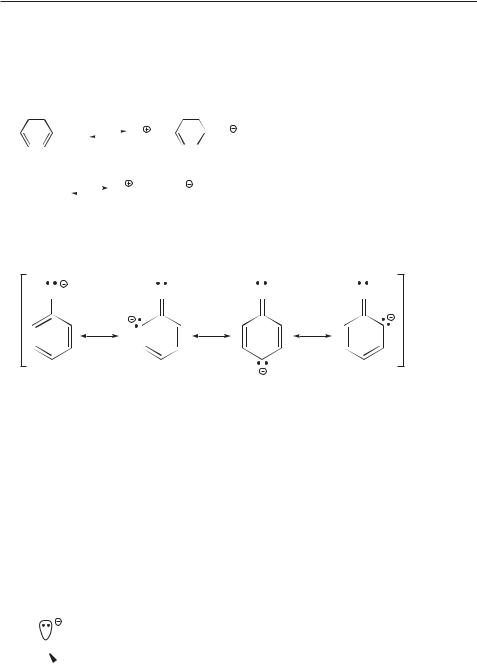
86Глава 1. Природа ковалентной связи. Электронные эффекты. Кислоты и основания
6.Еще один способ стабилизации сопряженного основания — резонансная стабилизация — можно видеть на примере значительно более высокой кислотности фенолов по сравнению со спиртами.
|
|
|
|
|
|
Реакция |
|
G°, кДж/моль |
pKa |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(ккал/моль) |
|
|
|
OH |
|
|
|
|
|
|
|
|
O |
34,8 (8,3) |
9,98 |
||
|
|
|
|
|
|
|
H + |
||||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|||||||||
|
фенол |
|
|
|
|
|
феноксид-ион |
|
|
||||||
CH3OH |
|
|
|
|
|
H + CH3O |
|
91,2 (21,8) |
15,5 |
||||||
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
||||||||||
метанол |
|
|
|
|
|
метоксид-ион |
|
|
|
||||||
Отрицательный заряд в феноксид-ионе резонансно делокализован с участием бензольного кольца.
 O
O O
O O
O O
O
феноксид-ион
Задача 1.4. Расположите в порядке возрастания кислотных свойств этанол, фенол, воду, нитроуксусную кислоту и уксусную кислоту. Приведите объяснение.
Особого рассмотрения заслуживают СН-кислоты, поскольку образующиеся при их диссоциации сопряженные основания — карбанионы — являются промежуточными частицами во многих органических реакциях.
Как уже отмечалось выше, СН-кислоты — наиболее слабые из кислот всех типов. Продуктом кислотной диссоциации углеводорода является карбанион — частица, в которой ключевым служит отрицательно заряженный атом углерода. В соответствии с теорией ОВЭП (см. разд. 1.4), метил-ани- он, например, представляет собой пирамиду, одну из вершин которой занимает НЭП:
H C
C

 H H
H H
Как и в ряду ОН-кислот, все факторы, способствующие делокализации НЭП карбаниона, будут повышать его устойчивость, а тем самым — и силу СН-кислоты.
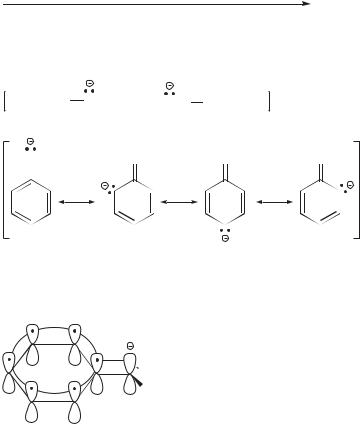
1.11. Кислоты и основания. Теория Брёнстеда |
87 |
Ниже перечислены значения pKa некоторых СН-кислот (ионизируемый фрагмент выделен полужирным шрифтом).
Кислота |
pKa |
Кислота |
pKa |
CH3–CH3 |
50 |
CH3COOC2H5 |
24 |
этан |
|
этилацетат |
|
CH4 |
48 |
CH3COCH3 |
20 |
метан |
|
ацетон |
|
C6H5CH3 |
43 |
CH3–NO2 |
10 |
толуол |
|
нитрометан |
|
HC≡CH |
25 |
CH2(COOCH3)2 |
9 |
ацетилен |
|
диметилмалонат |
|
В целом, ряд стабилизирующего влияния заместителей, соседних с карбанионным центром, совпадает с рядом увеличения их электроноакцепторных свойств.
CH3 < H < C6H5 < COOC2H5 < COCH2 < NO2
увеличение электроноакцепторности заместителя
Но и в случае карбанионов особенно эффективной оказывается резонансная стабилизация. Ниже показана резонансная стабилизация аллил- и бензил-анионов.
CH2 CH CH2
CH CH2 
 CH2 CH
CH2 CH CH2
CH2
|
аллил-анион |
|
|
CH2 |
CH2 |
CH2 |
CH2 |
бензил-анион
Эффект делокализации отрицательного заряда в бензил-анионе столь велик, что его геометрия приближается к плоской; при этом углеродный атом карбанионного центра меняет свою гибридизацию с sp3 на sp2.
 H
H
 C
C
H

88 Глава 1. Природа ковалентной связи. Электронные эффекты. Кислоты и основания
Напротив, электронодонорные заместители, повышающие электронную плотность на карбанионном центре, дестабилизируют карбанион и тем самым снижают кислотность соответствующего углеводорода.
CH3 > CH3—CH2 > (CH3)3C
снижение устойчивости карбаниона
Задача 1.5. Расположите частицы по возрастанию их устойчивости. Дайте объяснения.
a) CH3CH2 |
|
|
C |
|
CH3 |
CH2 |
|
|
|
CH |
|
|
C |
|
CH |
CH2 |
|
|
CH2 |
|
CH |
|
CH3 |
|||||||||
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
CH3 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
в) CH3 |
|
CH |
|
CH3 |
CH3 |
|
CH |
|
N |
CH3 |
|
|
CH2 |
|||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||||
O
 ОБРАТИТЕ ВНИМАНИЕ!
ОБРАТИТЕ ВНИМАНИЕ!
Карбанионом называют продукт кислотной диссоциации (отрыва протона) СН-кислоты — частицу, в которой ключевым является отрицательно заряженный атом углерода.
1.11.2.Основания Брёнстеда
Тот же самый подход — сравнение устойчивости исходного соединения и конечного продукта — объясняет закономерности в изменении силы органических оснований, в том числе оснований Брёнстеда.
Ниже приведены примеры нейтральных оснований В — органических веществ, способных присоединять протон за счет своей НЭП.
B + H2O |
|
|
|
BH + OH |
|
|
|||
|
|
|
||
основание |
|
сопряженная |
||
|
|
|
|
кислота |
Константу соответствующего равновесия обозначают как Kb:
Kb = |
[BH ] [ OH] |
, –lgKb = pKb . |
[B ] |
Чем больше значение Kb, тем выше сила основания.
Более универсальной оценкой силы органического основания, однако, является величина pKa его сопряженной кислоты — pKa (ВН ).
BH + H2O
+ H2O 
 B
B + H3O
+ H3O
Ka (BH ) = |
[B ] [H3O ] |
, |
–lgKa (BH ) = pKa (BH ). |
|
[BH ] |
||||
|
|
|
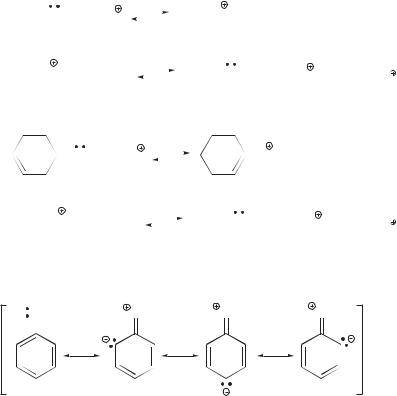
1.11. Кислоты и основания. Теория Брёнстеда |
89 |
Слабым основаниям соответствуют сильные сопряженные кислоты и наоборот: сильным основаниям соответствуют слабые сопряженные кислоты.
Типичными основаниями по Брёнстеду являются органические амины. При этом алифатические амины — значительно более сильные основания, нежели ароматические амины.
CH3 |
|
|
NH2 + H |
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
NH3 |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
метиламин |
|
|
|
|
|
|
|
метиламмоний-ион |
|
|
||||||||||||||||||||||||
CH |
|
|
|
|
NH |
+ H O |
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
NH |
|
+ H O |
(Ka (BH ) |
10,6) |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
3 |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
3 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
3 |
|
|
|||||||
метиламмоний- |
|
|
|
|
|
|
|
|
|
|
метиламин |
|
|
|
|
|||||||||||||||||||
|
|
ион |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
NH2 + H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH3 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
анилин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
анилиний-ион |
|
|
||||||||||||
C H |
|
|
|
NH |
+ H O |
|
|
|
|
|
|
|
|
|
|
C H |
|
|
|
NH |
+ H O |
(Ka (BH ) |
4,6) |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
6 |
5 |
|
3 |
2 |
|
|
|
6 |
|
5 |
|
|
|
2 |
3 |
|
|
|||||||||||||||||
анилиний-ион |
|
|
|
|
|
|
|
|
|
|
анилин |
|
|
|
|
|||||||||||||||||||
В молекуле анилина НЭП атома азота сопряжена с π-электронами бензольного кольца:
NH2 |
NH2 |
NH2 |
NH2 |
Этот эффект снижает свободную энергию молекулы анилина, повышает тем самым силу его сопряженной кислоты и соответственно снижает основность анилина по сравнению с метиламином.
В молекуле метиламина НЭП полностью локализована на атоме азота. Этот факт ведет к росту свободной энергии молекулы метиламина, снижает силу его сопряженной кислоты и повышает основность метиламина по сравнению с анилином.
1.11.3.Термодинамический контроль органической реакции
Изучение кислотно-основных реакций дает возможность ввести понятие
термодинамический контроль органической реакции: конечный состав про-
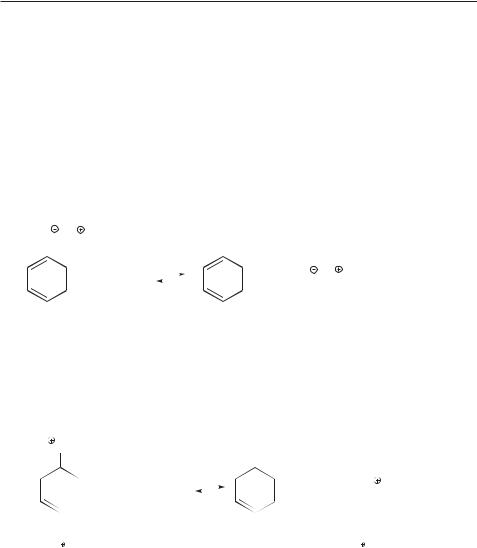
90 Глава 1. Природа ковалентной связи. Электронные эффекты. Кислоты и основания
дуктов обратимой органической реакции определяется разностью свободных энергий образующихся и исходных веществ:
G° = ΣG°прод – ΣG°исх = –2,303 RT pKa.
Чем выше G°, тем менее диссоциирована (т. е. тем слабее) кислота. Чем ниже G°, тем более диссоциирована (т. е. тем сильнее) кислота.
Рассмотрим два примера применения термодинамического контроля. При этом будем помнить, что кислотно-основные равновесия всегда сдвинуты в сторону диссоциированных форм более сильных кислот.
Пример 1.
O Na |
|
|
|
|
OH |
|
||
|
|
+ CH3OH |
|
|
|
|
|
+ CH3O Na |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
феноксид |
метанол |
|
|
|
фенол |
метоксид |
||
натрия |
pKa 15,5 |
|
|
|
pKa 9,98 |
натрия |
||
Поскольку феноксид-ион резонансно-стабилизирован, значение G° кислотной диссоциации для фенола значительно ниже, чем для метанола. Фенол является более сильной кислотой и поэтому указанное равновесие
сильно сдвинуто влево.
Пример 2.
NH3 |
|
|
NH2 |
||||
|
+ CH3NH2 |
|
|
|
|
|
+ CH3NH3 |
|
|
||||||
|
|
|
|
||||
|
|
|
|||||
анилиний-ион метиламин |
|
|
анилин метиламмоний-ион |
||||
pKa (BH ) 4,6 |
|
|
|
|
pKa (BH ) 10,6 |
||
Сопряженная кислота анилина на 6 порядков сильнее сопряженной кислоты метиламина. В соответствии с этим указанное равновесие практически нацело сдвинуто вправо:
|
|
Ka(C H |
5 |
NH ) |
10–4,6 |
K |
|
6 |
3 |
|
|
равн |
= = = 106. |
||||
|
Ka(CH NH ) |
10–10,6 |
|||
|
|
||||
|
|
3 |
|
3 |
|
Значения основности органических соединений, относящихся к различным классам, перечислены в табл. 1.13.
