
Konspekty_Enzimologiya
.pdfКогда сделали такую структуру выяснилось, что карб-катиона там никакого нет, а конформация полукресло. Т.е. фермент стабилизировал продукт в той конформации, которая характерна для переходного состояния.
Дальше были получены косвенные доказательства. Когда имеем хорошие конкурентные ингибиторы, они как правило отличаются от S тем, что они по структуре ближе в переходном состоянии.
Иммунология: моноклональные антитела. Отбирается определенный клон клеток, продуцирующих определенные антитела со строгой специфичностью, далее - сливаем с раковой клеткой, образуется определенный эпитоп.
Иммунизация животных, лимфоциты, антиген - к матрице, нужные клетки застревают на колонке. Вещество, имитирующее переходное состояние реакции для определенного S (это была протеазная р-ция). Взяли S, имитирующий переходное состояние пептидной связи, когда требуется уплощенная структура. Иммунизировали мышку, пришили к колонке, лимфоциты, антитела – получили антитела, имеющие сродство к переходному сотоянию, работающие как протеазы. Т.е получили антитела, которые являются ферментами - абзимы.
Стабилизация переходного состояния приводит к тому что субстрат, связываясь, меняет свою конформацию и дальше он вынужден превращаться, у него нет возможности существовать долго в таком состоянии.
15.12.15 Регуляция работы ферментов, локализация ферментов.
Регуляция деятельности ферментов Суммируем, т.к. мимоходом затрагивали этот вопрос.
Рассмотрим на двух уровнях. Смысловая предпосылка: Для чего нужна регуляция работы ф-нта?
1)в клетке и вокруг нее условия меняются. В зависимости от того, в каких условиях находится клетка, у нее есть те или иные исходные вещества для метаболизма, есть недостающие вещ-ва, в одних случаях нужен один ферментативный аппарат, в других
– другой.
2)случай внутриклеточный, когда разница не в том что получает, а в том что должна выдавать. Метаболиты организма, вырабатываемые одними органами, потребляются другими. Это могут оказаться секретируемые компоненты. И вещ-ва отбросы, которые не нужны, но т.о. клетка выводит их, т.е нейтрализует вещ-ва.
Эти процессы тоже не постоянны, и активность образованных вещ-в должна быть такой, которая нужна клетке в конкретный момент.
Формируется 2 временных тренда (направления регуляции):
1- регуляция медленная, расчитанная на долгое поддержание полученного состояния
2- быстрая регуляция, как бы подстройка активности ф-нта под быстро меняющиеся условия.
Эти 2 направления не являются строго изолироваными друг от друга. Мб как долгосрочная так и краткосрочная регуляция одним и тем же, точнее как непрерывный временной ряд изменения активности, т.е. можно изменять активность за доли секунды, можно изменить на всю оставшуюся жизнь клетки, а можно изменить на ближайшие 2 ч, а потом вернуться назад.
Активность фермента регулируется несколькими уровнями: 1. образование/распад фермента.
●Образование белка
Вкл/выкл тех или иных генов при помощи тех или иных механизмов тоже поразному. У бактерий – на уровне транскрипции и эта регуляция довольно быстрая, в целом это следствие общей тактики бактериальной клетки при изменении условий. Т.е. имеется ген, кодирующий фермент, этот фермент клетке не нужен, клетка выключит его моментально, ф-нт какое-то время (синезированный) еще будет работать, но постепенно в силу быстрого обмена белков, он деградирует и данная активность в клетке исчезнет. С другой стороны, если понадобится какоето вещ-во, которого нет в среде, то ферменты для его синтеза начнут образовываться, сначала транскрипция, потом трансляция, до завершения этого процесса уже начинается синтез белков на матрице, и т.о. в течение если не секунд, то минут клетка успевает отреагировать.
С эукариотами сложнее, здесь имеет место дифференцировка. Дифференцировка клеток - это переключение белкового синтеза, и в этом случае меняется и ферментный спектр. Т.е. в одних типах клеток образуется один набор ф-нтов, в других другой и это определяется регуляцией на уровне образования. Такого рода переключение очень часто необратимо. В процессе дифф-ки в клетке выключаются гены тех или иных ферментов и больше никогда не включаются. Если говорить об уровне регуляции ф-нта, то транскрипция в эукариотах не играет столь важной роли, транскрипция будет связана именно с дифференцировкой, а быстрая регуляция осущ-ся на уровне трансляции.
●Распад белка
Существует несколько механизмов выведения фермента из активного состояния, в итоге все кончается протеолизом. Сложно расщеплять одни белки и не расщеплять другие, Есть определенные методы
– убиквитины;
-некоторые особенности в последовательности;
-некоторые белки, узнающие ф-нт и приводящие к его разрушению(т.н. антизимы).
Целенаправленно деградируют только те белки, которые должны быть убраны. Если этот белок убран из клетки, он может появиться опять, если есть ген и если он не выключен, т.е. это обратимая регуляция, как правило, не связанная с тем что выключается ингибитор.
2)Ковалентная модификация ферментов. Для этого необходимы специфические ферменты, которые должны быть тоже регулируемы в свою очередь. Существуют разные способы. Наиболее часто – фосфорилирование, CH3- и аденилирование.
Происходит изменение конформации белка и он может переходить в актив/неактив форму. Т.е. в одних случаях модификация является активатором пр-сса, в других - ингибитором. Чаще это обратим модифик. Существует фермент, снимающий эту модификацию, и как следствие этого восстанавливается исходная форма фермента.
Фосфорилирилировние по остаткам аминок-т Ser, Thr, Tyr. Ф-лироватся должны не все, а строго определенные остатки. Это опредеделяется отчасти последовательностью аминокислот в цепи, отчасти конформацией белка. Разные белки должны модифиц-ся в разных условиях, а это возможно только имея достаточно разнообразный и регулируемый аппарат модификации. Поэтому в
клетках эукариот очень много таких ферментов. Это протеинкиназы. В геноме порядка 300 видов протеинкиназ закодировано, ~200 выделено там есть неточности (по последовательности протеинкиназы, но что делают, не ясно). Протеинкиназы тоже регулируемые ф-нты но регуляция др способом – путем присоединения молекулярных факторов в ответ на внеш или внутр изменения. Химич модификация осуществляется через регулируемый каскад, требует времени: быстро, но не моментально. Возникает проблема: фермент имеет 2 состояния активности – вкл/выкл. Так легко включать, но так сложно осуществить плавную подстройку, когда нам нужно изменить активность немного, чтобы поддерживать на постоянном уровне конц того или иного метаболита. В этом случае используются нековалентные изменения структуры ф-нта присоеди нием НМ лигандов. Присоед по разным участкам ф-нтов. Очень часто регуляторами ф- нтов явл обратим инг-торы. Кот в свою оч связ-ся в АЦ вызыв конкур инг-рование а могут в др местах. Инг-ние связано не с доступностью АЦ а с самой его стр-рой. Такого рода присоед осущ по строго опред учатскам и поск-ку этот участок не совпад с АЦ – аллостерич участок – участок другого пр-ва.
Когда присоед такой лиганд, это приводит к изм в стр-ре ф-нта в месте присоединения и дальше это охватывает всю молекулу. Это незначительная перестройка, она осущ практич моментально. Акт-ть ф-нта мб усилена или подавлена.
Имеем возможность за счет установления неких равновесий делать плавную регуляцию. Поск-ку регуляторы специально вырабатываемые – они появл в малых кол-вах. Возникает некое равновесие когда часть связ часть свободно. И в зависимости от кол-ва регулятора и кол-ва ф-нта свободная часть мб представлена большим или меньшим кол-вом активных мол-л, т.е. не происходит полного выкл до достат высоких уровней инг-ра, а на промежуточных уровнях можно плавно подгонять активность. Такого рода инг-ние мб неполным по мех-му и за счет инг-ра можем снизить акт-ть ф-нта до некого уровня. Очень часто ф-нты особенно те что занимают некие угловые позиции регулир-ся нес-кими аллостерич регуляторами. Эффект полного инг-рования достигается только при большом колве инг-щих мол-л.
Аллостерич центр может находиться не только непосредствено на белке, т.е. на глобуле, на кот осущ аллостерич регуляция, а часто связан с 4-тич стр-рой когда 1 или нес-ко субъед ответственны за акт-ть другая – за регуляцию. Пример – аспартаткарбомоилтрансфераза – первый ф-нт синтеза пиримидиновых нуклеотидов. Этот ф-нт присоед к Asp остаток от мол-лы
Эта гр отрывается и присоед к азоту. Остаток полуамида угольной к-ты карбомоил присутствуте в активированной форме за счет связи с фосфатом, Есвязи здесь больше чем в АТФ и перенос обеспечивает Еобраз связи. Получается мол-ла, за счет которой образуется при циклизации пиримидиновое кольцо карбонил удаляется. Смысл –нарастить цепочку для дальнейшего синтеза кольца. Этот ф-нт первый, а заканчивает самой дальней точкой – ЦТФ. Это и регулятор для этого ф- нта. Ф-нт из 2х субъед, одна каталитич, другая – регуляторная. В 4-чн стрре это как 2 шестигранника, лежащих один на одном и каждый его регуляторная субъед связана с каталитической. Если относительно мягко подействовать на ф-нт мочевиной, т.е. разобрать ф-нт на субъед, то каталитическая сохранит свою активность. При этом она будет проявлять обычную ф-нтатив кинетику и ее акт-ть не будет зависеть от доп ф-ров. 2-ая не обладает каталит акт-тью, но зато имеет
центр связ нуклеотидов. Он один и в завис от того что там связ-ся происходят разные перестройки. Может связ-ся ЦТФ или АТФ. Если ЦТФ – сильное увел Км у катал субъед для Asp и вел-на выходит за те рамки конц которые нормальны для клетки, т.е. скорость падает сильно при тех конц Asp которые мы видим в кл. Если с АТФ – такого изм не происх. Дальше – конкуренция. Если в кл много АТФ и мало ЦТФ, то ф-нт связ-ся с АТФ и продолжает работать. Если наоборот – ф-нт связ-ся с ЦТФ и активность практич падает до нуля. В клетке скорее всего будет промежуточное состояние. ЦТФ/АТФ - регулятор.
Если ЦТФ много – она клетке не нужна. Почему ЦТФ ингибирует понятно. При чем здесь АТФ? Ведь в реакции она не участвует? Ответ –она помогает поддерживать баланс пуринов и пиримидинов. Если пуринов в кл много надо с-зир пиримидины, раз много пуринов – много АТФ, значит ф-нт связан с АТФ.
Среди вещ-в которые, связываясь с ф-нтом, могут менять его активность не обязательно должны присутствовать какие-то спец вещ-ва. Нек-рые ф-нты регулир-ся просто за счет уровня субстрата. Здесь мы имеем дело с ф-нтами обладающими 4чн структурой и имеющими нес-ко АЦ за счет этого. При взаимод отдельных глобул м/у собой они начинают влиять др на др, т.е. связывание белк глоубл приводит к тому что, конформация меняется и связывание субстрата с одним АЦ влияет на конформ соседних групп. Рассказывали на примере гемоглобина про кооперативность связывания Hb и O2
Есть 2 конформационных состояния – связанное и свободное у глобулы. Если она единична – ее личное дело, если объединена то она начинает взаимод с соседями и ее конф перестройка затрагивает сосед моллы и либо они ей мешают, либо она им помогает.
Если тетрамеры, а одна из единиц меняет конформацию, то ей либо будет трудно связать, потому что ее будут держать другие субъединицы, но связавшись, она проведет перестройку и перетянет соседнюю субъединицу. А здесь уже будет та конформация, которая соответствует конформации уже связавшейся с субстатом субъединицы. Субстрат свяжется легче, К связывания меньше и реакции пойдут быстрее. Далее изменяются остальные, т.е. у нас первая мол-ла S присоед трудно, тк надо не только присоединить, но и вызвать конформ переходы в соседях. Вторая присоед проще, 3ь совсем просто, о 4-ой и говорить нечего. Отсюда интересная кривая насыщения ( “S” -образная: % насыщения и pO2, т.е. субстрат). Аналогично при связывании сусбстрата: если S связывается с олигомерным ф- нтом с 1 субъед, это может повлечь перестройку соседних и облегчить связывание субстрата. Будет такая же “S” –образная кривая, только будет не % насыщения и давления, а конц S по этой оси и акт-ть ф-нта по этой. Эти ур-ния не опис ур-нием ММ, для этого есть ур-ние Хилла.
Если в клетке уровень S низкий, то акт-ть ф-нта низкая, субстрат перерабатывается в весьма незначительной степени - скорость переработки S-та маленькая. Всегда есть некий источник поступления и эта низк конц будет поддерж, а чаще всего акт-ть ф-нта будет такой низкой, что она начнет нарастать. Если конц S будет высокой, акт-ть ф-нта макс-льна и она будет перерабат субстрат со скоростями, превышающими ск-ть его поступления. В конечном счете, конц S будет колебаться в пределе середины “S” –образной кривой (на подъеме). При повыш конц S ф-нт активируется и его убирает, при понижении ф-нт
замедляется, и S накапливается. Т.о. удается поддерж нек-рые значения опред веществ.
Пример – цитратдегидрогеназа в ЦТК работает по такому принципу.
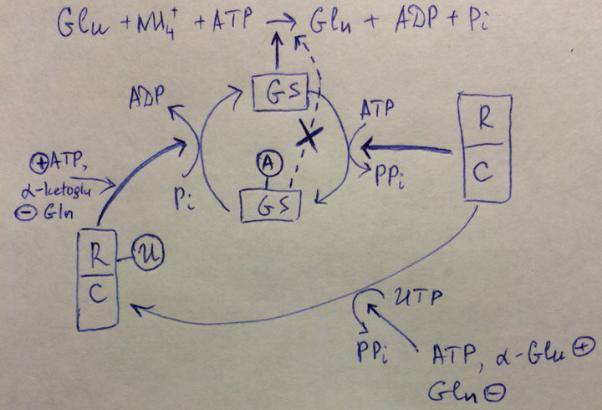
Могут реализовываться нес-ко путей регуляции одного и того же ф-нта, в случае если ф-нт связан с узловыми точками, которые влияют на нес-ко метаболич путей. Ф-нты должны регулироваться так, чтобы появлялись все необходимые для осуществления тех реакций вещества и т.о. появляются нес-ко центров и мех-мов регуляции на ф-нте. Возникают сложные случаи, когда один и тот же ф-нт активируется одними вещ-вами, ингибируется другими, ковалентно модифицир под действием третьих – короче очень сложная и тонкая регуляция. Пример: глутаминсинтетаза – вход для азота в орг соед, поэтому он регулируется уровнем и аминок-т нес-ких, и азот оснований, и аминосахаров.
Глутаминсинтетаза катализирует р-цию Glu + NH4+ + ATP -> Gln + ADP +Pi
На первом этапе происходит активация удаленного карбоксила глутаминовой к-ты за счет ее фосфорилир и образования смешанного ангидрида и затем фосфатная гр вытесняется ионом NH4+ и получаем амид, служащий дальше субстратом в большом кол-ве реакций: с-за аминок, азотист осн-ний. Главная – когда амидный азот переносится на карбонил альфакетоглутаровой кислоты. Образуется 2 молекулы Gln, одна идет снова в реакцию, вторая – в метаболизм являясь там тоже донором аминных групп, в т.ч. в реакциях переаминирования. Т.о., почти весь азот, который мы видим в орг соед, проходит через этот этап.
E. coli (у растений еще сложнее, тк светозависимая регуляция есть)
Есть целый ряд активаторов и инг-ров осущ-щих плавную подстройку, те могут частично инг-ровать акт-ть ф-нта. Существует еще один способ регуляции акт-ти ф-нта за счет концентрации 2х валентных катионов (Mg) которые стабилизир его 4чн стр-ру. Построен из одинаковых субъединиц (12 шт). Имеется ряд инг-ров, кот действуют по разным мех-мам.
1- инг-рование аминок-тами (8 шт) – регуляторы действуют в виде конкурентов глутаминовой к-ты за связывание.
2 – инг-рование нуклеотидами. Есть 2 нуклеотида – ЦТФ конкурентным инг-ром, конкур с глут к-той. Хотя в ф-нте есть центр связывания с АТФ, куда ЦТФ в принципе мог бы встраиваться, но конкурирует он все же с Glu. АМФ второй – почему часто так регулятор? – он сильнее регулирует, его конц в клетке очень низкая; небольшой расход АТФ путем гидролиза приводит к заметному увел АМФ потому что за счет действия соответ-щей киназы за счет 2 м-л АТФ образуется АМФ и АДФ. Если АТФ и АДФ изменения измеряются в процентах, то АМФ изм-ся в разы.
АМФ – хороший индикатор недостатка Е в клетке и расхода Е в клетке. Логично предположить, что АМФ конкурирует с АТФ в центре связывания для него. Однако для АМФ есть свой аллостерический центр связывания.
АМФ – аллостерич инг-р который сниж акт-ть в общем не конкурируя с др нуклеотидами.
Еще одним регуляторов явл карбомоилфосфат – узловое вещ-во, кот сл донором карбомоила, содерж аминную гр, в с-зе целого ряда соед: пиримидинов, аминок-т, то это достат важное соед, уровень в кл весьма и весьма низок. Как только азота
становится много, уровень карбомоила сразу повышается и может исп-ся как соотв аллостерич инг-тор.
Инг-тор – глюкозамин который явл полномочным представителем аминосахаров. Глюкозамин – конкурентный инг-тор иона NH4+.
Это то что касается плавной подстройки. Большинство инг-ров не в состоянии полностью заинг-ровать ф-нт, только на 10-15% и только если все аминок-ты повлияют, то тогда будет кумулятивный эффект инг-ния – когда по мере накопления инг-щих регуляторов (пр-ктов) постепенно снижается акт-т. Если гистидина не хватает, а остальные в избытке – ф-нт все равно будет работать, т.к. те 5-10% влияния His не хватает для полного выключения.
Когда надо полн-тью надо заингибировать – ковалентная модификация Аденилирование. Осущ специфич ф-нтом, кот переносит аденильный ост из АТФ на ф-нт и последний теряет активность.
Глутамин синтетаза катализир р-цию, за счет присоед остатка она перех в аденилир форму кот осущ р-цию не может. Отщепл пирофосфат.
Такого рода модифик имеет смысл только в случае если она обратима. В противном случае разрушить фермент будет выгоднее, освободятся аминок-ты. Поэтому есть обратный ф-нт, который осущ отщ аденильного остатка причем не совсем тривиальным способом (не экзотический тк часто) – фосфоролиз аденильного остатка. Неорг фосфат и обр-ся АТФ. НО! Эти 2 пр-сса должны быть скоординированы и осущ-ся это не совсем тривиальным способом: оба этих пр-сса осущ один и тот же белок, который в одном сл работает как аденилилтрансфераза, 2 субъед, регулятор и каталитич. Но он сам может подверг модифик и уже в модифиц виде осущ др пр-сс. Модифик осуществляется в присоединении тоже
нуклеотида, только не аденилового, а уредилового, присоед УМФ. УМФ присоед из УТФ. Есть некий ф-нт осущ переход в эту форму за счет того что из УТФ и пирофосфат выходит. Этот пр-сс катализир-ся уридилтрансфераза. И этот ф-нт регулир-ся компонентами исходной реакции. Т.е. АТФ и альфакетоглутарат – положительные эффекторы, а Gln отрицательным.
Когда Gln накапливается много, уредилирование прекращ, ф-нт вот в этом состоянии, Gln-синтетаза аденилируется и не работает.
(Если Gln много, это ингибирует реакцию, ф-нт не модифицированный, он осущ аденилирование Gln-синтетазы и она переходит в неактивную форму).
Если много АТФ и альфакетоглутарата, у нас все наоборот: происходит интенсивное уредилирование, ф-нт деаденилир-ся и работать по с-зу глутамина. Почему выгодно туда-сюда гонять – ф-нт дает метаболит, нужный в большом колве – ф-нта нужно много, с-зир и расщеплять его долго. А модифицир удобно, модифицирующая единица очень мала и если ее разрушить ничего страшного не произойдет. Достаточно разрушить только регуляторную субъединицу чтобы дальше восстановить реакцию.
Переход из неакт в акт стимулир-ся при наличии субстратов и подавл при изб прктов. Это помогает поддерж клетке пост кол-ва метаболитов.
Регуляция гликогена в печени – надо посмотреть. Один ф-нт переключает свои активности.
Биологические аспекты энзимологии.
В разных кл разные наборы ф-нтов. Связано с тем, что а) существуют в разных исходных условиях б) в сл многоклеточных – выполн разные ф-ции
ЛактатДГ – катализатор одного из вариантов гликолитического расщепления. Мыш гликолиз или молочно-кисл брожение.
Восстановле на послед этапе пирувата за счет НАДН и обр лактата. Пируват весьма не полезное для клетки соединение и за счет стр-ры плохо из кл выводимое. Лактат менее ЭО выводится из кл легче и токсичность для кл ниже. Осущ ф-нтом но возникают разные ситуации с выведением этого вещ-ва. В мышце и в сердце это разные ф-нты. Зависимость от компонентов р-ций. Мышцы после работы в анаэроб сост превращ, накапл пируват, его надо превращать в лактат и реакция организована так что Км для пирувата намного ниже, для лактата выше, р- ция идет в сторону образ-ния лактата и он потом выводится. В сердце другая ситуация:т сердце работает по аэробной схеме, пируват надо в мтх загонять и дальше их расщеплять и даже если из окр среды лактат просач в кл от него надо избавл. Км здесь наоборот, для пирувата выше.
Оказалось, что сущ 2 разных по св-вам ф-нта и они имеют 4чн стр-ру, альфа4, т.е. явл тетрамерами, и в каждом случае это разный белок т.е. разная первич стр-ра. Обознач как сердечная и мышечная.
H4 – сердечная, M4 - мышечная. Но гликолиз-то во всех тканях! И когда начали выделять из др тканей, напр из печени, выяснилось что есть и та и др формы, и еще некоторые. Метод электрофореза сыграл роль.
Из сердца одна полоса, из мышцы – другая, из печени – 5 полос, в т.ч. те две, причем они как крайние. Помимо них еще есть Н3М, Н2М2 и НМ3.
У нас в геноме есть 2 гена лактатДГ кодирующие каждый свою полипептид цепь. В мышцах – только один такой ген и обр только 1 тип субъединиц и все они объед в

тетрамер. В сердце – другой ген и собир другой тетрамер. [наличие сердечной ЛДГ в крови это типа один из маркеров инфаркта] В ост тканях – оба гена работают с разной интенсивностью и получаются разные формы в разных соотношениях. Одна форма ведет лучше в одну сторону, другая в другую. Это не значит, что они сдвигают равновесие. Речь идет о неравновесных процессах, поск-ку лактат все время выводится а пируват образуется и наоборот.
Карбангидраза – ф-нт расщепл угольную к-ту. Одни из форм работают в легких, где надо быстро расщепить бикарбонат до выделени СО2 чтобы он успел уйти поск-ку кровь двигается по капиллярам очень быстро, равновесие в распаде угольной к-ты без катализа установиться не успевает. До полного удаления надо катализировать. В тканях другая ситуация – надо быстро перевести СО2 в хорошую форму бикарбоната и хотя есть некое равновесие р-ции но направление явл-ся независящ от тд, а завис от концентрации. Достигается сдвиг за счет Км отдельных компонентов.
Сущ-вуют случаи, когда изоформы хорошо связаны м/у собой. Изоформы – различные виды одного и того же ф-нта, похожие др на др по пр-венной стр-ре и родственные по первичной. Но изоформами часто называют другие вещи: Различ формы РНК полимераз эук. 1-ая работает с рб генами, 2 – гены иРНК и мяРНК, 3 - тРНК, 5S-РНК и нек-рые ост малые РНК. Все эти формы РНКполимераз имеют абсолют разную субъединич стр-ру. Общий план похож, есть 2 большие субъед осущ главные пр-ссы. А дальше 1,5-2 десятка разнообразных
малых субъед. Да и большие субъед разные на уровне родства с бакт ф-нтом нахся. Т.е. они разошлись млрд-ы лет назад. Т.е. по-хорошему это разные уже белки. Но поск-ку они осущ одну и ту же р-цию, формально это изоформы. Но как термин изоформы к ним желательно не применять (и правильно, поск-ку это не формы, а разные в принципе ф-нты).
Иногда модифицированные формы одного и того же фермента тоже называют изоферментами.
Локализация ферментов.
Связано с биологическими ф-циями и особенностями Внутри- и внеклеточные. Изначально все внутри образуются, но потом нек-рые
траспортируются в окр среду и их задача как пр-ло -расщепление сложных полимеров, чтобы клетка мономеры (простые вещ-ва) поглотила. Обобщенно – пищеварение (как у грибов). Это мб модифик собств веществ, выделяемых клеткой на поверхности (муреиновая кл стенка у бакт например). Внеклеточные белки – 1. Выдел собственно во внеш среду
2. Многоклет орг-мов, кот выдел во внутр среду орг-ма (кровь, лимфа, межклет жид-сть)
3. ф-нты клет стенок, гликокаликса, т.е. те, кот находятся в адсорбированном состоянии. Часто такие ф-нты могут отделяться – тонкий кишечник. Большая масса ф-нтов кот выдел-ся как р-римые оказываются в основном связанными с поверхностями эпит клеток, т.е. расщепление в непосредственной близости от места, где в дальнейшем осущ транспорт пр-кта. Локальное концентрирование.
4. Не связ с клет стенкой и нах в периплазм пр-ве (м/у КС и
клет мембраной)
Для всех этих ф-нтов возникает внешняя угроза, тк вне клетки и химич состав среды может меняться, и могут возникнуть различ агрессив мол-лы, норовящие их расщепить или изменить. Поэтому многие из этих ф-нтов имеют прочную пространственую стр-ру, сшитую S-S мостиками.
Внутриклет ф-нты: |
1 |
– в цитоплазме (гликолиз) |
|
2 |
– в опред органеллах (ЦТК – в мтх) |
Т.о., в опред компартментах разные пр-ссы. И накапливаются разные компоненты. Разделение ф-нтов обмена ЖК приводит к тому что в цитопл практически не происх их расщепления, цитоплазм ф-нты доводят только до гидролиза сл липидов, а сами ЖК, которые при этом образуются, могут активироваться и идти в с-з других сложных липидов. Для окисления их нужно перенести в мтх, что требует доп. переносчика (карнитина), не происх ненужного окисления, только тогда когда либо слишком большой избыток, либо когда синтетич дефицит.
Ф-нты лизосом, стр-ра диктует рН в кислой области, при нейтр рН не активна. Это своеобраз защита клетки от возможности ее расщепления. Ф-нт в обл рН 4-5 активен, в цитоплазматическом рН не работает. Но отдельные проявл активности есть все же. Есть пр-ссы которые кл не может допустить даже в ничтожно мал колве – расщепление белков и НК. Многие белки, которые работают на расщепление, в кл образ-ся в виде неакт предшественников. В нужный момент они активируются и выделяются. Это касается лизосомных и пищеварит ф-нтов.
Пр-сс пищеварения, надо выделять пищеварит ф-нты. Секреция жел сока, белкипредшественники были синтезированы до попадания пищи. Активир предшественники после поступления субстрата.
