
Донсков С.И., Мороков В.А. Группы крови человека. Руководство по иммуносерологии
.pdf225.Tegoli J., Cortez M., Jensen L., Marsh W.L. A new antibody, anti-ILe bH, specific for a determinant formed by the combined action of the I, Le, Se, and H gene products // Vox Sang. – 1971. – V. 21. – P. 397–404.
226.Teneberg S., Miller-Podraza H., Lampert H. C. J. et al. Carbohydrate binding specificity of the neutrophil-activating protein of Helicobacter pylori // J. Biol. Chem. – 1997. –V. 272. –
P.19067–19071.
227.Tetteroo P.A.T., de Heij H.T., van den Eijnden D.H. et al.AGDP-fucose:[Galβ1→4]GlcNAc
α1→3-fucosyltransferase activity is correlated with the presence of human chromosome 11 and the expression of the Le x, Le y, and sialyl-Le x antigens in human-mouse cell hybrids // J. Biol. Chem. – 1987. –V. 262. – P. 15984–15989.
228.Tilley C.A., Crookston M.C., Brown B.L., Wherrett J.R. A and B and A1Le b substances in glycosphingolipidfractionsofhumanserum//VoxSang.–1975.–V.28.–P.25–33.
229.Ueyama R. Studien über die neuen Typensubstanzen in Sekreten // Jap. J. Med. Sci., VII Social. Med. Hyg. – 1940. – V. 3. – P. 23–25.
230.Ueyama R. Üeber das neue Antigen ‘T’ entdeckt im menschlichen Speichel des Nichtausscheiders // Hanzaigaku-Zasshi. – 1939. – V.13. – S. 51–64 (japan).
231.Varki A. Selectin ligands // Proc. Nat.Acad. Sci. USA. – 1994. – V. 91. – P. 7390–7397.
232.Vos G.H., Comley P. Red cell saliva studies for the evaluation of ABH and Lewis factors among the Caucasians and Aboriginal populations of Westem Australia // Acta Genet. – 1967. – V. 17. – P. 495–510.
233.Waheed A., Kennedy M.S., Gerhan S. Transfusion significance of Lewis system antibodies: Report a nationwide survey // Transfusion. – 1981. – V. 21. – P. 542–545.
234.Watkins W.M. Biochemistry and genetics of the ABO, Lewis and P blood group systems: Advances in Human Genetics. – 1980. – V. 10. – P. 1–136.
235.Wiener A.S., Gordon E.B., Moor-Jankowski J. The Lewis blood groups in man.Areview with supportingdataonnon-humanprimates//J.Forens.Med.–1964.–V.11.–P.67–83.
236.Wu J.T., Olson J., Walker K. Tumor markers CA 19-9 and CA 195 are also useful markers for cystic fibrosis // J. Clin. Lab.Anal. – 1992. – V. 6. – P. 151–161.
237.Wyatt J.I., Dixon M.F. Chronic gastritis – a pathogenetic approach // J. Path. – 1988. –
V.154. – P. 113–124.
238.Yamamoto S. Inhibitory activities of substances present in plant seeds and fruits against anti-Lewis agglutinins // J. Immunogenet. – 1982. – V. 9. – P. 137–141.
239.Yazawa S., Furukawa K. α-L-Fucosyltransferases related to biosynthesis of blood group substances in human saliva // J. Immunogenet. – 1980. – V. 7. – P. 137–148.
240.Young W.W., Johnson H.S., Tamura Y. et al. Characterization of monoclonal antibodies specific for the Lewis a human blood group determinant // J. Biol. Chem. – 1983. – V. 258. –
P.4890–4894.
241.Yuen C.T., Bezouska K., O’Brien J. et al. Sulfated blood group Lewis a. A superior oligosaccharide ligand for human E-selectin // J. Biol. Chem. – 1994. – V. 269. –
P.595–1598.
601

Глава 10.
Система Duffy
Основные антигены системы Duffy (Даффи) – Fy a и Fy b – являются продуктами аллельных генов Fy a и Fy b, которые образуют 3 основных фенотипа у лиц белой расы: Fy(a +b −), Fy(a +b + ) и Fy(a −b + ). Еще 1 аллель (Fy x) кодирует син-
тез слабовыраженного антигена Fy b. Большинство лиц черной расы имеют фенотип Fy(a −b −). Указанный нулевой фенотип встречается крайне редко среди людей других рас.
Антигены Fy3, Fy5 и Fy6 имеют высокую частоту среди европеоидов и монголоидов, однако сравнительно редко их выявляют среди негроидов. Антигены Fy3 и Fy6 присутствуют на всех эритроцитах, за исключением Fy(a −b −). Фактор Fy6 определяют с помощью мышиных моноклональных антител. Поликлональные аллогенные антитела к этому антигену не найдены. Антиген Fy5 присутствует одновременно с Fy3. Исключение составляют эритроциты Rhnull, на которых антиген Fy3 имеется, а антиген Fy5 отсутствует (табл. 10.1).
Таблица 10.1
Антигены системы Duffy
Обозначение |
Частота (%) среди |
Комментарий |
|||
традицион- |
IBST |
европеоидов |
негроидов |
||
|
|||||
ное |
|
|
|
|
|
Fy a |
FY1 |
61–68 |
13 |
Антитетичен Fy b(FY2), Gly42 |
|
Fy b |
FY2 |
80 |
23 |
Антитетичен Fy a(FY1),Asp42 |
|
Fy3 |
FY3 |
100 |
45 |
Отсутствует у лиц Fy(a −b −) |
|
Fy4 |
FY4 |
< 1 |
> 99 |
Возможно антитетичен Fy3 |
|
Fy5 |
FY5 |
100 |
45 |
Отсутствует у лиц Rhnull |
|
Fy6 |
FY6 |
100 |
45 |
Близок Fy3, распознается МКА |
|
Антигены системы Duffy располагаются на гликопротеинах с мол. массой от 35 до 50 кДа, которые выполняют функцию хемокиновых рецепторов, относящихся к G-ассоциированным белкам. Помимо эритроцитов эти гликопротеины присутствуютнаэндотелиивенуликлеткахнекоторыхорганов.АнтигенныеразличияFy a / Fy b обусловленыаминокислотнойзаменойGly42AspвгликопротеинеFy.
Возникновение фенотипа Fy(a −b −) у негроидов связано с гомозиготностью по молчащему гену Fy – мутации, препятствующей синтезу Duffy-гликопротеина на эритроцитах, но не на других клетках организма.
602
Индивиды Fy(a −b −) устойчивы к инвазии Plasmodium vivax и реже болеют малярией.
ГенныйлокусFY картированнадлинномплечехромосомы1впозиции1q21–q25.
Антитела анти-Fya и анти-Fyb
Первое сообщение о выявлении антител анти-Fy a у мужчины по фамилии Duffy появилось в 1950 г. (Cutbush и соавт. [40, 41]). В том же году были описаны 3 других образца антител указанной специфичности (Ikin и соавт. [74], Rosenfield и соавт. [142], van Loghem и соавт. [166]).
Mollison и соавт. [113] подсчитали, что антитела анти-Fy a встречаются в 3 раза реже по сравнению с анти-K-антителами.
В соответствии с расчетами Marsh [101] иммуногенность фактора Fy a в 40 раз ниже, чем KEL1.
По данным нескольких исследовательских центров США (Baldwin и соавт. [16], Beattie [18], Issitt [75], Mollison и соавт. [113]), фактор Fy a проявляет боль-
шую иммуногенность среди европеоидов. По отношению к негроидам он менее иммуногенен, хотя в одной из публикаций это оспаривается. Sosler и соавт. [150] не нашли различий в частоте анти-Fy a-антител у представителей разных рас.
Несмотря на невысокую встречаемость антигена Fy a у негроидов, только 11– 21 % образцов антител выявлено у лиц указанной расы. В большинстве случаев сенсибилизированными к фактору Fy a (в 79–89 % случаев) были европеоиды (Issitt,Anstee [76]). У лиц фенотипа Fy(a −b −) появление антител анти-Fy a часто предшествовало последующему образованию анти-Fy3 (Kosinski и соавт. [85], Molthan, Crawford [114], Oberdorfer и соавт. [126], Vengelen-Tyler [168]).
Образование антител анти-Fy a в некоторых случаях было стимулировано беременностями,однаковбольшинствеслучаевэтиантителаобразуютсяврезультате гемотрансфузий. Описаны также антитела анти-Fy a естественного происхождения, хотя последние бывают крайне редко (Algora и соавт. [11], Rosenfield и соавт. [142]). Антитела анти-Fy a могут присутствовать в качестве моноспецифических (В.А. Мороков [5]) и сопутствующих другим (М.А. Умнова и соавт. [7, 8]) Обычно они относятся к классу IgG, главным образом IgG1 (Hardman, Beck [65], Szymanski и соавт. [154]). Как правило, указанные антитела активны в непрямом антиглобулиновом тесте, однако описаны образцы, вызывавшие агглютинацию солевых суспензий эритроцитов, содержащих антиген Fy a
(М.А. Умнова и др. [8], Hardman, Beck [65], Szymanski и соавт. [154]). Примерно половина описанных образцов антител анти-Fy a обладала способностью связывать комплемент (Mollison и соавт. [113]). По мнению Issitt, некоторые образцы антител анти-Fy a как нельзя лучше подходят для контроля качества антиглобулиновых реагентов различных серий [76].
Антитела против антигена Fy a описаны как причина немедленных
(Rosenfield и соавт.[142]) и замедленных (Pineda и соавт. [133], Sosler и соавт. [150]) гемолитических трансфузионных реакций. В большинстве случаев они
603
протекали легко, однако имели место и тяжелые гемотрансфузионные ослож-
нения (Доссе [3], М.А. Умнова и др. [7, 8], В.А. Мороков [5], Hardmanm, Beck [65], Szymanski и соавт. [154]), в том числе с летальными исходами (Badakere, Bhatia 13], Freisleben [52]).
М.А. Умнова и др. [2, 7, 8] отметили особенности посттрансфузионных осложнений, вызванных антителами анти-Fy a, в частности низкая активность антител не соответствовала тяжести клинического течения посттрансфузионных реакций. Авторы полагают, что в первые дни после трансфузии крови, не совместимой по антигену Fy a, происходит адсорбция антител на перелитых эритроцитах, в связи с чем титр антител крайне низок или их не обнаруживают вовсе. Эти авторы наблюдали появление сопутствующих антител анти-Fy a у больных с гемотрансфузионными осложнениями по антигену D. На 14–21-й день после D-несовместимой гемотрансфузии в сыворотках крови некоторых реципиентов, помимо высокоактивных антител анти-D и анти-C, появлялись анти- Fy a-антитела, реагирующие в непрямой антиглобулиновой пробе в разведении 1 : 4 ± 1 : 8. У одной больной с гемотрансфузионным осложнением по антигену Fy a обнаружены необычные агглютинины, активные при температуре 22 оС [8]. Авторы рекомендовали воздерживаться от переливания эритроцитов в первые дни после трансфузионного осложнения, поскольку риск образования сопутствующих антител в этот период высок.
Гемолитическая посттрансфузионная реакция, обусловленная анти- Fy a-антителами, описана В.А. Мороковым [5] у онкологической больной, получившей несколько переливаний эритроцитов в связи с анемией. У больной отмечали внесосудистый гемолиз и гипербилирубинемию. Больная имела фенотип B(III)CCDeekkFy(a −). В первые дни после несовместимой трансфузии титр анти-Fy a-антител был 1 : 2 ± 1 : 4. Через 10 дней после трансфузии антитела реагировали в разведении 1 : 128 и проявляли феномен зоны. Подбор совместимых доноров для указанной больной представлял определенные трудности из-за высокой частоты антигена Fy a (до 90 %) среди жителей Республики Коми [4, 5].
Mollison и Cutbush [112] отметили, что эритроциты Fy(a + ) с радиоактивной меткой, введенные внутривенно лицам, содержащим анти-Fy a-антитела, исчезали из кровотока в течение 10 мин.
Gover и Morton [56] наблюдали гемолитическую реакцию у реципиента Fy(a +b + ),которомуперелилидонорскуюплазму,содержащуюантителаанти-Fy a.
Гемолитическая болезнь у новорожденных Fy(a +b + ), родившихся от сенсибилизированных женщин, чаще протекала легко, хотя имеются описания тяжелых случаев ГБН, обусловленных антителами анти-Fy a (Baker и со-
авт. [15], Goodrick и соавт. [55], Greenwalt и соавт. [57], Shah, Gilja [147], Weistein, Tayler [175]). По наблюдениям Goodrick и соавт. [55], у 3 из 69 жен-
щин с наличием антител анти-Fy a родились дети, страдавшие тяжелой анемической формой ГБН, двоим новорожденным потребовалось обменное переливание крови.
604
Несмотря на то что гибридомные технологии моноклональных антиэритроцитарных антител были разработаны еще в 1975 г. , гибридомы, синтезирующие антитела анти-Fy a, удалось получить лишь в 1999 г. Мышиные МКА анти-Fy a были получены Halverson и соавт. [64] культивированием лимфоцитов трансгенных мышей, которым предварительно был введен ген Fy b. Далее животных иммунизировали клетками эмбриональной линии почечных клеток человека, экспрессирующей антиген Fy a.
По расчетам Marsh [101], антитела анти-Fy b встречаются в 20 раз реже, чем антитела анти-Fy a. Их, как правило, обнаруживают одновременно с другими антителами, появившимися вследствие беременностей (Ikin и соавт. [73], Vetter, Wegner [169]) и гемотрансфузий (Giblett и соавт. [54], Levine и соавт. [90]).
Contreras и соавт. [38] описали случай появления указанных антител у женщины после внутриматочного переливания крови.
Антитела анти-Fy b естественного происхождения выявляли у лиц, не имев-
ших беременностей и гемотрансфузий (Issitt, Anstee [76], Michalewski [105]).
Некоторые образцы антител анти-Fy b обладали комплементсвязывающей активностью (Marsh [101]), они описаны в качестве причины тяжелых гемолитических трансфузионных реакций, в том числе с летальным исходом (Badakere и
соавт. [14], Boyland и соавт. [22]).
Kim и соавт.[84] описали 1 случай отсроченной посттрансфузионной реакции, обусловленной анти-Fy b-антителами, а Carreras Vescio и соавт. [24] – 1 случай ГБН, купированный двумя заменными гемотрансфузиями.
Dickstein и соавт. [48], Harris [66], van’t Veer и соавт. [167] сообщили о 4 слу-
чаях выявления у лиц Fy(a +b −) аутоантител, напоминавших анти-Fy b, которые реагировали с эритроцитами Fy(a −b + ), Fy(a +b + ) и слабо с эритроцитами Fy(a +b −). С эритроцитами Fy(a −b −) реакция была отрицательной. В одном случае указанные аутоантитела вызвали гемолитическую анемию [167].
Colligan и соавт. [37] получили моноклональные антитела анти-Fy b, иммунизируя мышей синтетическими пептидами.
Антигены Fya и Fyb
Как уже указывалось выше, антитела анти-Fy a были впервые обнаружены Cutbush и соавт. [40, 41] в 1950 г. у больного гемофилией, получившего большое количество гемотрансфузий. Вновь открытый антиген был обозначен последними буквами фамилии больного, мистера Duffy, поскольку к тому времени буквы Du уже обозначали слабый антиген D u системы резус.
Через год, в 1951 г., Ikin и соавт. [73] описали антитела, открывавшие антитетичный антиген Fy b.
Race и соавт. [137] отметили, что некоторые образцы антител анти-Fy a, особенно агглютинины, проявляли отчетливый эффект дозы. Буквами Fy x Chown и соавт. [35] обозначили ген, кодирующий слабый вариант антигена Fy b.
605
Частота
Частота антигенов Fy a и Fy b среди представителей разных рас и этнических групп неодинакова (табл. 10.2).
Таблица 10.2
Распределение фенотипов и генотипов Duffy у представителей разных рас*
Фенотип |
Генотип |
|
Частота (%) среди |
|
||
|
|
|
|
|
||
европеоидов |
|
негроидов |
|
монголоидов |
||
|
|
|
|
|||
|
|
|
|
|
|
|
Fy(a +b −) |
Fy a / Fy a (Fy a / Fy–) |
20 |
|
10 |
|
81 |
Fy(a +b + ) |
Fy a / Fy b |
48 |
|
3 |
|
15 |
Fy(a −b + ) |
Fy b / F b (Fy b / Fy–) |
32 |
|
20 |
|
4 |
Fy(a −b −) |
Fy–/Fy– |
0 |
|
67 |
|
0 |
* по Mourant и соавт. [118].
Chown и соавт. [35], Lewis и соавт. 92] обследовали 2182 канадца с помощью сыворотки анти-Fy b, выявляющей сильный и слабый варианты указанного антигена. Авторы установили, что частота генов Fy a, Fy b и F x составляет 0,425, 0,557 и 0,016, а частота фенотипов Fy(a +b −), Fy(a +b + ) и Fy(a −b + w) – 0,1823, 0,4735 и 0,004 соответственно. Лиц Fy(a −b −) среди канадцев не обнаружено.
Среди жителей Северной Европы чаще встречался ген Fy b, чем Fy a. Среди жителей Дальнего Востока, наоборот, аллель Fy b выявляли реже, чем Fy a (Lewis
и соавт. [91], Mourant и соавт. [118], Shimizu и соавт. [148]).
Частота генов Fy a и Fy b у негроидов оказалась более низкой по сравнению с европеоидами(табл.10.2).СредимонголоидовчастотаантигенаFy a превышает96 %.
В табл. 10.3 приведены данные генотипирования европеоидов и негроидов, полученные Olsson и соавт. [127] с помощью ПЦР.
Таблица 10.3
Частота фенотипов и генотипов Duffy у негров Южной Африки и шведов
|
|
Частота генотипа (%) среди |
|
Частота аллеля (%) среди |
||
Фенотип |
Генотип |
шведов |
негров |
Аллель |
шведов |
негров |
|
|
(n=100) |
(n=100) |
|
||
|
|
|
|
|
||
Fy(a +b −) |
Fy a / Fy a |
21 |
0 |
Fy a |
41 |
3 |
|
Fy a / Fy |
0 |
4 |
Fy b |
59 |
15,5 |
Fy(a +b + ) |
Fy a / Fy b |
40 |
2 |
Fy |
0 |
79,5 |
Fy(a −b + ) |
Fy b / Fy b |
39 |
2 |
|
|
|
|
Fy b / Fy |
0 |
29 |
|
|
|
Fy(a −b −) |
Fy / Fy |
0 |
63 |
|
|
|
|
|
|
|
|
|
|
606
Гены Fy a и Fy b наследуются кодоминантно. При обследовании членов 1091 семьи с помощью сывороток анти-Fy a и анти-Fy b ожидаемая и фактическая частота фенотипов Duffy совпала (Chown и соавт. [35], Lewis и соавт. [92]).
Среди 1445 обследованных жителей Москвы 1077 (74,84 %) были Fy a-положительными, 368 (25,16 %) – Fy a-отрицательными (Т.М. Пискунова [6]).
Молекулярная основа
Секвенирование ДНК ретикулоцитов показало, что специфичность антигенов Fy a и Fy b обусловлена заменой нуклеотидов в позиции 125, которая приводит к замене глицина на аспарагин в положении 42 гликопротеина Fy (Adams и
соавт. [9], Chaudhuri и соавт. [29], Iwamoto и соавт. [79], Mallinson и соавт. [99], Tournamille и соавт. [164]) (табл. 10.4). Результаты этих исследований подтверждены трансфекцией соответствующих кодирующих ДНК-клонов в клетки линии COS-7 обезьян. В результате трансфекции указанные клетки начинали экспрессировать антигены Fy a и Fy b, что можно было выявить с помощью проточной цитофлюориметрии (Tournamille и соавт. [164]). Участок рестрикции аллеля Fy a обозначен BanI.
Замена Ala 100 Thr в домене 2, обусловленная мутацией G 298 A, не влияла на специфичность антигенов.
Как показали Olsson и соавт. [128], у доноров шведов, имевших фенотип Fy(a −b + ), гликопротеин Fy в позиции 100 содержал треонин. Среди доноров Fy(a +b −) лиц с аналогичным размещением треонина в гликопротеине Fy не обнаружено.
|
|
|
|
Таблица 10.4 |
|
Аллели, изменяющие экспрессию антигенов Duffy на эритроцитах |
|||||
|
|
|
|
|
|
Аллели |
Нуклеотид |
Нуклеотид в позиции 125, |
Нуклеотид в позиции 265, |
Нуклеотидвпозиции298, |
|
аминокислота |
аминокислота |
аминокислота |
|||
локуса Fy |
в позиции 67 |
||||
в положении 42 |
в положении 89 |
в положении 100 |
|||
|
|
||||
|
|
|
|
|
|
Fy a |
T |
G |
C |
G |
|
Глицин |
Аргинин |
Аланин |
|||
|
|
||||
Fy b |
T |
A |
C |
G илиA |
|
Аспарагин |
Аргинин |
Aланин или треонин |
|||
|
|
||||
Fy x |
T |
A |
T |
A |
|
Аспарагин |
Цистеин |
Треонин |
|||
|
|
||||
Fy |
C |
A |
C |
G |
|
Аспарагин |
Аргинин |
Аланин |
|||
|
|
||||
Гликопротеин Fy, гомологичный на 99 % гликопротеину Fy человека, найден у шимпанзе. У обезьян Macacus rhesus, сурков и белок гомология составила 93–94 % (Chaudhuri и соавт. [29]). Все без исключения приматы имели ген, кодирующий в положении 42 аспарагин, из чего был следовал вывод, что аллель Fy a в эволюции человека появился раньше (Chaudhuri и соавт. [29], Li и
соавт. [93]).
607
Действие ферментов
Антигены Fy a и Fy b разрушаются большинством протеолитических ферментов: папаином, фицином, бромелином, проназой и химотрипсином. Трипсин не влияет на указанные антигены (Judson, Anstee [83], Miller и соавт. [110], Morton [116]). Обработка эритроцитов сиалидазой также не сказывается на факторах Fy a и Fy b. Ранние сообщения о влиянии трипсина на антигены системы Duffy были обусловлены, как полагают Daniels [43] и Issitt, Anstee [76], искажением результатов из-за примеси химотрипсина.
Хранение нативных эритроцитов в изотоническом растворе хлорида натрия при 12 оС в течение 2 недель приводит к частичой утрате антигенной активности факторов Fy a, Fy b, Fy3 и других Fy-субстанций, специфически ингибирующих соответствующие антитела (Williams и соавт. [179]).
Фенотип Fyx
Фенотип Fy x проявляет себя наличием необычного антигена Fy b, который реагирует не со всеми образцами сывороток анти-Fy b. Специфических антител антиFy x не найдено. Это свидетельствует в пользу того, что антиген Fy x как самостоятельная единица не существует. Тем не менее признак Fy x наследуется кодоми-
нантно, так же как Fy a и Fy b (Chown и соавт. [34, 35], Lewis и соавт. [92]).
Некоторые образцы сывороток анти-Fy a реагируют слабо с эритроцитами Fy aFy x (Chown и соавт. [35], Lewis и соавт. [92]). По адсорбции – элюции высокоактивных анти-Fy b-антител можно отличить лиц, имеющих генотип Fy b / Fy b от лиц, имеющих генотип Fy b / Fy x, однако более четкие результаты получают при использовании ПЦР (Murphy и соавт. [121]).
Фенотип Fy x [Fy(a +b w)] описывали главным образом у лиц белой расы, среди которыхонвстречаетсянестольредко.Среди1108обследованных11человекбыли
Fy(a +b w),1Fy(a −b + w);частотагенаFy x составила0,015(Lewisисоавт.[92]).
Фенотип Fy x описан у индейцев Канады (Buchanan и соавт. [23]). Сообщалось о нескольких лицах, которые были гомозиготны по гену Fy x. Фенотип двоих при первичном тестировании был определен как Fy(a −b −) (Cedergren, Giles [25], Cook и соавт. [39], Habibi и соавт. [58], Lewis и соавт. [92], Parasol и соавт. [131]).
Помимо супрессии антигена Fy b у гомозигот Fy x / Fy x заметно снижена выраженность других часто встречающихся антигенов Duffy: Fy3, Fy5 и Fy6 (Buchanan и соавт. [23], Habibi et al [58, 59], Mallinson и соавт. [99], Marsh [101], Olsson и соавт. [128], Tournamille и соавт. [162], Yazdanbakhsh и соавт. [183]).
Подсчет антигенных участков Fy6 с помощью проточной цитофлюориметрии показал, что их количество на эритроцитах Fy(a −b + ) составляет 2200–2400, на эритроцитах Fy x – от 150 до 250 (Tournamille и соавт. [162]). низкий уровень связывания антител анти-Fy6, обусловленный геном Fy x, наблюдалиTournamille и соавт. [162], Yazdanbakhsh и соавт. [183], используя метод иммуноблоттинга. Авторы полагают, что в присутствии гена Fy x имеет место угнетение синтеза
608
гликопротеина Fy, но не конформация его молекулярной структуры с образованием новой специфичности.
Гены Fy a, Fy b и Fy x имеют одинаковые кодирующие последовательности за исключением одной нуклеотидной замены (С 265 Т), приводящей к заме-
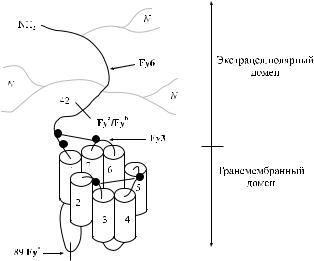
щению Arg 89 Cys (Gassner и соавт. [53], Li и соавт. [93], Olsson и соавт. [128], Tournamille и соавт. [162]) (табл. 10.4). Указанная замена затрагивает первую экстрацеллюлярную петлю гликопротеина Fy (рис. 10.1).
Рис. 10.1. Трехмерная модель Fy-гликопротеина по Mallinson и соавт. [99]. Экстрацеллюлярный домен содержит 3 участка N-гликозилирования. Черными кружками отмечены 5 цистеиновых остатков.
Клетки млекопитающих, подвергнутые трансфекции кДНК-Fy с искусственно встроенным кодоном цистеина в позиции 89, продуцировали меньшее количество субстанций Fy b, Fy3 и Fy6 по сравнению с клетками, подвергнутыми трансфекции кДНК нормальных генов Fy a и Fy b, в которых вместо Arg в пози-
ции 89 присутствует Lys (Tamasauskas и соавт. [155]).
Ген Fy x кодирует треонин в позиции Ala 100 Thr, а также имеет замену С 190 Т в интроне гена FY (Gassner и соавт. [53]). Эксперименты по направленному мутагенезу со встраиванием участков ДНК, кодирующих Ala 100 Thr, показали, что замены в этой позиции не влияют на экспрессию антигенов Duffy (Yazdanbakhsh и соавт. [183]).
Генная частота Fy x, установленная по мутацииArg 89 Cys при обследовании 100 шведов и 300 австрийцев, соответствовала 0,025 и 0,015; при обследовании 100 южноафриканских негров ген Fy x не обнаружен (Gassner и соавт. [53], Olsson и соавт. [128]). Тем не менее, ген Fy x проявлял некоторые признаки гетерогенности. У одних индивидов, имеющих фенотип Fy x, последовательность,
609
кодирующая антиген Fy b, не отличалась от нормы, у других наблюдали делецию на участке SP-1, расположенном выше стартовой точки считывания (Moulds и
соавт. [117]).
Фенотип Fy(a −b −)
Фенотип Fy(a −b −) был впервые выявлен Sanger и соавт. [144] при исследовании крови доноров (американских негров) сыворотками анти-Fy a и антиFy b. Оказалось, что большинство лиц указанной расовой принадлежности являются Fy(a −b −). Такие результаты позволили высказать предположение о существовании рецессивного аллеля в локусе Duffy. Этот молчащий аллель получил обозначение Fy. Частота фенотипа Fy(a −b −) составила 63 % среди негров Нью-Йорка, Вест-Индии (Race, Sanger [136]) и Южной Африки (Olsson и соавт. [127]), а среди других африканских популяций она оказалась еще более высокой (Mourant и соавт. [118]). Все 1168 обследованных жителей сельских районов Гамбии имели фенотип Fy(a −b −) (Welch и соавт. [176]).
Данные посемейных исследований в 53 негритянских семьях позволили подтвердить первоначальное предположение о существовании молчащего аллеля Fy (Race, Sanger [136]). Эффект дозы, выявляемый некоторыми образцами антител анти-Fy a, позволил установить, что практически все европеоиды Fy(a +b −) имеют генотипFy a / Fy a исодержатдвойнуюдозуантигенаFy a,анегроидыимеютгенотип Fy a / Fy, их эритроциты несут 1 дозу антигена Fy a и реагируют с антителами антиFy a менееинтенсивно,чемэритроцитыFy(a + )европеоидов(Sangerисоавт.[144]).
Хотя эритроциты Fy(a −b −) лишены Fy-гликопротеина (Chaudhuri и соавт. [28, 30]), последний у негроидов экспрессирован на клетках эндотелия посткапиллярных венул в мягких тканях и синусах селезенки (Peiper и соавт. [132]). Транскрипты гена FY (иРНК) не были выявлены в костном мозге лиц Fy(a −b −), однако их обнаружили в других тканях (легкие, селезенка, толстая кишка) (Chaudhuri и соавт. [29]). Кодирующая последовательность аллеля Fy оказалась идентичной кодирующей последовательности аллеля Fy b (Chaudhuri и со-
авт. [28, 29], Iwamoto и соавт. [79], Mallinson и соавт. [99], Peiper и соавт. [132], Tournamille и соавт. [164]), однако в промоторной области имелась нуклеотидная замена T > C, расположенная на 33 позиции выше стартовой точки считывания для эритроидных транскриптов, на 66 позиций выше такой же точки для образования большого транслирующего кодона (позиция 67), включая участок рестрикции StyI (Iwamoto и соавт. [78], Tournamille и соавт. [160]). Эта мута-
ция внутри последовательности GATA(с заменой CTTATCTна CTTAСCT) прерывает связывание эритроидспецифического фактора транскрипции GATA-1 и тем самым препятствует экспрессии антигенов FYна эритроидных клетках, при этом другие типы клеток не затрагиваются.
Iwamoto и соавт. [78], Tournamille и соавт. [160] провели эксперименты по трансфекции эритроидной клеточной линии человека (HELa) и линии эндотелиальных клеток промоторным регионом гена Fy b и гена, кодирующего
610
