
Донсков С.И., Мороков В.А. Группы крови человека. Руководство по иммуносерологии
.pdfАнтиген Р и антитела анти-Р
Антиген Р − гликолипидный глобозид – имеется на всех эритроцитах за исключением редких фенотипов р и P k. Он одинаково экспрессирован на эритроцитах Р1 и Р2 взрослых лиц. Этот антиген в отличие от антигена Р1 хорошо развит к моменту рождения. Несколько слабее он выражен у новорожденных Р2 по сравнению с новорожденными Р1.
Сведения об экспрессии антигена Р на других клетках крови противоречивы. С помощью метода проточной цитофлюориметрии Dunstan [39] выявил антиген Р на лимфоцитах, гранулоцитах и моноцитах; в своих экспериментах автор применил аллогенные анти-Р-антитела. Напротив, von dem Borne и соавт. [163], используя моноклональные анти-Р-антитела, не обнаружили указанный антиген на гранулоцитах и большинстве лимфоцитов периферической крови, хотя при этом он присутствовал на клетках эндотелия, тромбоцитах, мегакариоцитах и фибробластах. Другие авторы (Shevinsky и соавт. [149]), применив несколько образцов моноклональных анти-Р-антител, не нашли фактора Р на лимфоцитах и фибробластах. Антиген Р выявлен в клетках злокачественных опухолей (Bono и соавт. [15], Kelus и соавт. [77], Shevinsky и соавт. [149], von dem Borne и соавт. [163]), в клет-
ках печени и сердца плода, а также в плаценте (Spitalnik и соавт. [153]). Анти-Р-антителанайденывсывороткахлиц,имевшихфенотипP k.Kortekangas
и соавт. [83], Matson и соавт. [108] выделили анти-Р-антитела из сывороток лиц р, содержащих комбинированные антитела, адсорбцией эритроцитами P1 k или P2 k. Такие же антитела получили Watkins и Morgan [168], нейтрализуя сыворотку с комбинированными антителами жидкостью эхинококковых кист.
Большинство анти-Р-антител является смесью IgM и IgG (Lopez и соавт. [103], Soderstrom и соавт. [151], Yoshida и соавт. [176]) и иногда содержат фрак-
цию IgA (Hansson и соавт. [55]). В присутствии комплемента анти-Р-антитела IgM вызывали гемолиз эритроцитов Р1 и Р2 (Adinolfi и соавт. [2]).
Помимо аллоиммунных анти-Р-антител встречаются аутоиммунные антитела такой же специфичности. Их обнаруживали у больных пароксизмальной холодовой гемоглобинурией (Worlledge, Rousso [173]). Это один из вариантов аутоиммунной гемолитической анемии, развивающейся преимущественно у детей как осложнение перенесенной вирусной инфекции. Сыворотка крови таких больных содержит гемолизины, получившие название двухфазных гемолизинов Доната – Ландштейнера по имени авторов, впервые их описавших и предложившихсоответствующуюпробудляихопределения.ПробаДоната –Ландштейнера сводится к следующему: сыворотку выдерживают с эритроцитами при температуре 4–8 оС (I фаза – сенсибилизация), затем экспонируют в термостате при температуре 37 оС. При наличии в испытуемой сыворотке двухфазных гемолизинов эритроциты разрушаются (II фаза – гемолиз). Гемолиз происходит в присутствии комплемента, который содержится в исследуемой сыворотке.
В значительном числе случаев двухфазные гемолизины имеют анти-Р- специфичность, реагируют с эритроцитами Р1 и Р2, но не взаимодействуют с
501
эритроцитами р и P k (Heddle [57], Levine и соавт. [95], van der Hart и соавт. [160]).
Эти антитела относятся к классу IgG. Значительно реже встречаются двухфазные аутоиммунные гемолизины со специфичностью анти-I, анти-i, анти-Pr (Sokol и
соавт. [152]) и анти-р (Engelfriet и соавт. [41], Issitt и соавт. [67]).
При проведении пробы Доната – Ландштейнера для усиления реакции эритроциты обрабатывают папаином (Heddle [57], Sokol и соавт. [152]), сыворотки корригируют до слабокислого pH (Judd [70]).
Аутоиммунную гемолитическую анемию способны вызывать и однофазные аутоантитела анти-Р IgG-класса с температурным оптимумом между 20–32 оС
(Lindgren и соавт. [99], Mensinger и соавт. [110], Ries и соавт. [137]). Такие антите-
ла выявляли только в среде с низкой ионной силой, тест Доната – Ландштейнера с ними был отрицательным (Cohen и соавт. [30], Judd и соавт. [71]).
Крысиные МКА анти-Р (МС631) к эмбриональному стадиоспецифическому мышиному антигену (SSEA-3) перекрестно реагировали с эритроцитами Р1 и Р2, но не реагировали с эритроцитами р и P k. Их активность угнеталась трисахари-
дом GalNAcβ1 → 3Galα1 → 4Gal (Kannagi и соавт. [73],Tippett и соавт. [158]).
Мышиные МКА анти-Р IgM-класса, реагировавшие с очищенным глобозидом, вызывали сравнительно слабую холодовую агглютинацию, однако в присутствии комплемента наблюдали выраженный гемолиз эритроцитов Р + (Rouger и соавт. [139], von dem Borne и соавт. [163]). Другой образец мышиных МКА, полученных иммунизацией экстрактом из Escherichia coli, в серологических реакциях также показал анти-Р-специфичность. Однако активность этих антител устранялась Т-специфическим иммуносорбентом (Galβ1 →3 GalNAc-R) (Inglis и соавт. [66], Rouger и соавт. [139]).
Экстракты из лосося, форели и икры сельди реагировали с эритроцитами, содержащими антигены В, Р, Р1 или P k, но не агглютинировали эритроциты О(I) р или А(II) р (Anstee и соавт. [7, 8], Voak и соавт. [161, 162]). Антитела не сепарируются по специфичности дифференциальной адсорбцией, поэтому ценность указанных экстрактов в качестве реагентов невелика.
Антиген Pk и антитела анти-Pk
Антитела анти-P k и соответственно антиген P k открыты в 1959 г. Matson и соавт. [108] с помощью дифференциальной адсорбции сыворотки, содержавшей комбинированные антитела.
Особенностью лиц P k + является то, что их эритроциты не содержат часто встречающегося антигена Р, а в сыворотке крови присутствуют анти-Р-антитела. Кроме того, сыворотки слабо реагируют с эритроцитами р (Kortekangas и соавт. [83], Tippett [156]).
Антиген P k одинаково хорошо экспрессирован в эритроцитах независимо от
факторов Р1 и Р2.
Индивиды P k + встречаются крайне редко, реже, чем лица с нулевым фенотипом р (Daniels [37]). Все они были выявлены благодаря неизменному
502
присутствию в сыворотках их крови анти-Р-антител. Лица P k + были выявлены,
в основном, среди финнов и японцев (Daniels [37], Race, Sanger [133]).
Обращало на себя внимание, что родители пробандов P k + были P k −. Это давало основание полагать, что наследование гена P k имеет рецессивный характер
(Moullec и соавт. [119], Nakagima и соавт. [126], Race, Sanger [133]). Родители 7
индивидов P k + состояли в кровном родстве. Вместе с тем рецессивный характер наследования может представлять собой только видимость, поскольку вещество P k является предшественником субстанции Р, и стандартные серологические методы позволяют выявить его только у лиц Р − (гомозигот P k / P k).
По результатам прямых серологических тестов создавалось впечатление, что антиген P k является очень редким. Однако Fellous и соавт. [42] обнаружили его на фибробластах всех лиц Р1 и Р2; фибробласты лиц р этот антигена не содержали. Затем Naiki и Marcus [125] установили, что тригексозид церамида (Gb3) – один из основных мембранных гликолипидов эритроцитов – ингибирует активность антител анти-P k. Naiki и Kato [123] указали на присутствие P k на эритроцитах Р1 и Р2. Они высказали предположение, что ранее полученные результаты были ложноотрицательными, поскольку при адсорбции антител анти-Р1P k эритроцитами Р1 (содержащими Gb3), помимо анти-Р1-антител, из сывороток удалялась также и фракция анти-P k. Позднее присутствие антигена P k на эритроцитах Р1 и Р2 подтвердили с помощью МКА анти-P k. Слабую экспрессию антигена P k объяснили неполным превращением глобозида 3 в глобозид (антиген Р).
Антиген P k лучше экспрессирован на эритроцитах LKE −, чем LKE + (см. Антиген LKE).
Антиген P k, идентифицированый как CD77, присутствует на лимфоцитах, гранулоцитах, моноцитах, тромбоцитах, клетках гладкой мускулатуры пищеварительного и мочеполового тракта (Kasai и соавт. [75]), клетках злокачественных опухолей (Bono и соавт. [15], Wiels и соавт. [170]) и считается информативным при диагностике лимфомы Беркитта. Полагают, что CD77 участвует в апоптозе клеток зародышевых центров В-лимфоцитов (Khine и соавт. [80], Mori и соавт. [117]). Связывание CD77 и CD19 (специфический В-клеточный маркер) в дальнейшем приводит к апоптозу В-клеток (Mangeney и соавт. [104]).
Аллоиммунные антитела анти-P k присутствуют одновременно с анти-Р и анти-Р1 в сыворотках крови лиц нулевого фенотипа р. Их выделяли из некоторых сывороток адсорбцией эритроцитами Р1 (Race, Sanger [133], Tippett [156]). Такие антитела реагируют одинаково интенсивно с эритроцитами Р1 и Р2. Активность антител анти-P k нейтрализуется жидкостью эхинококковых кист (Kortekangas и соавт. [84], Matson и соавт. [108]). Используя метод ингибиции анти-P k-антител различными фракциями эхинококковой жидкости и олигосахаридами известной структуры, Watkins и Morgan [168] пришли к выводу, что антитела анти-P k имеют более широкую специфичность, чем анти-Р1. Установлено, что дисахарид Galα1 → 4Gal, выделенный из P1 k-специфичного гликопротеина жидкости эхинококка, так же как Р1-специфический трисахарид
503
и олигосахариды, имеющие группировку Galα1 → 4Gal, ингибирует активность антител анти-P k (Naiki и соавт. [123]).
Помимо аллоиммунных антител, описаны аутоиммунные анти-P k-антитела, которые находили у больных аутоиммунной гемолитической анемией и билиар-
ным циррозом печени (Race, Sanger [133]).
Иммунизацией крыс клетками лимфомы Беркитта были получены моноклональные анти-P k-антитела (Wiels и соавт. [170]), реагирующие с Gb3. Эти антитела реагировали в высоком титре с клетками P1 k и P2 k, слабо реагировали с папаинизированными эритроцитами Р1 и Р2 и давали отрицательные реакции с эритроцитами нулевого фенотипа р.
Другие образцы МКА анти-P k получены иммунизацией мышей синтетическими гликопротеинами, содержащими P k-специфические компоненты, глобозидом 3, выделенным из эритроцитов свиней и клеточных линий плоскоклеточной карциномы пищевода (Kasai и соавт. [75], Miyamoto и соавт. [113]).
Антиген LKE (Luke)
Антиген LKE обнаружили Tippett и соавт. [159] в 1965 г. Сыворотка анти-LKE была получена от негра по имени Luke Р., страдавшего болезнью Ходжкина. Она напоминала известные к тому времени сыворотки анти-Р, поскольку не реагировала с эритроцитами р и P k. Однако отрицательные реакции наблюдали также с некоторымиобразцамиэритроцитовР1 иР2,чтоотличалоанти-LKE-антителаотанти-Р.
В 1985 г. были получены моноклональные антитела к мышиному стадиоспецифическому эмбриональному антигену (SSEA-4) (Kannagi и соавт. [73]), специфичность которых практически совпадала со специфичностью антител сыворотки Luke (Tippett и соавт. [158]). Как показал биохимический анализ, структура, с которой реагировали указанные антитела, содержала терминальную группировку NeuAcα2 → 3Galβ1 → 2GalNAc, сиаловую кислоту и галактозу, присоединенную к глобозиду. Именно эта структура распознается антителами антиLKE и анти-SSEA-4.
Популяционные исследования среди англичан, проведенные Tippett и соавт. [158, 159]сиспользованиемсывороткиLuke,атакжеМКАанти-SSEA-4,показали98,84 % положительныхрезультатов(LKE + );1,16 %отрицательных(LKE −).Частотагеноти-
повLKE +/LKE +составила0,7962;LKE +/LKE − −0,1922;LKE −/LKE − −0,0116.
Фенотип LKE − обнаружен у представителей различных расовых и этнических групп:англичан,шотландцев,итальянцев,французов,евреев,арабов,турок,негров.
Посемейные исследования показали, что ген LKE независим от локусов, контролирующих другие антигенные системы эритроцитов (MNS, P1, RH, LU, KEL, FY, XG), а также выделительство.
При проведении популяционных исследований отмечено, что экспрессия антигена LKE варьировала в широких пределах. Фенотип LKEw (weak) встречался чаще у лиц лиц Р2, чем у лиц Р1, а также чаще среди лиц, имеющих группу крови А1 и А1В, по сравнению с людьми, имеющими группу крови О, В, А2 и
504
А2В. Однако второй образец аллогенных анти-LKE-антител не показал какихлибо ассоциаций с группой Р и АВО (Daniels [37]).
Антиген LKE хорошо выражен к моменту рождения (Bruce и соавт. [22], Tippett и соавт. [158]). Он обнаружен в клеточных линиях тератомы человека (Kannagi и соавт.[73]),вганглиозидах,выделенныхизтромбоцитов(Coolingисоавт.[32]).
Экспрессия антигена LKE не зависела от наличия антигена Р. Лица LKE − присутствовали среди индивидов Р1 и Р2. Отмечена некоторая фенотипическая связь с антигеном P k. Последний лучше выражен на эритроцитах Р + LKE − (Bruce и соавт. [22]).
Известно 5 образцов антител анти-LKE аллогенного происхождения. Первый из них найден у больного лимфомой, не получавшего гемотрансфузий (Tippett и соавт. [159]). В серологических реакциях антитела проявляли себя как агглютинины, выраженность реакций усиливалась по мере снижения температуры, такой же эффект давало энзимирование эритроцитов трипсином, фицином и папаином. Свежая сыворотка Luke вызывала гемолиз папаинизированных клеток. Антитела анти-LKEнеингибировалисьжидкостьюкистэхинококкаилислюнойлицLKE +. Позднее было найдено еще 4 сыворотки указанной специфичности (Bruce и соавт. [22], Moller, Jorgensen [114]), в одном случае анти-LKE-антитела сочетались с анти-Р ([114]). У новорожденных LKE +, родившихся от матерей с наличием анти-LKE-антител, проявлений ГБН не отмечено ([22, 114]).
Фенотип р и антитела анти-РР1Рk
В 1951 г. Levine и соавт. [94] описали антитела, присутствовавшие у пациентки с карциномой желудка. Последние реагировали со всеми образцами эритроцитов, за исключением собственных и эритроцитов сестры. Антитела были обозначены анти-Tj a (T – тумор, j – по имени больной). Ассоциацию антигена Tj a с системой Р установила Sanger [142], обнаружившая 6 неродственных лиц с фенотипом Tj(a −), не содержавших антигенов Р. По предложению Sanger фенотип Tj(a −) был переименован в р. Его возникновение интерпретировали как фенотипическое проявление гомозиготности по рецессивному аллелю локуса Р1.
Фенотип р встречается редко – 1 на 172 тыс. обследованных. По расчетам
Race и Sanger [133], частота гена р составляет 0,0024.
При обследовании более миллиона китайцев Гонконга он не найден ни разу (Lin и соавт. [98]), однако присутствовал среди японцев. Из 40 149 обследованных шведов 8 имели фенотип р (Cedergren [26]).
Посемейными исследованиями, в том числе в изолятах, показан рецессивный характер наследования гена р (Catino и соавт. [25], Miwa и соавт. [112], Salmon и соавт. [141], Yamaguchi и соавт. [174]). Родители лиц с фенотипом р часто оказывались кровными родственниками.
Полагают, что фенотип р обусловлен гомозиготностью по мутантному гену, кодирующему Gb3-синтазу. Этот фермент обеспечивает превращение лактозилцерамида в глобозид-3 (Furukawa и соавт. [50], Steffenson и соавт. [155]). Точковые
505
мутации в различных участках экзона 2 (табл. 7.3) приводят к образованию Gb3синтазы, лишенной трансферазной активности. Отмечена гетерогенность мутаций генаα4Gal-Tуяпонцев(Furukawaисоавт.[50])ишведов(Steffensonисоавт.[155]).
В сыворотках крови всех без исключения людей с фенотипом р присутствуют антитела, вызывающие агглютинацию и / или гемолиз всех образцов эритроцитов, за исключением группы р. Как показала Sanger [142], двумя основными компонентами таких сывороток являются антитела анти-Р1 и анти-Р. Их можно разделить адсорбцией эритроцитами Р2, при этом удаляется фракция анти-Р- антител. Позднее был идентифицирован еще один компонент (анти-Р k), вследствие чего специфичность антител обозначена анти-РР1Р k.
1устраняла активность анти-Р1
ианти-Р k, при этом фракция анти-Р в сыворотке оставалась в чистом виде (Matson
исоавт. [108]). Фракцию анти-Р k удавалось выделить не из всех сывороток. Tippett
[156] проводила адсорбцию 47 таких сывороток, используя эритроциты Р1. Фракции анти-Р k,какправилоснизкойактивностью,выделеныменеечемвполовинеслучаев.
Naiki и Kato [123] ингибировали антитела, полученные от лиц р, добавляя в сыворотки различные гликосфинголипиды. Тестирование проводили с помощью реакций агглютинации и связывания комплемента. После нейтрализации анти-Р-антител глобозидом оставшиеся в сыворотке антитела имели специфичность анти-Р1Р k. Антитела анти-Р1Р k были представлены преимущественно классом IgG (Naiki, Kato
[123]),аанти-Р1-антитела,выявляемыеулицР2,вбольшинствеслучаевклассомIgM. Используя аналогичные методы, Kato и соавт. [76] подтвердили, что одна фрак- цияанти-Р-антителулицрпредставленаIgM,которыеперекрестнореагируютсан- тигеном Форссмана; другая фракция – IgG, реагирующими с глобозидом. Фракция анти-Р k-антителвтакихсывороткахпредставляласобойIgG(Katoисоавт.[76]). Rydberg и соавт. [140] с помощью радиоиммунного анализа установили, что антителакфакторамР,Р1иР k являютсяIgGиIgА.Анти-Р1-ианти-Р k-антителабыли представленытакжеIgМ.ПочтивсеIgG-антителаотносилиськсубклассуIgG3,ино- гда присутствовали фракции IgG1 или IgG2, фракция IgG4 не обнаружена ни разу. АнтителасубклассаIgG1перекрестнореагировалисА-иН-группоспецифическими веществами, как полагают Rydberg и соавт. [140], за счет способности распознавать
углеводородныегруппировкивнутриолигосахаридныхцепей.
Антитела анти-РР1Р k способны вызывать внутрисосудистый гемолиз и могут иметь клиническое значение (Т.М. Пискунова, Т.А. Ичаловская [1], Daniels [37]). Острые гемолитические реакции наблюдали Chandeysson и соавт. [27] после внутривенного введения 25 мл несовместимых эритроцитов. Указанные антитела являются одной из возможных причин привычных выкидышей на ранних сроках беременности.
Как отмечено выше, фенотип р был впервые выявлен у женщины с карциномой желудка. Ей была проведена субтотальная резекция желудка и после этого в течение 22 лет не наблюдали признаков рецидива или метастазирования (Levine [93]). В отличие от эритроцитов больной клетки ее опухоли экспрессировали
506
антигены Р и Р1 (Kannagi и соавт. [74]), что послужило основанием концепции «запретных антигенов», появляющихся в опухолях вопреки генотипу индивида, сфорсулированной Levine. По появлению этих антигенов можно судить о глубине трансформации нормальных клеток в процессе малигнизации. Levine высказал предположение, что антитела анти-РР1Р k, имевшиеся у больной, предотвращали дальнейший рост опухоли.
Необычные фенотипы
Race и Sanger [133] описали пациента, у которого присутствовали антитела антиРР1Р k. Эритроциты больного, Р1 −Р k −LKE −, реагировали с 9 сыворотками анти-Р1, полученнымиотлицР k,атакжес1из12сыворотоканти-РР1Р k инеагглютинирова- лисьсывороткойанти-Рбольногоэхинококкозом.Сывороткабольногореагировалас эритроцитамиР1,Р2 иР k,нобылаинертнавотношении16образцовэритроцитовр.
Allenисоавт.[3]обследовалибольногосослабымантигеномР(Р1 −Р k −),всыворотке которого присутствовали антитела анти-IP1 и анти-IP. Антиген I в эритроцитах этого человека также был необычным: компонент I D был ослаблен, I F – выражен нормально, экспрессия антигена i была повышена (см.Система Ii).
Issitt и соавт. [68] описали антитела анти-IP1, которые в серологических реакциях вели себя как анти-Р1 с той лишь разницей, что не реагировали с эритроцитами новорожденных Р1.
Booth [16], Ramos и соавт. [135] нашли двухфазные гемолизины со специфичностью анти-I ТP1.
Kundu и соавт. [88] нашли мужчину китайца с фенотипом Р2, эритроциты которого слабо реагировали с сыворотками анти-РР1Р k. В сыворотке крови антител не выявлено. Содержание глобозида, в том числе Gb3, в его эритроцитах составляло 30–40 % от нормального. Авторы высказали предположение, что возникновение подобного фенотипа обусловлено гомозиготностью индивида по дефектному аллелю Р k или эффектом другого гена, ингибирующего ген Р k.
В сыворотке крови 1 женщины были найдены агглютинины, которые давали выраженные реакции с эритроцитами Р1, Р2 и слабоположительные реакции с эритроцитами р (Shirey и соавт. [150]). Специфичность антител более напоминала анти-Р, чем анти-LKE, поскольку они в отличие от анти-LKE-антител ингибировались глобозидом.
Обследуемая имела фенотип Р1 + Р k + Р −. В то же время содержание глобозида в эритроцитах было снижено в 2, а Gb3 – в 4–6 раз по сравнению с нормой.
Не исключено, что антигены рассматриваемой системы, как и другие групповые антигены, могут быть парциальными.
Анти-р-антитела
До настоящего времени специфические анти-р-антитела не найдены и, возможно, не существуют в природе. Вместе с тем нечто близкое к анти-р- специфичности было обнаружено.
507
Engelfriet и соавт. [41], Issitt и соавт. [67, 68], Metaxas и соавт. [111] описали
3 сыворотки, которые реагировали с эритроцитами р, а реакция с эритроцитами Р1, Р2 и Р k была слабой или отсутствовала.
Одна из сывороток (Fol) содержала агглютинины и двухфазные гемолизины. Антиген, с которым реагировала сыворотка Fol, разрушался после обработки эритроцитов сиалидазой и был идентифицирован Schwarting и соавт. [145] как сиалопараглобозид.
Антитела анти-Gd, реагирующие с сиалозависимыми антигенами подобно сыворотке Fol, имели другую специфичность (Roelcke и соавт. [138]), хотя одна из них реагировала с эритроцитами р.
Получены мышиные моноклональные антитела со специфичностью, подобной антителам сыворотки Fol, однако антиген, открываемый этими антителами, не разрушался сиалидазой (McDonald и соавт. [109]).
Биохимия
Антигенные детерминанты Р на эритроцитах представлены углеводными остатками гликосфинголипидов (табл. 7.2), олигопептидные цепи связаны с церамидом (Schenkel-Brunner [144]). Изучение биохимической структуры антигенов Р1, Р и P k показало, что субстанции Р и P k не являются предшественниками антигена Р1. Синтез указанных антигенов происходит посредством двух различных механизмов: P k и Р образуется из параглобозидов, причем P k является предшественником Р, а Р1 – из глобозидов.
Таблица 7.2
Структура гликосфинголипидов, ассоциированных с системой Р и GLOB
Антиген |
Структура |
Терминальные углеводные группировки |
|
|
Лактозилцерамид (Gb2) |
Galβ → 4Glc-Cer |
|
|
ПАРАГЛОБОЗИДЫ |
||
Р1 |
Параглобозид |
Galβ → 4GlcNAcβ1 → 3Galβ1 → 4Glc-Cer |
|
Галактозилпараглобозид |
Galβ → 4Galβ1 → 4GlcNAcβ1 → 3Galβ1 → |
||
|
4Glc-Cer |
||
|
|
||
|
Сиалозилпараглобозид |
NeuAcα2→3Galβ1→4GlcNAcβ1→3Galβ1→ |
|
|
4Glc-Cer |
||
|
|
||
|
ГЛОБОЗИДЫ |
||
P k |
Глоботриозилцерамид (Gb3) |
Galα1 → 4Galβ1 → 4Glc-Cer |
|
P |
Глобозид |
GalNAcβ1 → 3Galα1 → 4Galβ1 → 4Glc-Cer |
|
LKE, |
Сиалозилгалактозилглобозид |
NeuAcα2→3Galβ1→3GalNAcβ1→3Galβ1→ |
|
SSEA-4 |
|
4Galβ1→4Glc-Cer |
|
|
Дисиалозилгалактозилглобозид |
NeuAcα2 → 3Galβ1 → 3(NeuAcα2 → 6) → |
|
|
|
GalNAcβ1 →3 Galα1 → 4Galβ1 → 4Glc-Cer |
|
Н |
Глобо-Н (тип 4Н) |
Fucα1 → 2Galβ1 → 3GalNAcβ1 → 3Galα1 → |
|
4Galβ1 → 4Glc-Cer |
|||
|
|
||
Антиген |
(Gb5) |
Gal-NAcα1 → 3GalNAcβ1 → 3Galα1 → |
|
Форссмана |
4Galβ1 → 4Glc-Cer |
||
|
|||
508
Антигены Р, относящиеся к параглобозидам
Параглобозид (лакто-N-неотетразилцерамид) является предшественником АВН-субстанций типа 2, некоторых ганглиозидов, а также антигена Р1. Первые сведения о природе Р-антигенов были получены в тестах с ингибицией специфических антител. Изучая ингибирующее действие моно-, ди- и трисахаридов на активность антител анти-Р1, Morgan и Watkins [116, 168] показали, что специфическая активность всех сахаров обусловлена α-D-галактозой. Авторы получили из жидкости эхинококка овец гликопротеин, специфически ингибировавший анти-Р1-антитела. При кислотном гидролизе указанного гликопротеина было установлено, что детерминанта Р1, распознаваемая антителами анти-Р1, является трисахаридом: Galα1 → 4Galβ1 → 4GlcNAc (Cory и соавт. [33], Schenkel-Brunner [144].
Антиген Р1 на эритроцитах представлен гликосфинголипидом ‒ пентамерным церамидом (см. табл. 7.2) с трисахаридным терминальным участком, распознаваемым специфическими антителами (Naiki и соавт. [122, 124]). Пространственная структура представляет собой параглобозид с дополнительным остатком α-галактозы. Трисахаридная структура, определяющая специфичность, обладала выраженным ингибирующим эффектом по отношению к моноклональным анти-Р1-антителам (Bailly и соавт. [10, 11], Rouger и соавт. [139]).
Brodin и соавт. [18]) получили Р1-специфический трисахарид синтетическим путем и с успехом использовали для иммунизации мышей с целью получения моноклональных антител. Синтетический трисахарид, коньюгированный с иммуносорбентом, извлекал антитела анти-Р1 из аллоиммунных сывороток
(Cowles и соавт. [34]).
Описаны антитела, реагирующие с эритроцитами нулевого фенотипа р. Эти антитела специфически ингибировались сиалозилпараглобозидом (Metaxas и соавт. [111], Schwarting и соавт. [145]), терминальная часть которого содержала остатки сиаловых кислот. Упомянутый сиалозилпараглобозид найден в высокой концентрации на эритроцитах лиц, имеющих нулевой фенотип р. При этом синтез вещества P k (Gb3) блокирован.
Антигены Р, относящиеся к глобозидам
Антигены Р, P k и Р1 между собой тесно связаны, однако имеют разную природу: Р и P k относятся к глобозидам, а Р1 ‒ к параглобозидам. На эритроцитах они представлены гликолипидами, в жидкости эхинококковых кист они присутствуют в составе гликопротеинов.
Используя очищенные гликолипиды для ингибиции антител анти-PP1P k, Naiki и Matson [125], Yang и соавт. [175] установили, что глобозид и тригексозид церамида (Gb3) свойственны эритроцитам, несущим антигены Р и P k. Субстанция P k трансформируется в антиген Р, а антиген Р1 синтезируется на основе параглобозидов (рис. 7.1).
509
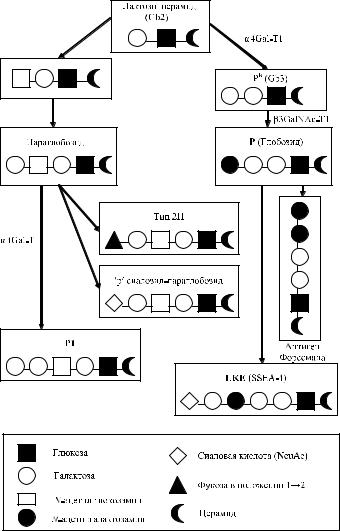
Рис. 7.1. Синтез антигенов Р и GLOB по Daniels [37].
Антиген Pk
Формирование антигенной детерминанты P k происходит с участием α-D-
галактозы (Furukawa [49], Kundu и соавт. [86], Voak и соавт. [161], Watkins, Morgan [168]).Активностьантителанти-P k,такжекакианти-Р,ингибироваласьжидкостью кистэхинококка(Matsonисоавт.[108]).Частичныйкислотныйгидролизгликопротеина,выделенногоизэхинококковыхкист,позволилполучить2субстанции:трисахарид, обладающий способностью специфически инактивировать антитела анти-Р1 и анти-P k,идисахаридGalα1→4Gal,связывающийантителаанти-Р1,ноинертныйпо отношению к анти-P k-антителам [168]. Другие олигосахариды, содержавшие терминальные α-галактозные группы, также нейтрализовали активность анти-P k-антител, чтоподтверждалоучастиеα-галактозывформированииэпитоповP k [168].
510
