
Донсков С.И., Мороков В.А. Группы крови человека. Руководство по иммуносерологии
.pdfприсоединения полисахаридных группировок к полипептидной части: посредством О- и N-связи. Эти участки обозначают как О- и N-гликаны (Chasis и соавт. [40], Daniels [56]). Последние представлены сложными полисахаридными цепями, связанными с пептидной цепью через аминогруппы аспарагина, чаще с N-ацетилгалактозамином (Chasis и соавт. [40], Dahr [54]). Последовательность Asn/…n–Thr / Ser, где позицию …n может занимать любая аминокислота, кроме пролина, является участком N-гликозилирования. Гликофорин A имеет один N-гликан, гликофорины В и Е не содержат N-гликаны. О-гликаны меньше по размеру и гликозилированы через гидроксильные группы, образованные серином или треонином. Углеводные цепи присоединены к экстрацеллюлярным участкам гликофоринаAи B (Chasis и соавт. [40], Dahr [54]).
ГликофоринA– одно из наиболее представительных в количественном отношении веществ в структуре эритроцитной мембраны (Chasis и соавт. [40], Dahr [54]). В его состав входит 131 аминокислота. На экстрацеллюлярный участок, N-домен, приходится 72 аминокислоты, на гидрофобный трансмембранный домен – 23 аминокислоты, на терминальный цитоплазматический, или С-домен, –
36аминокислот.
Гликофорин B имеет меньшую массу (72 аминокислоты). Он также пред-
ставлен тремя доменами: экстрацеллюлярным, N-терминальным, имеющим 44 аминокислоты; гидрофобным трансмембранным, имеющим 20 аминокислот, и коротким терминальным цитоплазматическим С-доменом, состоящим из 8 ами-
нокислот (Chasis и соавт. [40], Daniels [56]).
Экстрацеллюлярные домены обоих гликофоринов, А и В, интенсивно гликозилированы.
Молекула гликофорина A содержит один N- и от 15 до 21 О-гликанов, при этом О-гликаны представлены разветвленной цепью тетрасахаридов, состоящей из сиаловой кислоты, галактозы и N-ацетилгалактозамина (Chasis и соавт. [40], Issitt,Anstee [113]).
Степень гликозилирования гликофоринов у разных лиц неодинакова. Строение О-гликанов гликофорина A во многом сходно с таковым гликофорина В. Так, первые 26 аминокислотных остатков в экстрацеллюлярном домене гликофорина А с N-серологической активностью такие же, как и на гликофо-
рине В (Blumenfeld и соавт. [29], Booth [31], Chasis и соавт. [40], Dahr [54], Schenkel-Brunner [223]). Этим объясняется N-антигенная активность гликофорина B, которую обозначают как ′N′ для ее дифференциации от антигена N, находящегося на молекуле гликофоринаA(Issitt,Anstee [113], Judd и соавт. [127]). Трансмембранные домены гликофоринов A и B также практически идентичны между собой (Chasis и соавт. [40], Daniels [56], Schenkel-Brunner [223]).
Антигены М и N несет гликофорин A, антигены S и s расположены на гликофорине B (Schenkel-Brunner [223]). Количество молекул гликофорина A на 1 эритроцит составляет 800 тыс.–1 млн, гликофорина В – 170–250 тыс. (SchenkelBrunner [223]).
451
Антигены М, N и антитела к ним
Серологически выявляемая М-антигенная активность обусловлена присутствием серина в позиции 1 и глицина в позиции 5 на экстрацеллюлярном домене гликофорина А (Dahr и соавт. [55]). На N-положительных клетках в этих позициях находятся лейцин и глютаминовая кислота соответственно (рис. 6.1). В экспрессии антигенов важную роль играют О-гликаны и сиаловые кислоты. Позиции 2–4 пептидной цепи гликофорина A гликозилированы (Dahr и соавт. [55], Issitt,Anstee [113], Schenkel-Brunner [223]).
Рис. 6.1. Строение терминальных участков гликофорина А.
Нередко антитела анти-M и анти-N обнаруживают у лиц, не имевших беременностей и гемотрансфузий (Garratty [78], Kao и соавт. [128]). Такие антитела естественные, часто представляют собой IgM и реагируют при комнатной температуре как агглютинины. Описаны IgG-антитела той же спец-
ифичности (Garratty [78], Issitt, Anstee [113]). Многим антителам, особенно анти-М, свойствен эффект дозы. Эритроциты гомозигот M / M и N / N реагируют с антителами анти-М и анти-N сильнее, чем эритроциты гетерозигот. Большинство образцов указанных антител не обладает способностью активировать комплемент. Считается, что антитела анти-M и анти-N, относящиеся к холодовым, не имеют клинического значения, поскольку не способ-
ны вызвать гемолиз эритроцитов in vivo (Garratty [78], Issitt, Anstee [113]). Случаи ГБН (Duguid и соавт. [65], Stone и соавт. [234], Teleschi и соавт.
452
[246]) и трансфузионные реакции (Alperin и соавт. [13], Ballas и соавт. [20], Furlong и соавт. [73], Sancho и соавт. [217]), обусловленные указан-
ными антителами, редки.
В отечественной литературе имеется 2 сообщения об аллоиммунизации антигеном М в результате беременности. Выраженных клинических проявлений ГБН при этом не наблюдали (А.А. Михайлова, Т.А. Ичаловская [6], А.Е. Скудицкий [8]).
Антитела анти-М обнаруживали у детей и взрослых, перенесших бактериальные инфекции (Kao и соавт. [128]). Антитела выявляли у беременных, дети которых, как позже выяснилось, не имели антигена М. Анти-М-антитела иногда сопутствовали другим антителам (Rh, Kell, Kidd, Duffy) у гематологических больных, получивших многочисленные переливания компонентов крови (А. Майский, Л. Кучера [5], Gales и соавт. [77]).
Помимо естественных и аллоиммунных антител описаны аутоантитела анти-М и анти-N (Chapman и соавт. [39], Garratty и соавт. [79], Immel и соавт. [110], Sacher и соавт. [215]). В некоторых случаях течение аутоиммунной гемолитической анемии, обусловленной этими антителами, было тяжелым (Garratty
и соавт. [79], Immel и соавт. [110]).
Различают рН-зависимые и глюкозозависимые антитела анти-M и анти-N (Beattie и соавт. [22], Reid и соавт. [200]). В отличие от обычных антител, для которых кислотность среды не столь существенна, рН-зависимые анти-М и анти-N-антитела наиболее активно реагируют с эритроцитами, несущими соответствующий антиген, при значении рН 6,5. Глюкозозависимые антитела проявляют свое действие лишь с эритроцитами, инкубированными в растворе глюкозы. Установлено, что активность некоторых образцов антител анти-М и анти-N ингибируется растворами мальтозы и маннита, но остается неизмененной в присутствии фруктозы, рибозы, галактозы, лактозы и сахарозы. Такие антитела выявляли главным образом у больных сахарным диабетом.
У больных почечной недостаточностью, находившихся на гемодиализе, обнаруживали особые антитела анти-N, реагирующие с эритроцитами, обработанными формальдегидом (Dzik и соавт. [66], Howell и соавт. [96], McLeish и со-
авт. [157], Sandler и соавт. [218], White и соавт. [259]). Такие антитела были
обозначены как анти-Nform. Дальнейшие исследования показали, что анти-Nform- антитела образовались в результате модификации мембраны эритроцитов боль-
ных следами формальдегида в гемодиализной системе (стерилизацию систем для гемодиализа проводили с использованием формальдегида).
Анти-N-подобную специфичность имеют лектины растительного происхо-
ждения – Vicia graminea (А.К. Туманов, В.В. Томилин [9], Prigent [190]).
К настоящему времени получено большое количество образцов моноклональных антител анти-M и анти-N (Lisowska [149], Reid и соавт. [201]). Последние с успехом используют для фенотипирования эритроцитов, однако некоторые из них, в частности анти-М, не строго специфичны и в высоких
453
концентрациях реагируют с эритроцитами M −N +, т. е. диспецифичны. Для придания им анти-М-специфичности прибегают к их разведению, что вполне приемлемо для рутинного анализа, но не для метода адсорбции – элюции. На активность моноклональных анти-M- и анти-N-антител влияют рН среды и температурные условия постановки реакции. Поликлональные антитела анти-M и анти-N алло- и ксеногенного происхождения менее зависимы от этих условий.
Протеолитические ферменты, применяемые в практике иммуносерологических лабораторий (папаин, фицин, бромелин, протеаза), разрушают антигены M и N, в связи с чем энзимные пробы при работе с антителами анти-M и
анти-N не используют (Hirsch и соавт. [93], Issitt, Anstee [113], Race, Sanger [191], Reid и соавт. [201]).
Антигены S, s и антитела к ним
Специфичность антигенов S и s обусловлена заменой одной аминокислоты в экстрацеллюлярной части гликофорина B, в позиции 29 (Chasis и соавт. [40], Dahr [54]). На цепях, несущих S-антигенную активность, эту позицию занимает метионин, на цепях, несущих s-антигенную активность, – треонин. Полагают, что важную роль в экспрессии указанных антигенов играет гликозилирование цепей гликофорина B в позициях 25, 34 и 35. Вместе с тем S- и s-антигенную активность связывают с терминальными пентапептидными участками гликофо-
риновAи B (Daniels [56], Issitt,Anstee [113], Reid, Lomas-Francis [202]).
Антитела анти-S и анти-s встречаются реже по сравнению с анти-М- и анти- N-антителами. Они имеют, как правило, аллогенное происхождение (Sanger [191]). Их обнаруживают у лиц, подвергавшихся гемотрансфузиям, и у женщин, имевших беременности. Описан также случай естественных анти-S-антител
(Constantoulis и соавт. [47]).
Большинство образцов антител к антигенам S и s относится к классу IgG, некоторые содержат фракцию IgM (Garratty [78]). Антитела непосредственно вызывают агглютинацию эритроцитов S + нередко при температуре ниже 37 оС. В отличие от антител к антигенам М и N агглютинины анти-S эффектом дозы не обладают. Отдельные образцы анти-S-антител рН-зависимы и реагируют наиболее интенсивно при рН 6,0. Многие образцы анти-S содержали также специфические антитела к редким антигенам эритроцитов других групповых систем: анти-Wr a, анти-Sw a и др., отнесенных в настоящее время к системе Diego. Большинство из описанных в литературе образцов антител анти-s были IgG, они проявляли активность при 37 оС и лучше всего выявлялись непрямой антиглобулиновой пробой (Beck и соавт. [23]). Естественные анти-s-антитела крайне редки (Lalezari и соавт. [135]).
Протеолитические ферменты, обычно применяемые в иммуносерологии, разрушают антигены S и s.
Антиген S разрушается следовым количеством хлора (Long и соавт. [151]). Известен способ обработки эритроцитов гипохлоритом натрия с целью
454
ингибиции S-антигенной активности. Его используют для дифференциации антител анти-S с антителами другой специфичности (Judd [124]).
Антитела анти-S и анти-s часто выявляют как сопутствующие одновременно с антителами других групповых систем: анти-D, анти-E, анти-c, анти-C W, анти-K, анти-Fy a и анти-Jk a (Gales и соавт. [77]). Описаны аутоантитела анти-S (Fabijanska-Mitek и соавт. [68], Johnson и соавт. [122]).
Антитела к антигенам S и s относят к клинически значимыми (Drachmann
и соавт. [64], Giblett и соавт. [81], Levine и соавт. [144]). Описаны случаи тяжелой ГБН, обусловленной антителами анти-S и анти-s, с летальным исходом (Giblett и соавт. [81]). Поиск совместимых доноров затруднен из-за высокой частоты антигенов S и s. Одновременное присутствие у реципиента других антител еще более осложняет подбор.
Гены, кодирующие гликофорины
Синтез гликофоринов контролируют гены GYPA, GYPB и GYPE, расположен-
ные на хромосоме 4 (4q28.2–q31.1).
Ген GYPA имеет размер 40 тыс. пн и состоит из 7 экзонов (табл. 6.3, рис. 6.2). Экзон 1 контролирует синтез большей части лидер-пептида. Экзон 2 величиной 30 тыс. пн контролирует оставшуюся часть лидер-пептида и первые 26 аминокислот экстрацеллюлярного домена. Экзоны 3 и 4 кодируют экстрацеллюлярный домен, 5 – трансмембранный. Экзон 6 и небольшая часть экзона 7 контролируют синтез цитоплазматического домена гликофорина А, другая, большая часть экзона 7, не транслируется.
|
|
|
|
|
|
Таблица 6.3 |
|
|
Структура генов GYPA, GYPB и GYPE |
|
|||
|
|
|
|
|
|
|
|
GYPA |
|
|
GYPB |
|
GYPE |
A1 |
5'UT,-19 - -8 |
|
B1 |
5'UT, -8 - -19 |
E1 |
5'UT, -19 - -8 |
A2 |
-7-26 |
|
B2 |
-7-26 |
E2 |
-7-26 |
A3 |
27-58 |
|
ΨВ3 |
Псевдоэкзон |
ΨE3 |
Псевдоэкзон |
A4 |
59-71 |
|
B4 |
27-39 |
ΨE4 |
Псевдоэкзон |
A5 |
72-100 |
|
B5 |
40-71 |
E5 |
27-58 |
A6 |
101-126 |
|
B6 |
72, 3'UT |
E6 |
59, 3' UT |
A7 |
127-131, 3'UT |
|
|
|
|
|
Ген GYPВ состоит из 6 экзонов, среди которых 1 представляет собой псевдоэкзон (см. рис. 6.2). Экзоны 1 и 2 GYPВ почти идентичны экзонам 1 и 2 гена GYPА. Экзон 4 GYPВ, имеющий высокую степень гомологии с экзоном 4 GYPА, кодирует антигены S и s. Экзоны 5 и 6 кодируют С-терминальную цепь, часть экзона 6 не транслируется (Storry и соавт. [237]). Псевдоэкзон ΨВ3 не транслируется из-за мутации в участке сплайсинга, поэтому гликофорин В не содержит фрагмента пептидной цепи, имеющегося на гликофорине А в позиции 27– 58. Трансляция псевдоэкзона ΨВ3 происходит в редких случаях, когда в
455
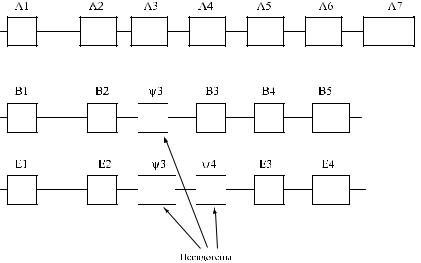
Рис. 6.2. Структура генов гликофорина А, В и Е.
него в результате рекомбинации включен фрагмент GYPА с активным участком сплайсинга (Storry и соавт. [237]).
Ген GYPE включает 4 экзона и 2 псевдоэкзона, обозначаемые буквой Ψ (см. рис. 6.2). Он непосредственно не кодирует каких-либо серологически определяемых продуктов на мембране эритроцитов, однако, как полагают ряд авторов, участвует в рекомбинации генов, что приводит к возникновению новых антигенных свойств (Fukuda [72], Huang и соавт. [97], Khalid и соавт. [130], Palacajornsuk [182]).
Гены GYPA, GYPB и GYPЕ более чем на 90 % гомологичны. Различия между ними выявлены в транслируемых участках. Исследование, выполненное Kudo и соавт. [134], позволило установить, что продуктом гена GYPE является пептидная цепь из 78 аминокислот. Экстрацеллюлярный домен гликофорина Е, несущий антигены М, S или s, имеет мол. массу 17 000 и включает 58 аминокислот с
11О-гликанами.
Три гена расположены в последовательности 5′ GYPA - GYPB - GYPB - 3′ и
гомологичны от фланкирующего участка 5′ до повторяющейся последователь-
ности Alu (Huang и соавт. [97]).
Полиморфизм антигенов системы MNS обусловлен как точковыми мутациями (заменой одного нуклеотида) (табл. 6.4, рис. 6.3), так и более сложными генетическими феноменами: делецией одного или более экзонов, гибридизацией различных участков генов GYPA, GYPB с фрагментами гена GYPE (табл. 6.5). В ряде случаев наблюдали кроссинговер, имеющий неполный характер (Huang
и соавт. [97, 99, 101–107]).
456
|
|
|
|
|
Таблица 6.4 |
Молекулярная основа полиморфизма антигенов системы MN |
|||||
|
|
|
|
|
|
Антиген |
|
Замена аминокислот |
|
Экзоны |
Замена нуклеотидов |
|
|
Гликофорин |
А |
|
|
ENEN / Vw / Hut |
|
Thr 28 Met / Lys |
|
3 |
C 140T |
|
|
T140A |
|||
|
|
|
|
|
|
Vr |
|
Ser 47Tyr |
|
3 |
C 197A |
Mt a |
|
Thr 58 Ile |
|
3 |
C 230T |
Ri a |
|
Glu 57 Lys |
|
3 |
G 226A |
Ny a |
|
Asp 27 Glu |
|
3 |
T138A |
Or |
|
Arg 31Trp |
|
3 |
T148 C |
ERIK |
|
Gly 59Arg |
|
4 |
G 232A |
|
|
|
|
|
|
Os a |
|
Pro 54 Ser |
|
3 |
C 217T |
ENEP / HAG |
|
Ala 65 Pro |
|
4 |
G 250 C |
|
|
|
|
|
|
ENAV / MARS |
|
Glu 63 Lys |
|
4 |
C 244A |
|
|
Гликофорин В |
|
||
S / s |
|
Met 29Thr |
|
4 |
T143 C |
M v |
|
Thr 3 Ser |
|
2 |
C 65 G |
s D |
|
Pro 39Arg |
|
4 |
C 173 G |
Mit |
|
Arg 35 His |
|
4 |
G 161A |
|
|
Нулевые фенотипы |
|
||
M k |
|
ДелециявGYPA(экзоны2–7),GYPB(экзоны1–5)иGYPE (экзон1) |
|||
En(a −) |
|
Делеция в GYPA (экзоны 2–7) и GYPB (экзон 1) |
|||
S–s–U– |
|
Делеция в GYPВ (экзоны 2–4) и GYPЕ (экзон 1) |
|||
Рекомбинации |
иногда затрагивают |
псевдоэкзоны |
и фрагменты интро- |
||
нов GYPA, GYPB и GYPE, в результате чего вновь появившаяся генетическая структура может создавать антигенные варианты (Huang и соавт. [97]). Обнаружены варианты гибридных генов: GYP(А-В-А), GYP(В-А-В), GYP(В- А-В-А), GYP(A-E-A) и др. Их трансляция приводит к заменам аминокислот в различных позициях. Вновь образовавшиеся пептидные цепи одного и того же типа, например GYP(А-В-А), могут отличаться друг от друга. Отдельные фрагменты цепей гликофоринов с измененной последовательностью аминокислот оказываются иммуногенными. Фенотипически это проявляется в виде качественно новых, как правило, редких антигенов системы MNS, которые распознаются специфическими антителами (Huang и соавт. [97, 99, 101–107]). Новые последовательности аминокислот влияют на гликозилирование гликофоринов, что приводит к появлению новых редких специфичностей и сказывается на экспрессии антигенов M, N, S и s. Один из вариантов гибридизации генов приведен на рис. 6.4.
457
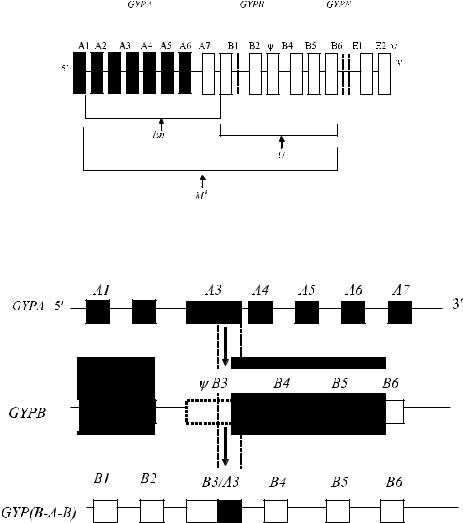
Рис. 6.3. Генетическая основа нулевых фенотипов MNS. Стрелки указывают на участки генов гликофоринов, подвергшиеся делеции (по Daniels [56]). Ψ – псевдогены гликофоринов B и Е.
Рис.6.4.РекомбинациялокусовGYPAиGYPBсобразованиемгибридногогенаGYP(B-A-B). Черными прямоугольниками обозначены экзоны гена гликофорина А, заштрихованными – гена гликофорина В. Белый прямоугольник, обрамленный пунктиром, – псевдоэкзон ΨВ3, частично вовлеченный в гибридный продукт В3 / А3.
458
|
|
|
|
|
|
|
|
|
|
|
|
Табл. 6.5 |
Подсистема Мильтенбергер (варианты гликофоринов и ассоциированных с ними редких антигенов MNS) |
|
|||||||||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
Присутствие в гликофорине антигенов |
|
|
|
||||
Типы |
Типы |
|
|
|
|
|
|
|
|
|
|
|
Mt a |
Vw |
Hut |
Mur |
MUT |
Hil |
TSEN |
MINY |
Hop |
Nob |
DANE |
||
Мильтенбергер |
гликофорина |
|
|
|
|
|
|
|
|
|
|
|
MNS |
MNS |
MNS |
MNS |
MNS |
MNS |
MNS |
MNS |
MNS |
MNS |
MNS |
||
|
|
8 |
9 |
19 |
10 |
35 |
20 |
33 |
34 |
26 |
27 |
32 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Mi.I |
GP.Vw |
+ |
+ |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Mi.II |
GP.Hut |
+ |
0 |
+ |
0 |
+ |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Mi.III |
GP.Mur |
+ |
0 |
0 |
+ |
+ |
+ |
0 |
0 |
0 |
0 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Mi.IV |
GP.Hop |
+ |
0 |
0 |
+ |
+ |
0 |
+ |
+ |
+ |
0 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Mi.V |
GP.Hil |
0 |
0 |
0 |
0 |
0 |
+ |
0 |
0 |
0 |
0 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Mi.VI |
GP.Bun |
+ |
0 |
0 |
+ |
+ |
+ |
0 |
+ |
+ |
0 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Mi.VII |
GP.Nob |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
+ |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Mi.VIII |
GP.Joh |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
+ |
+ |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Mi.IX |
GP.Dane |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
Mi.X |
GP.HF |
+ |
0 |
0 |
+ |
+ |
+ |
0 |
+ |
0 |
0 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Mi.XI |
GP.JL |
0 |
0 |
0 |
0 |
0 |
0 |
+ |
+ |
0 |
0 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Примечание. + антиген присутствует, 0 – отсутствует.
459
Гликофориндефицитные фенотипы
Низкое содержание гликофоринов А и В на эритроцитах обусловлено частичной или полной делецией генов GYPA и GYPB.
GPА-дефицитные фенотипы
En(a −)
В1969 г. Darnborough и соавт. [63] обнаружили в сыворотке крови беременной женщины, англичанки по происхождению, антитела к антигену очень высокой частоты. Исследователи обратили внимание на необычное реагирование эритроцитов женщины и некоторых членов ее семьи. В серологических тестах эритроциты проявляли повышенную агглютинабельность и напоминали клетки, предварительно обработанные протеолитическими ферментами. Авторы предположили, что эти эритроциты, подобно энзимированным, лишены определенного поверхностно расположенного оболочечного вещества, названного ими клеточным конвертом (cell envelope). Новый антиген и выявляющие его антитела обозначены En a и анти-En a соответственно.
Лица редкого фенотипа En(a −) c наличием антител анти-En a вскоре были найдены другими исследователями (Furuhjelm и соавт. [75], Gahmberg и со-
авт. [76], Inglis и соавт. [111], Issitt и соавт. [116], Moulds и соавт. [171], Tanner
исоавт. [244]), в том числе среди японцев (Okubo и соавт. [179]), пакистанцев (Rapmi и соавт. [192]), финнов (Walker и соавт. [255]) и во французскоканадской семье (Taliano и соавт. [243]).
Воснове возникновения редкого фенотипа En(a −) могут лежать разные причины. Одна из них – гомозиготность по редкому гену En, отличающемуся сочетанной делецией экзонов 2–7 гена GYPA и экзона 1 гена GYPB. В результате такой делеции на эритроцитах отсутствует гликофоринA(cell envelope).
Позднее установлено (Daniels [56]), что лица En(a −), выявленные
Darnborough и соавт. [63], имели генотип GYP(A-B)/Mk.
Для дифференциации генных нарушений, приводящих к возникновению фенотипа En(a −), ген En предложено обозначать как En(UK) и En(Fin) – ген En английского и ген En финского типов соответственно (Schenkel-Brunner [223], Walker и соавт. [256]).
На эритроцитах En(a −) отсутствуют антигены, ассоциированные с антигеном М, за исключением антигенов S и s, которые выражены нормально.
Эритроциты En(a −) не содержат антигенов Wr a и Wr b системы Diego, т. е. они одновременноEn(a −)иWr(a −b −)(Issittисоавт.[116]).
Эритроциты En(a −) имеют, как указано выше, характерную особенность. Они, подобно энзимированным эритроцитам, непосредственно агглютинируются в солевой среде сыворотками анти-D, анти-C, анти-c, анти-E, анти-e и другими, содержащими неполные IgG-антитела. Эритроциты обычных людей (En + ) такую способность не проявляют, их мембрана экранирована гликофоринами
460
