
- •1. Основные определения термодинамики.
- •2. Теплота, работа, внутренняя энергия.
- •3. Состояния системы. Уравнения состояния системы.
- •4. Работа и теплота. Свойства работы и теплоты.
- •5. Характеристические функции термодеформационной системы.
- •6. Дифференциальные соотношения термодинамики.
- •7. Классификация теплоемкостей по единицам количества вещества и видам процессов.
- •8. Общая формула теплоёмкостей однородных систем.
- •9. Внутренняя энергия и теплоёмкость идеального газа.
- •10. Зависимость теплоёмкостей от давления и объёма.
- •11. Зависимость теплоёмкости от температуры.
- •12. Вычисление энтропии.
- •13. Уравнения адиабаты идеального газа (Уравнения Пуассона).
- •14. Уравнение адиабаты реального газа в общем виде.
- •15. Политропный (политропический) процесс.
- •16. Теплоёмкость в политропном процессе.
- •17. Работа, теплота и внутренняя энергия в политропном процессе.
- •18. Вычисление энтропии в политропном процессе.
- •20. Второй закон термодинамики.
- •20.2 Прямой необратимый цикл Карно.
- •20.3 Тепловая смерть Вселенной.
- •21. Третий закон термодинамики.
- •22. Газовые смеси
- •22.1 Основные признаки газовых смесей.
- •22.4.1.1. Удельные значения функций и параметров смеси газов
- •22.4.1.2. Мольные значения функций и параметров смеси газов
- •22.4.2. Парциальное давление.
- •22.4.4. Задание состава смеси идеальных газов объемными долями.
- •22.4.5. Формулы пересчета для различных способов задания состава газовых смесей
- •22.4.6. Кажущаяся молекулярная масса смеси газов
- •22.4.7. Газовая постоянная смеси газов
- •22.4.8. Плотность смеси газов
- •22.4.9. Энтропия смеси идеальных газов
- •22.4.10. Теплоемкость газовой смеси
- •22.5 Смешение газов
- •Смешение газовых потоков
10. Зависимость теплоёмкостей от давления и объёма.
Из общей формулы для теплоемкостей реальных и идеальных газов можно получить два соотношения:
 ,
,
 .
.
Выводы из анализа этих соотношений:
-Изохорная
теплоёмкость зависит
от величины
объёма
системы(сv=cv(v)),
если в уравнении состояния газа давление
от температуры зависит
нелинейно,
т.е.
 const.
Если давление газа в уравнении состояния
зависит от температуры линейно, то
cvcv(v).
const.
Если давление газа в уравнении состояния
зависит от температуры линейно, то
cvcv(v).
-Изобарная
теплоёмкость зависит
от величины давления(
cp=cp(p)),
если удельный
объём в уравнении состояния зависит
от температуры
нелинейно,
т.е. при const
. И наоборот,
const
. И наоборот,
при =const. , cpcp(p) .
В последнем случае не нужно опытным путем определять изобарную теплоемкость в лабораторных установках при различных значениях давления.
Для идеального газа
 .и
тогда
.и
тогда
 ,
,
следовательно, изохорная теплоёмкость идеального газа от величины объёма не зависит.
Для идеального газа
 .
и тогда
.
и тогда
 ,
,
следовательно, изобарная теплоемкость идеального газа от величины давления не зависит.
Исследуем
зависимость изохорной теплоёмкости
идеального газа от величины давления,
то есть найдем
 ,
представив ее в виде произведения двух
частных производных
,
представив ее в виде произведения двух
частных производных
 .
Но
.
Но
 ,
а сжимаемость
,то
,
а сжимаемость
,то
 ,
следовательно,
изохорная теплоёмкость идеального газа
от величины давления не зависит.
,
следовательно,
изохорная теплоёмкость идеального газа
от величины давления не зависит.
Исследуем зависимость изобарной теплоемкости идеального газа от величины объема:
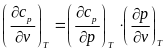 ,
Но
,
Но
![]() ,
а
,
а
 ,
то
,
то

следовательно, изобарная теплоемкость идеального газа от величины давления не зависит.
Общий вывод: изохорная и изобарная теплоёмкости идеального газа зависят только от температуры.
11. Зависимость теплоёмкости от температуры.
Истинная и средняя теплоёмкости.
Исследуем зависимость изохорной и изобарной теплоёмкости реальных и идеальных газов от величины температуры:


Поменять порядок дифференцирования и применить затем дифференциальные соотношения термодинамики не удается, то есть термодинамика на этот вопрос не отвечает.
Вывод: зависимость изохорной и изобарной теплоёмкости реальных и идеальных газов от температуры может быть установлена только опытным путём, либо с помощью какой-либо физической теории.
Опытные значения зависимости теплоёмкости от температуры представляются в виде таблиц, графиков и эмпирических зависимостей. У большинства технических газов cv и cp возрастают с ростом температуры.
Из физики известно, что температура газа не связана колебательным движением атомов и молекул, а зависит от кинетической энергии их поступательного движения. Подводимая к газу теплота по мере роста температуры перераспределяется всё более и более в пользу колебательного движения и поэтому прирост температуры при одинаковом подводе теплоты замедляется.
с



с0
t
Рис.8.
Зависимость теплоемкости от температуры.
На рис.8 опытные данные обозначены в виде звездочек. Сплошная линия – это кривая, аппроксимирующая опытные данные с использованием метода наименьших квадратов или других аналогичных математических методов. Аппроксимирующая кривая подчиняющаяся уравнению
c=c0 + at + bt2 + dt3 +…
Здесь: t-температура в градусах Цельсия ; c0, a, b, d и т.д – эмпирические коэффициенты (коэффициенты, полученные опытным путем). В инженерных расчетах ограничиваются первыми двумя слагаемыми в правой части уравнения, то есть полагают зависимость теплоемкости от температуры линейной:
C = c0 + at
В частности:
-
cv=c0v + at
и
-
cр=c0р + at
Все ранее полученные формулы относятся к истинной теплоемкости, то есть теплоемкости для конкретной (заданной) температуры
В практических расчётах часто требуется знать среднее значение теплоёмкостей в заданном интервале температур от t1 до t2.
Обозначение
средней теплоемкости:
 ,
или
,
или
 .
.
 .
.
 Средняя
теплоемкость определяется как
средняя линия трапеции на рисунке:
Средняя
теплоемкость определяется как
средняя линия трапеции на рисунке:
рис.9.К


или окончательно
|
Рисунок. К определению средней теплоемкости
Конкретные значения эмпирических коэффициентов С0 и а содержатся в справочной литературе по теплофизическим характеристикам веществ.
В тех случаях, когда зависимость теплоёмкости от температуры не удаётся удовлетворительно аппроксимировать линейной зависимостью вида c=c0+at, то следует воспользоваться формулой для нелинейной зависимости:
Для оценочных (не очень точных) расчетов, когда отсутствуют опытные данные для теплоемкости в виде таблиц или эмпирических формул, можно воспользоваться результатами молекулярно-кинетической теории газов, в которой понятию идеального газа соответствуют одноатомные газы при малых давлениях
Из молекулярно-кинетической теории газов известно соотношение U = 12,56T, КДж/кмоль.
Здесь U - внутренняя энергия одного киломоля идеального газа, Т - абсолютная термодинамическая температура, К.
Для массовой изохорной
теплоемкости идеального газа, ранее
было получено:
 Молярная
изохорная изобарную теплоемкость
определяется аналогично:
Молярная
изохорная изобарную теплоемкость
определяется аналогично:

Подставляя в cv значение U = 12,56T получим
cv =12,56, КДж/(кмоль*К)
Молярную изобарную теплоемкость сµp найдем из уравнения Майера:
cp=cv+R=12,56+8,314 20,93 КДж/(кмоль*К)
Как следует из полученных результатов, по молекулярно-кинетической теории газов теплоемкости не зависят от температуры, то есть берутся средним значениеми во всем диапазоне температур. Именно в этом заключается оценочный характер этих значений.
На практике, чаще всего приходится иметь дело с двухатомными, трехатомными и более атомными газами. Воздух считается в инженерных расчетах двухатомным газом, состоящим по объёму на 79% из азота (N2) и на 21% из кислорода (O2).
Для оценочных расчетов можно пользоваться следующей таблицей теплоемкостей идеальных газов:
Газ |
cv,
|
cp, |
Одноатомный |
|
20,93 |
Двухатомный |
|
29,31 |
Трех и более атомный |
29,31 |
37,68 |
В этой таблице, во второй и третьей строках теплоемкости скорректированы по результатам опытов.
У реальных газов, в отличие от идеального, теплоёмкости могут зависеть не только от температуры, но и от объёма и давления.




 12,56
12,56 20,93
20,93