
§ 1. Координационная теория Вернера.
Комплексные – соединения, содержащие сложные ионы и молекулы, способные к существованию как в кристаллическом виде, так и в растворах.
Реагирующие вещества |
Kомплексные соединения |
Kомплексные ионы |
CuSO4 + 4NH3 |
[Cu(NH3)4] SO4 |
[Cu(NH3)4]2+ |
Fe(CN)2 + 4KCN |
K4[Fe(CN)6] |
[Fe(CN)6]4– |
PtCl2 + 2NH3 |
[Pt(NH3)2Cl2] |
– |
Строение комплексных соединений рассматривают на основе координационной теории Вернера.
В соответствии с этой теорией в комплексных соединениях различают комплексообразователь, внешнюю и внутреннюю сферы.
Комплексообразователем обычно является катион или нейтральный атом.
Внутреннюю сферу составляет определенное число ионов или нейтральных молекул, которые прочно связаны с комплексообразователем. Их называют лигандами.
Число лигандов определяет координационное число комплексообразователя (число связей, которые образует комплекообразователь) и дентантность лиганда (число связей, которые образует каждый лиганд).
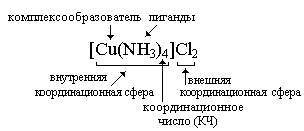
Природа связи между центральным ионом (атомом) и лигандами может быть двоякой. С одной стороны, связь обусловлена силами электростатического притяжения. С другой – между центральным атомом и лигандами может образоваться связь по донорно-акцепторному механизму по аналогии с ионом аммония. Во многих комплексных соединениях связь между центральным ионом (атомом) и лигандами обусловлена как силами электростатического притяжения, так и связью, образующейся за счет неподеленных электронных пар комплексообразователя и свободных орбиталей лигандов.
Если заряд лигандов компенсирует заряд комплексообразователя, то такие комплексные соединения называют нейтральными: они состоят только из комплексообразователя и лигандов внутренней сферы [Pt(NH3)2Cl2].
Лигандами могут быть:
а) полярные молекулы – NH3, Н2О, CO, NO, NH2CH2CH2NH2 (этилендиамин)
б) простые ионы – F–, Cl–, Br –, I–, H–, H+ и т. д.;
в) сложные ионы – CN–, SCN–, NO2–, OH–, SO42–, SO32–, C2O42–
Число связей, которые образует лиганд – дентатность.
Лиганды бывают:
а) монодентатные – NH3, Н2О, CO, NO, CN–, SCN–, NO2–, OH–, F–, Cl–, Br –, I–, H–, H+ и т. д.
б) бидентантные –SO42–, SO32–, C2O42–, NH2CH2CH2NH2
в) полидентантные – этилендиамминтетраацетат, PO43–, порфирин
г) амбидентатные – CN-, NCX-, NO2-, SO32-
Хелатные комплексы – комплексы с полидентантными лигандами содержат циклы, которые включают центральный атом.

К группе хелатов относятся и внутрикомплексные соединения, у которых центральный атом связан с лигандами ковалентной связью по обменному механизму и донорно-акцепторному. Образование внутрикомплексного соединения сопровождается вытеснением из кислых функциональных групп одного или нескольких протонов ионом металла:

§ 2. Номенклатура комплексных соединений.
1) В соединении сначала называют анион, а затем катион.
2) При указании состава внутренней сферы прежде всего называют анионы, прибавляя к латинскому названию суффикс -о-:
CN– – циано;
OH– – гидроксо;
S2– – тио;
NO3– – нитро;
C2О42– – оксалато;
SО42– – сульфато;
S2О32– – тиосульфато;
SО32– – сульфито;
О2– – оксо
3) Далее называют нейтральные лиганды ив первую очередь аммиак и его производные. При этом пользуются терминами:
NH3 – аммин;
Н2О – аква;
NH2CH2CH2NH2 – этилендиаммин;
СО – карбонил и т. д.
4) Затем переходят к названию центрального атома.
Если центральный атом входит в состав катионов, то используют русское название соответствующего элемента и в скобках указывают его степень окисления (римскими цифрами).
Если центральный атом содержится в анионе, тоупотребляют латинское название элемента, а в конце прибавляют окончание -ат.
5) Название комплексного иона пишут в одно слово. Степень окисления центрального атома обозначают римской цифрой, помещенной в круглые скобки.
[Cu(NH3)4]Cl2 – хлорид тетраамминмеди (II), [Co(NH3)3H2OCl2]NO3 – нитрат дихлороакватриамминкобальта (III), K3[Fe(CN)6] – гексацианоферрат (III)калия, K2[PtCl4] – тетрахлороплатинат (II)калия, [Zn(NH3)4Cl2] – дихлоротетраамминцинк, H2[PtCl6] – гексахлороплатинат (IV) водорода
