
7. Реакции ионного обмена. Диссоциация.
1. Напишите уравнения диссоциации для следующих соединений: серная кислота, гидроксид аммония, хлорид железа (III), сульфат натрия, уксусная кислот, карбонат калия, фосфорная кислота, гидрофосфат калия.
2. Написать в ионно-молекулярной форме уравнения реакций:
![]() →
→
Na2S + H2SO4 →
3. Написать в ионно-молекулярной форме уравнения реакций между:
а) гидроксидом калия и серной кислотой;
б) хлоридом аммония и гидроксидом натрия;
4. Написать в ионно-молекулярной форме уравнения реакций:
![]() →
→
![]() →
→
5. Написать в ионно-молекулярной форме уравнения реакций между:
в) гидроксидом железа (III) и соляной кислотой;
б) йодидом калия и нитратом свинца (II)
6. Какое значение рН имеет раствор, в 500 мл которого растворено 1,825 г соляной кислоты.
7. Написать уравнения реакций в молекулярном виде, полном ионном виде и сокращенном ионном виде:
![]()
![]()
8. По ионной форме уравнения составить уравнение в молекулярном виде:
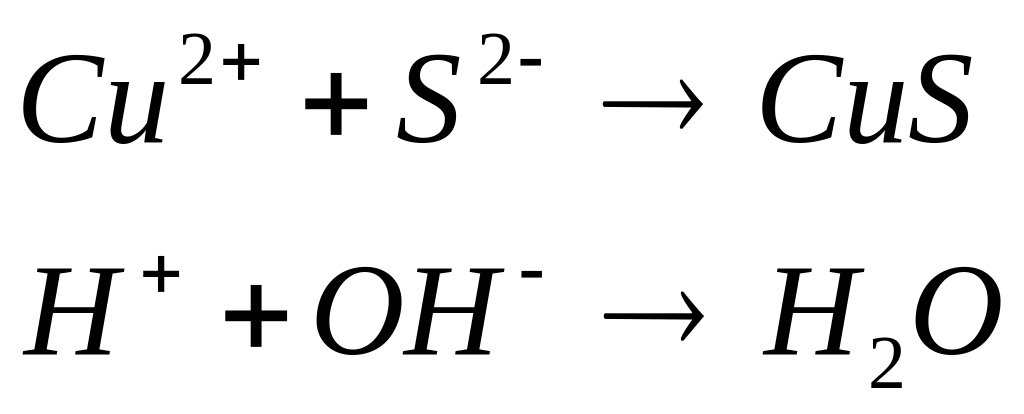
9. Написать в ионно-молекулярной форме уравнения реакций:
К2S + H2SO4 →
FeS + HCl →
10. Написать уравнения гидролиза нитрата меди (II) и сульфита натрия. Определить характер среды.
11. Какие из солей подвергаются гидролизу: сульфат алюминия, сульфид калия, нитрат свинца(II), хлорид калия? Составьте молекулярные и ионные уравнения гидролиза соответствующих солей, определите рН.
12. Определить рН
0,01н. раствора азотистой кислоты, если
степень диссоциации азотистой кислоты
![]() .
.
13. Написать в ионно-молекулярной форме уравнения реакций между:
а) нитратом бария и серной кислотой;
б) хлоридом железа (III) и гидроксидом аммония.
14. Рассчитайте концентрацию ионов H+ (моль/л) в растворе с рН = 2.
15. рН раствора гидроксида натрия равен 12, степень диссоциации 100%. Рассчитайте концентрацию NaOH (моль/л).
8. Окислительно-восстановительные реакции
Определите степени окисления элементов в соединениях, имеющих формулы:. SO3, P2O5 , K2Cr2O7, HNO3, HNO2, KMnO4.
Методом электронного баланса расставьте коэффициенты в уравнении реакции:
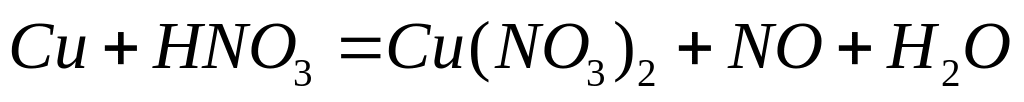
3. Могут ли происходить окислительно-восстановительные реакции между следующими веществами и почему:
а) NH3 и KMnO4
б) HNO2 и HI
в) HCl и H2Se
4. Методом электронного баланса расставьте коэффициенты в уравнении реакции: КМnO4 + KNO2 + H2SO4 = MnSO4 + KNO3 + K2SO4 + Н2О
5. Методом электронного баланса расставьте коэффициенты в уравнении реакции: HNO3 + Ca = NH4NO3 + Ca(NO3)2 + H2O
6. Методом электронного баланса расставьте коэффициенты в уравнении реакции: KClO3 + FeSO4 + H2SO4 = KCl + Fe2(SO4)3 + H2O
7. Методом электронного баланса расставьте коэффициенты в уравнении реакции: Cu + H2SO4 = CuSO4 + SO2 + H2O
8. Определите степени окисления элементов в соединениях:
а) сернистая кислота
б) нитрат аммония
в) хромат калия
г) азотная кислота
Какие окислительно-восстановительные свойства они проявляют в реакциях?
9. Методом электронного баланса расставьте коэффициенты в уравнении реакции: HCl + CrO3 = CrCl3 + Cl2 + H2O
10. Методом электронного баланса расставьте коэффициенты в уравнении реакции: K2Cr2O7 + H2S + H2SO4 = Cr2(SO4)3 + S + K2SO4 + H2O
11. Определите степени окисления элементов в соединениях:
а) серная кислота
б) нитрит калия
в) дихромат натрия
г) азотистая кислота
Какие окислительно-восстановительные свойства они проявляют в реакциях?
12. Методом электронного баланса расставьте коэффициенты в уравнении реакции: I2 + KOH = KIO3 + KI + H2O
13. Методом электронного баланса расставьте коэффициенты в уравнении реакции: KMnO4 + MnSO4 + H2O = MnO2 + K2SO4 + H2SO4
14. Методом электронного баланса расставьте коэффициенты в уравнении реакции: SO2 + Br2 + H2O = HBr + H2SO4
15. Методом электронного баланса расставьте коэффициенты в уравнении реакции: FeCl3 + H2S = FeCl2 + S + HCl
