- •1.6 Изменение внутренней энергии рабочего тела.
- •Теплоемкость. Использование теплоемкости для описания процессов в закрытых системах
- •Связь теплоемкости с термодинамическими функциями
- •Теплоемкости реальных газов
- •Истинная и средняя теплоемкости
- •Связь между различными видами теплоемкостями.
- •Зависимость теплового эффекта химической реакции от температуры
- •1.3.3 Влияние температуры на тепловой эффект
- •Теплоёмкость смеси рабочих тел (газовой смеси)
Связь теплоемкости с термодинамическими функциями
Внутренняя энергия системы может изменяться в результате теплообмена. Т.е., если к системе подводится теплота в количестве dQ, а работа не производится dW = 0, то согласно I закона термодинамики
dU = dQ – dW = dQ
dU = dQ (6.32)
Теплота - способ изменения внутренней энергии системы без изменения внешних параметров (dV = 0 ® dW = 0), это микроскопический способ преобразования энергии.
При поглощении системой некоторого количества теплоты dQ внутренняя энергия ее увеличивается на величину dU (согласно формуле (6.32.)). Возрастание внутренней энергии ведет к увеличению интенсив-ности движения частиц, составляющих систему. Согласно выводам статистической физики средняя скорость движения молекул связана с температурой
![]()
Т.е. поглощение системой некоторого количества теплоты dQ ведет к увеличению температуры системы на величину dT, пропорциональную dQ.
dT = const.dQ (6.33)
Соотношение (6.33) можно переписать в другом виде:
dQ
= C.dT
или ![]() ,
(6.34)
,
(6.34)
где С – константа, называемая теплоемкостью системы.
Итак, теплоемкость – это количество теплоты, необходимое для нагревания термодинамической системы на один градус по шкале Кельвина.
Теплоемкость системы зависит от:
а) состава и температуры системы;
б) размера системы;
в) условий, при которых происходит переход теплоты.
|
|
|
|

Схема 6.6. Виды теплоемкости
Т.е. С (теплоемкость), как и Q, является функцией процесса, а не состояния и относится к экстенсивным параметрам.
По количеству нагреваемого вещества различают:
1) удельную теплоемкость Суд, отнесенную к 1 кг или 1 г вещества;
2) молярную (мольную) теплоемкость См, отнесенную к 1 моль вещества.
Размерность {Суд} = Дж/г .К
{См} = Дж/моль . К
Между удельной и молярной теплоемкостями имеется соотношение
См = Суд . М, (6.35)
где М – молярная масса.
При описании физико-химических процессов обычно пользуются молярной теплоемкостью См (в дальнейшем индекс писать не будем).
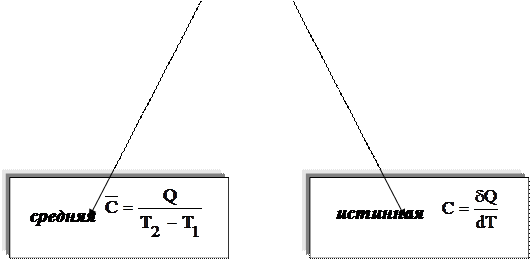
Различают также среднюю и истинную теплоемкости.
Средняя
теплоемкость ![]() –
это отношение некоторого количества
теплоты к разности температур
–
это отношение некоторого количества
теплоты к разности температур
 (6.36)
(6.36)
Истинной теплоемкостью С называют отношение бесконечно малого количества теплотыdQ, которое нужно подвести к одному моль вещества, к бесконечно малому приращению температуры – dT.

Установим связь между истинной и средней теплоемкостями.
Во-первых, ![]()
Во-вторых,
выразим Q из формулы (6.36) ![]() (6.37).
С другой стороны из формулы (6.34) ® dQ = CdT
(6.38). Проинтегрируем (6.38) в интервале
T1 -
T2 и
получим
(6.37).
С другой стороны из формулы (6.34) ® dQ = CdT
(6.38). Проинтегрируем (6.38) в интервале
T1 -
T2 и
получим
 (6.39)
(6.39)
Приравняем правые части выражений (6.37) и (6.39)
Отсюда  (6.40)
(6.40)
Это
уравнение связывает среднюю теплоемкость ![]() с
истинной С.
с
истинной С.
Среднюю теплоемкость рассчитывают в интервале температур от Т1 до Т2. Нередко интервал выбирают от ОК до Т, т.е. нижний предел Т1 = ОК, а верхний имеет переменное значение, т.е. от определенного интервала перейдем к неопределенному. Тогда уравнение (6.40) примет вид:
 (6.41)
(6.41)
Расчет можно провести графически, если известны значения истинной теплоемкости при нескольких температурах. Зависимость С = f(T) представлена кривой АВ на рис. 1.
|
|
|
|
Рис. 6.7. Графическое определение средней теплоемкости
Интеграл в выражении (6.40) представляет собой площадь фигуры Т1АВТ2.
Таким образом, измерив площадь, определяем
 (6.42)
(6.42)
Рассмотрим значение теплоемкости системы при некоторых условиях:
а) V = сonst
Согласно I закону термодинамики dQV = dU. Для простых систем внутренняя энергия является функцией объема и температуры U = U (V,T)

Теплоемкость в этих условиях
 (6.43)
(6.43)
б) p = const
dQp = dH. Для простых систем H = H(p,T);

Теплоемкость
 (6.44)
(6.44)
Ср и СV - теплоемкости при постоянных p и V.
Если рассматривать 1 моль вещества т.е. Ср и СV - молярные теплоемкости
dQV = CVdT, dQp = CpdT (6.45)
Для «n» моль вещества dQV = nCVdT, dQp = nCpdT
Исходя из выражения (6.45), находим
 (6.46)
(6.46)
Зная зависимость теплоемкости вещества от температуры, по формуле (6.46) можно вычислить изменение энтальпии системы в интервале Т1¸Т2. В качестве базовой температуры выбирается Т1 = ОК или 298,15 К. В этом случае разность энтальпий Н(Т) – Н(298) называется высокотемпературной составляющей энтальпии.
Найдем связь между Ср и СV. Из выражений (6.43) и (6.44) можно записать:


Из I закона термодинамики с учетом только механической работы для простой системы, для которой U = U(V,T)
dQ
= dU + pdV = 
т.е.  (6.49)
(6.49)
Подставим dQ из выражения (6.46) в (6.48) и (6.49) и получим:

Для простой системы объем можно рассматривать как функцию давления и температуры, т.е.
V
= V(p,T) ® dV = 
при
условии p = const dp = 0, 
т.е. 
Отсюда  ,
,
Таким
образом  (6.51)
(6.51)
Для
1 моль идеального газа pV = RT, 
 Cp –
CV =
Cp –
CV = 
Для 1 моль реального газа и применение уравнения Ван-дер-Ваальса приводит к следующему выражению:
Cp–
CV= 
Для
реальных газов Сp –
CV >
R. Эта разность увеличивается по мере
увеличения давления, т.к. с увеличением
давления растет  ,
связанное со взаимодействием молекул
реального газа друг с другом.
,
связанное со взаимодействием молекул
реального газа друг с другом.
Для твердого тела при обычной температуре Сp – CV < R и составляет примерно 1 Дж/(моль . К). с понижением температуры разность Сp – CV уменьшается и при Т ® ОК Сp – CV ® 0.
Теплоемкость обладает свойством аддитивности, т.е. теплоемкость смеси двух веществ
 (6.52)
(6.52)
В общем случае
 ,
,
где xi - доля веществ «I» в смеси.
Теплоемкость является одной из важнейших термодинамических характеристик индивидуальных веществ.
В настоящее время имеются точные методы измерения теплоемкости в широком интервале температур. Достаточно удовлетворительно разработана теория теплоемкости для простого твердого вещества при невысоких давлениях. Согласно молекулярно-кинетической теории теплоемкости для одного моль газа на каждую степень свободы приходится R/2. Т.е. поскольку молярная теплоемкость идеального газа при постоянном объеме
CV = Cn + Cв + Cк + Сэ, (6.53)
где Cn – теплоемкость газа, связанная с поступательным движением молекул,
Св – с вращательным,
Ск – с колебательным,
а Сэ – с электронными переходами, то для одноатомного идеального газа СV = 3/2R,
для двухатомных и линейных трехатомных молекул
CV = 5/2R + Cк
для нелинейных многоатомных молекул
CV = 3R + Ск
Теплоемкость Ск, связанная с колебательным движением атомов в молекуле, подчиняется законам квантовой механики и не отвечает закону равномерного распределения энергии по степеням свободы.
Сэ в формуле (6.53) не принимается во внимание, Сэ – это теплоемкость, связанная с электронными переходами в молекуле. Переход электронов на более высокий уровень под действием теплообмена возможен лишь при температурах выше 2000 К.
Теплоемкость твердых веществ с атомной кристаллической решет-кой можно вычислить по уравнению Дебая:
CV =
CД(х), ![]() ,
,
где q – характеристическая температура;
nm – максимальная характеристическая частота колебания атомов в молекуле.
При повышении температуры CV твердых веществ с атомной кристаллической решеткой стремится к предельному значению CV ® 3R. При очень низких температурах
CV ~ T3 (T < q/12).
Теплоемкости Ср по опытным значениям CV (или наоборот) для веществ с атомной кристаллической решеткой можно рассчитать по уравнению:
Cp =
СV (1
+ 0,0214CV ![]() )
)
Для сложного твердого или жидкого вещества хорошей теории пока не существует. Если экспериментальные данные по теплоемкости отсутствуют, то ее можно оценить с помощью эмпирических правил
1) Правило Дюлонга и Пти: атомная теплоемкость при постоянном объеме для любого простого твердого вещества приблизительно равна 25 Дж/(моль.К)
Правило выполняется при высоких температурах (близких к температуре плавления твердого вещества) для элементов, атомная масса которых больше, чем у калия. Как показал Больцман, оно может быть качественно обосновано кинетической теорией:
CV » 25 Дж/(моль.К)(3R)
2) Правило Неймана-Коппа (правило аддитивности) основывается на предположении о неизменяемости теплоемкости элементов при образовании химических связей
Ссв-ва = 25n
где n – число атомов, входящих в молекулу.
Более близкие к экспериментальным значениям теплоемкости получаются по правилу Неймана-Коппа, если принять для легких элементов значения атомных теплоемкостей представленные в табл. 6.1.
Таблица 6.1.
Значения атомных теплоемкостей для легких элементов
Элемент |
C |
H |
B |
Si |
O |
F |
S |
P |
Ср0, Дж/(моль.К) |
7,53 |
9,62 |
11,3 |
15,9 |
16,74 |
20,92 |
22,59 |
23,01 |
Для остальных элементов Cp0 » 25,94 Дж/(моль.К).
3) Правило аддитивности лежит в основе формулы Келли, которая справедлива для высококипящих чистых неорганических жидкостей (BeO, BeCl2, MgBr2 и др.):
Ср = 32,43n;
где n – число атомов в молекуле, входящих в молекулу неорганического вещества.
У расплавленных элементов с d- и f-электронами Сат достигает 42¸50 Дж/(моль.К).
4) Приближенный метод расчета для органических жидкостей, использующий атомно-групповые составляющие теплоемкостей
![]()
Последние получены при анализе опытных данных большого числа соединений, некоторые из которых сведены в табл. 6.2.
Таблица 6.2.
Некоторые значения атомно-групповых составляющих теплоемкостей
Атом или группа |
Ср, Дж/(моль.К) |
Атом или группа |
Ср, Дж/(моль.К) |
–СН3 |
41,32 |
–О– |
35,02 |
–СН2– |
26,44 |
–S– |
44,35 |
|
22,68 |
–Cl |
35,98 |
–СN |
58,16 |
–Br |
15,48 |
–ОН2 |
46,02 |
C6H5– |
127,61 |
|
60,75 |
–NH2(амины) |
63,6 |
С=О(кетоны) |
61,5 |
–NO2 |
64,02 |
Зависимость теплоемкости от температуры
Теплоемкость твердых, жидких и газообразных веществ повышается с температурой. Только теплоемкости одноатомных газов практически не зависят от Т (например, He, Ar и другие благородные газы). Наиболее сложная зависимость С(Т) наблюдается у твердого вещества. Зависимость С(Т) изучается экспериментально, т.к. теория недостаточно разработана.
Обычно зависимость атомной и молярной теплоемкости от температуры выражается в виде интерполяционных уравнений.
Ср = а + в .Т + с .Т2 (для органических веществ) (6.53)
Ср = а + в .Т + с/ .Т-2 (для неорганических веществ)
Коэффициенты а, в, с, с/ - постоянные величины, характерные для данного вещества вычисляются на основании экспериментальных данных и справедливы в определенном интервале температур.
Теплоемкость - ϶ᴛᴏ свойство тел поглощать и выделять теплоту при изменении температуры на один градус в различных термодинамических процессах. Различают общую среднюю и общую истинную теплоемкости.
Общая средняя теплоемкость термодинамического процесса (ТП) - ϶ᴛᴏ теплоемкость тела массой m, кг за конечный отрезок ТП:
![]() ,
[Дж/К].
,
[Дж/К].
Общая истинная теплоемкость ТП - ϶ᴛᴏ теплоемкость тела массой m, кг в каждый данный момент ТП:
![]() ,
[Дж/К].
,
[Дж/К].
Рассмотрим
произвольный ТП 1-2 в координатах ![]() ,
где Q –
подведенная теплота в [Дж]; t –
температура в [0C].
Тогда
,
где Q –
подведенная теплота в [Дж]; t –
температура в [0C].
Тогда ![]() ,
, ![]() .
.

В случае если ТС – однородное рабочее тело, то в расчетах применяются относительные теплоемкости:
- удельная теплоемкость – теплоемкость, отнесенная к 1 кг вещества с=С/m, Дж/кгК;
-
молярная теплоемкость – теплоемкость,
отнесенная с 1 молю вещества ![]() ,
Дж/мольК;
,
Дж/мольК;
-
объёмная теплоемкость – теплоемкость,
отнесенная к 1м3 вещества ![]() ,
Дж/м3К.
,
Дж/м3К.
Теплоемкость – функция процесса и зависит от рода рабочего тела, характера процесса и параметров состояния. Так, теплоемкость в процессе с постоянным давлением принято называть изобарной теплоемкостью:
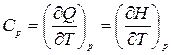 ,
,
где H, Дж – энтальпия.
Теплоемкость в процессе с постоянным объёмом принято называть изохорной теплоемкостью:
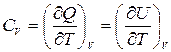 ,
,
где U, Дж – внутренняя энергия.
Теплоемкость
идеального газа не зависит от температуры
и давления и зависит только от числа
степеней свободы движения молекул и в
соответствии с законом о равном
распределении энергии по степеням
свободы движения молекул теплоемкость: ![]() ,
где
,
где ![]() -
вращательные степени свободы, равные
для одноатомного газа нулю
-
вращательные степени свободы, равные
для одноатомного газа нулю ![]() ,
для двухатомного газа -
=2
и для трехатомных газов
=3;
,
для двухатомного газа -
=2
и для трехатомных газов
=3; ![]() Дж/мольК
– молярная газовая постоянная.
Теплоемкость
Дж/мольК
– молярная газовая постоянная.
Теплоемкость ![]() определяется
по уравнению Майера:
определяется
по уравнению Майера:
![]() .
.
Для
одноатомного газа ![]() и
и ![]() ,
для двухатомного газа
,
для двухатомного газа ![]() и
и ![]() ,
для трех и более атомных газов
,
для трех и более атомных газов ![]() и
и ![]() .
.
Теплоемкость реальных газов зависит от давления и температуры. В ряде случаев можно пренебречь влиянием давления на теплоемкость и принять, что теплоемкость реальных газов зависит только от температуры: C=f(t). Эта зависимость определяется экспериментально.
Эмпирическая зависимость удельной истинной теплоемкости от температуры должна быть представлена в виде многочлена:
![]() ,
Дж/кгК,
,
Дж/кгК,
где ![]() при
температуре t=00C.
Для двухатомных газов можно ограничиться
двумя слагаемыми:
при
температуре t=00C.
Для двухатомных газов можно ограничиться
двумя слагаемыми: ![]() ,
или
,
или ![]() ,
где
,
где ![]() .
.
Для конечного участка процесса 1-2 количество теплоты равно:
![]() .
.
Тогда средняя теплоемкость на этом участке процесса будет равна:
![]() ,
Дж/кгК.
,
Дж/кгК.
В области низких температур при Т<100К прекращается вращательное движение молекул и колебательное движение атомов, а при температуре Т→0К прекращается и поступательное движение молекул, ᴛ.ᴇ. при Т=0К Ср=Cv=0 и прекращается тепловое движение молекул (опытные данные Нернста и др., 1906-1912гᴦ.). При температуре Т→0К свойства веществ перестают зависеть от температуры, как это иллюстрируется на приведенном графике зависимости теплоемкости от абсолютной температуры.