
- •Физические основы термодинамики
- •1. Первое начало термодинамики
- •§1. Внутренняя энергия
- •§2. Теплота и работа
- •§3 I начало термодинамики
- •§2 Число степеней свободы молекулы. Закон о равномерном распределении энергии по степеням свободы молекулы
- •§3 Теплоемкость. Работа газа
- •9.3. Работа газа при его расширении
- •Основные понятия термодинамики.
- •Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы.
- •Внутренняя энергия и работа газа при расширении. закон термодинамики.
- •Теплоемкость
9.3. Работа газа при его расширении
Рассмотрим
сжатие идеального газа, находящегося
под поршнем (рис.9.1). Под действием внешней
силы
![]() переместим
поршень на бесконечно малую величину
,
настолько малую, что будем считать силу
постоянной.
Назовём работу постоянной силы по
перемещению поршня на бесконечно малую
величину элементарной
работой
и обозначим
переместим
поршень на бесконечно малую величину
,
настолько малую, что будем считать силу
постоянной.
Назовём работу постоянной силы по
перемещению поршня на бесконечно малую
величину элементарной
работой
и обозначим
![]() .
.
![]() Элементарная
работа может быть определена как работа
постоянной силы через скалярное
произведение силы на перемещение:
Элементарная
работа может быть определена как работа
постоянной силы через скалярное
произведение силы на перемещение:
![]() (9-6)
(9-6)
Поскольку
направление силы и перемещения совпадают,
то
![]() .
Газ, находящийся под поршнем, препятствует
сжатию и давит на поршень силой
.
Газ, находящийся под поршнем, препятствует
сжатию и давит на поршень силой
![]() ,
равной по величине, противоположной по
направлению и приложенной к поршню
(рис.4.1). Элементарная работа самого газа
,
равной по величине, противоположной по
направлению и приложенной к поршню
(рис.4.1). Элементарная работа самого газа
![]() .
Так как сила
.
Так как сила
![]() и
перемещение
и
перемещение
![]() направлены
в противоположные стороны, работа самого
газа при равномерном сжатии отрицательна
и равна по величине работе внешней силы,
сжимающей газ
направлены
в противоположные стороны, работа самого
газа при равномерном сжатии отрицательна
и равна по величине работе внешней силы,
сжимающей газ
![]() .
Сила, действующая на единицу площади
поверхности поршня S со стороны газа,
есть давление газа Р. Поэтому можно
выразить величину силы
.
Сила, действующая на единицу площади
поверхности поршня S со стороны газа,
есть давление газа Р. Поэтому можно
выразить величину силы
![]() через
давление:
через
давление:
![]() .
Тогда элементарная работа газа будет
равна:
.
Но
есть
величина приращения объёма газа. Тогда
элементарная работа газа равна:
.
Тогда элементарная работа газа будет
равна:
.
Но
есть
величина приращения объёма газа. Тогда
элементарная работа газа равна:
![]() ,
(9-7)
,
(9-7)
а
работа внешней силы по сжатию газа равна
![]() .
.
Для
определения работы по перемещению
поршня на значительную величину
![]() ,
в результате которой объём газа изменяется
на
,
в результате которой объём газа изменяется
на
![]() ,
нужно учесть процесс, происходящий с
газом. Работу в этом случае определяют
через интеграл:
,
нужно учесть процесс, происходящий с
газом. Работу в этом случае определяют
через интеграл:
 (9-8)
(9-8)
Работа газа (или над газом) зависит от процесса (т.е. от последовательности промежуточных состояний) и поэтому является функцией процесса. Работа не является полным дифференциалом, отсюда и обозначение элементарной работы , а не dA.
 Рассмотрим
работу, совершаемую газом, при различных
процессах. Будем обозначать в дальнейшем
элементарную работу газа просто через
и
считать её положительной, если газ
расширяется (
Рассмотрим
работу, совершаемую газом, при различных
процессах. Будем обозначать в дальнейшем
элементарную работу газа просто через
и
считать её положительной, если газ
расширяется (
![]() ),
и отрицательной, если газ сжимают (
),
и отрицательной, если газ сжимают (
![]() ).
).
Рассмотрим изохорический процесс. При изохорическом процессе объём газа не изменяется, приращение объёма равно нулю, следовательно, работа газа равна нулю.
Поскольку работу в любом случае можно определить, пользуясь формулой (9-8), для математической интерпретации работы удобно изображать любой процесс на диаграмме (P,V) . Работа на такой диаграмме равна площади фигуры под кривой, изображающей тот или иной процесс, происходящий с газом.
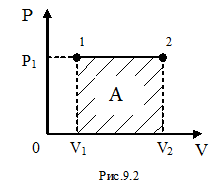
Рассмотрим изобарический процесс (рис. 9.2). Используя формулу (9-8) найдём работу газа при переходе из состояния 1 в состояние 2: .
Так как для данного количества вещества давление остаётся постоянным при изобарическом процессе, то его можно вынести за знак интеграла, тогда получим :
 .
Обозначим
.
С учётом этой записи работа при
изобарическом процессе определяется
по формуле:
.
Обозначим
.
С учётом этой записи работа при
изобарическом процессе определяется
по формуле:
![]() (9-9)
(9-9)
Используя
рис.9.2, можно записать работу через
указанные параметры состояния:
![]() .
Такую же формулу мы получим, находя
площадь заштрихованного прямоугольника.
Часто бывает удобно выражать работу
через изменение температуры. Для этого
нужно использовать уравнение состояния
идеального газа (уравнение Менделеева
– Клапейрона) для 1 и 2 состояний:
.
Такую же формулу мы получим, находя
площадь заштрихованного прямоугольника.
Часто бывает удобно выражать работу
через изменение температуры. Для этого
нужно использовать уравнение состояния
идеального газа (уравнение Менделеева
– Клапейрона) для 1 и 2 состояний:
![]() и
и
![]() .
Вычитая из второго уравнения первое,
получим:
.
Вычитая из второго уравнения первое,
получим:
![]() (9-10)
(9-10)
При изобарическом сжатии конечный объём меньше начального и работа газа отрицательна, то есть газ препятствует сжатию.
Формула
(9-7) позволяет выразить физический смысл
молярной постоянной R . Для одного моля
вещества (
![]() )
работа определяется как
)
работа определяется как
![]() .
Отсюда ясен физический
смысл R
, которая определяется работой
изобарического расширения одного моля
идеального газа при изменении температуры
на один кельвин.
.
Отсюда ясен физический
смысл R
, которая определяется работой
изобарического расширения одного моля
идеального газа при изменении температуры
на один кельвин.
 Рассмотрим
изотермический
процесс
(рис.9.3). При изотермическом процессе
температура остаётся постоянной, а
давление и объём связаны между собой
обратно пропорциональной зависимостью.
В этом случае, используя формулу (9-8) для
определения работы, уже нельзя вынести
давление за знак интеграла. Давление
выразим из уравнения Менделеева –
Клапейрона:
.
Подставим правую часть этого уравнения
в (9-8) и вынесен за знак интеграла все
постоянные:
Рассмотрим
изотермический
процесс
(рис.9.3). При изотермическом процессе
температура остаётся постоянной, а
давление и объём связаны между собой
обратно пропорциональной зависимостью.
В этом случае, используя формулу (9-8) для
определения работы, уже нельзя вынести
давление за знак интеграла. Давление
выразим из уравнения Менделеева –
Клапейрона:
.
Подставим правую часть этого уравнения
в (9-8) и вынесен за знак интеграла все
постоянные:
. Учитывая, что разность логарифмов есть логарифм отношения, получим:
(9-11)
Используя закон Бойля- Мариотта: , можем выразить работу и через отношение давлений:
![]() (9-12)
(9-12)
Рассмотренные примеры подтверждают, что работа является функцией процесса.
Первое начало термодинамики
Первое начало термодинамики учитывает энергетический баланс системы. В этом суть первого начала термодинамики. Можно сказать, что первое начало термодинамики является законом сохранения энергии для термодинамических систем.
Для
элементарного процесса первое начало
термодинамики можно записать следующим
образом:
![]() .
Работа самого газа связана с работой
внешних сил равенством
.
Работа самого газа связана с работой
внешних сил равенством
![]() .
Тогда математическая запись первого
начала термодинамики будет иметь вид:
.
Тогда математическая запись первого
начала термодинамики будет иметь вид:
![]() .
Однако в тех случаях, когда происходит
теплообмен и система получает (или
отдаёт тепло), удобно записывать первое
начало в виде:
.
Однако в тех случаях, когда происходит
теплообмен и система получает (или
отдаёт тепло), удобно записывать первое
начало в виде:
![]() (9-13)
(9-13)
Распределение энергии по степеням свободы молекулы
Чтобы разобраться в связи температуры с внутренней энергией, повторим введенное ранее в механике понятие — число степеней свободы.
Число степеней свободы механической системы — это минимальное число независимых скалярных величин, задание значений которых необходимо для однозначного определения конфигурации системы. |
В § 1.3 было показано, что давление газа численно равно импульсу, который передается за единицу времени единице площади стенки в результате ударов по ней молекул, поэтому давление определяется средней энергией только поступательного движения молекул.
Поступательное
движение любой системы «как целого»
полностью определяется движением одной
единственной точки: её центра масс. В
частности, полный импульс
![]() любой
нерелятивистской системы, равен
произведению массы
любой
нерелятивистской системы, равен
произведению массы
![]() этой
системы на скорость
этой
системы на скорость
![]() движения
её центра масс. Энергия поступательного
движения системы «как целого» равна
движения
её центра масс. Энергия поступательного
движения системы «как целого» равна
![]() .
Поэтому, для полного описания
поступательного движения любой системы
в трехмерном
пространстве необходимо и достаточно
задание значений трех
координат центра масс. Таким образом,
поступательному движению, как бы ни
была устроена система, всегда соответствуют
три поступательных степени свободы:
.
Поэтому, для полного описания
поступательного движения любой системы
в трехмерном
пространстве необходимо и достаточно
задание значений трех
координат центра масс. Таким образом,
поступательному движению, как бы ни
была устроена система, всегда соответствуют
три поступательных степени свободы:
![]() .
.
Можно сказать и так: «с точки зрения поступательного движения» любая система может быть точно, а не приближенно, представлена в виде одной единственной материальной точки совпадающей с центром масс системы и имеющей массу равную массе системы (рис. 1.15).

