
- •Стаціонарний стан в якому досягнута повна однорідність всіх параметрів системи і відсутні будь-які потоки має назву рівноважного стану тд-системи.
- •Всі, без виключення, внутрішні тд-параметри системи є функціями температури системи та зовнішніх параметрів.
- •Перший закон термодинаміки
- •Термодинамічні процеси: ізотермічний, ізохорний, ізобарний
- •Таким чином, для збільшення об’єму газу від v1 до v2 при сталій температурі необхідно системі передати кількість теплоти:
- •Теплоємності ідеального газу. Рівняння Майєра
- •Адіабатичний і політропічний процеси
- •Другий закон термодинаміки
- •„Будь-які спонтанні процеси в замкненій термодинамічній системі можуть відбуватися лише за умови, що ентропія системи при цьому не зменшується” :
- •Теплові двигуни та холодильні машини
- •Література
„Будь-які спонтанні процеси в замкненій термодинамічній системі можуть відбуватися лише за умови, що ентропія системи при цьому не зменшується” :
|
(50) |
Знак нерівності у (50) стосується нерівноважних термодинамічних процесів, знак рівності – рівноважних. Твердження (50) є однією з форм другого закону термодинаміки.
Другий
закон термодинаміки, таким чином,
регламентує ті термодинамічні процеси,
які можуть відбуватися у замкненій
термодинамічній системі без впливу
ззовні, тобто відбуватися невимушено,
спонтанно. Чи можливі процеси протилежні
(50), в яких ентропія системи зменшується
(![]() ),
а сама система переходить з більш
ймовірного до менш ймовірного
термодинамічного стану? Принципово
такі термодинамічні процеси можливі,
вони не є забороненими законами
термодинаміки. Втім вони не можуть
відбуватися у замкненій ТД-системі
спонтанно, отже, потребують зовнішнього
впливу на термодинамічну систему.
),
а сама система переходить з більш
ймовірного до менш ймовірного
термодинамічного стану? Принципово
такі термодинамічні процеси можливі,
вони не є забороненими законами
термодинаміки. Втім вони не можуть
відбуватися у замкненій ТД-системі
спонтанно, отже, потребують зовнішнього
впливу на термодинамічну систему.
Зауважимо, що для замкненої ТД-системи, що складається, припустимо, з двох підсистем, і під час спонтанного процесу з другого закону термодинаміки виникає:
|
(51) |
тому, що ентропія системи є сумою ентропій її підсистем (ентропія є екстенсивною, тобто адитивною величиною). Проте, в замкненій термодинамічній системі додатково маємо:
|
(52) |
Отже:
|
(53) |
Припустимо,
що
![]() тобто тепло отримує перша система від
другої. Тоді й величина множника у
круглих дужках має бути позитивною і
тому
тобто тепло отримує перша система від
другої. Тоді й величина множника у
круглих дужках має бути позитивною і
тому
![]() .
Отже, „у
замкненій системі тепло спонтанно
передається лише від тіла з більшою
температурою до тіла з меншою температурою”.
Це формулювання є іншим варіантом
другого закону термодинаміки. Зверніть
увагу на те, що тепло спонтанно (само
собою) передається не від тіла з більшою
внутрішньою енергією до тіла з меншою
енергією, як можна було б помилково
думати, а саме від більш нагрітого тіла
до менш нагрітого, незалежно від того
яке з них має більшу внутрішню енергію!
Якщо підсистеми є у рівновазі між собою,
то
.
Отже, „у
замкненій системі тепло спонтанно
передається лише від тіла з більшою
температурою до тіла з меншою температурою”.
Це формулювання є іншим варіантом
другого закону термодинаміки. Зверніть
увагу на те, що тепло спонтанно (само
собою) передається не від тіла з більшою
внутрішньою енергією до тіла з меншою
енергією, як можна було б помилково
думати, а саме від більш нагрітого тіла
до менш нагрітого, незалежно від того
яке з них має більшу внутрішню енергію!
Якщо підсистеми є у рівновазі між собою,
то
![]() .
Отже умова однаковості температур є
необхідною (хоча й не достатньою) умовою
термодинамічної рівноваги поміж
підсистемами.
.
Отже умова однаковості температур є
необхідною (хоча й не достатньою) умовою
термодинамічної рівноваги поміж
підсистемами.
Таким чином, як перший, так і другий закони термодинаміки мають природне статистичне обґрунтування. Статистична фізика дозволяє нам не просто обґрунтувати ці закони, які лише постулювалися в термодинаміці, однак не доводилися в її межах, але й визначити фізичний зміст таких ключових термодинамічних понять як внутрішня енергія та температура системи.
Теплові двигуни та холодильні машини
Тепловими машинами у технічній термодинаміці називають будь-який прилад, або устаткування, яке дозволяє циклічно перетворювати теплову енергію у механічну роботу.
Якщо запустити теплову машину у зворотному напрямі (тобто по оберненому циклу), то вона перетворюватиме механічну роботу зовнішнього джерела енергії у теплову енергію. Такі машини отримали назву теплових насосів, або холодильних машин.
Ц
Холодильник
Нагрівач
Рис.5.
![]() від нагрівача, здійснює певну роботу
від нагрівача, здійснює певну роботу
![]() ,
а далі передає частину тепла
,
а далі передає частину тепла
![]() холодильнику і за рахунок такої віддачі
частини тепла, отриманого від нагрівача,
повертається у початковий стан. Далі
весь цикл повторюється. Отже нагрівач,
холодильник та робоче тіло є невід’ємними
складовими частинами кожної теплової
машини, або теплового насосу (холодильної
машини). Ефективність (к.к.д) теплової
машини у загальному випадку дорівнює:
холодильнику і за рахунок такої віддачі
частини тепла, отриманого від нагрівача,
повертається у початковий стан. Далі
весь цикл повторюється. Отже нагрівач,
холодильник та робоче тіло є невід’ємними
складовими частинами кожної теплової
машини, або теплового насосу (холодильної
машини). Ефективність (к.к.д) теплової
машини у загальному випадку дорівнює:
|
(54) |
Ефективність
теплової машини може збільшуватися
лише двома способами, які передбачають:
зменшення кількості тепла відданого
холодильнику (![]() )
та збільшення кількості тепла отриманого
від нагрівача (
)
та збільшення кількості тепла отриманого
від нагрівача (![]() ).
).
Обидва
шляхи, зрозуміло, мають певні обмеження.
Зокрема важливим є те, що загалом обійтися
без витрат тепла на холодильник (тобто
покласти
![]() ,
отже й
,
отже й
![]() )
не можна, хоча б тому, що така теплова
машина не змогла б здійснювати циклічного
процесу, в якому робоче тіло час від
часу повертається у початковий стан.
)
не можна, хоча б тому, що така теплова
машина не змогла б здійснювати циклічного
процесу, в якому робоче тіло час від
часу повертається у початковий стан.
Рис.6. П
П![]() (тиск-об’єм), хоча він значно простіший
та зрозуміліший в інших координатах
(тиск-об’єм), хоча він значно простіший
та зрозуміліший в інших координатах
![]() (ентропія-температура).
(ентропія-температура).
Розглянемо цикл Карно детальніше за його чотирма етапами:
В ізотермічному процесі a-b (
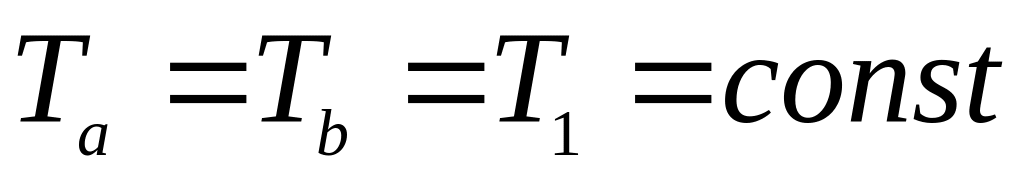 )
при температурі
)
при температурі
 відбувається підвід тепла
до робочого тіла від нагрівача. Робоче
тіло при цьому згідно з першим законом
термодинаміки перетворює все отримане
тепло у позитивну механічну роботу,
оскільки в ізотермічному процесі, як
відомо, внутрішня енергія лишається
незмінною. Робоче тіло в процесі a-b
розширяється (
відбувається підвід тепла
до робочого тіла від нагрівача. Робоче
тіло при цьому згідно з першим законом
термодинаміки перетворює все отримане
тепло у позитивну механічну роботу,
оскільки в ізотермічному процесі, як
відомо, внутрішня енергія лишається
незмінною. Робоче тіло в процесі a-b
розширяється ( ).
).В адіабатичному процесі b-c робоче тіло від’єднують від нагрівача і без втрат тепла (
 ,
,
 )
робоче тіло здійснює додаткову позитивну
роботу за рахунок зменшення внутрішньої
енергії, як це завжди має місце в
адіабатичному процесі. Температура
тіла при цьому зменшується від
до
)
робоче тіло здійснює додаткову позитивну
роботу за рахунок зменшення внутрішньої
енергії, як це завжди має місце в
адіабатичному процесі. Температура
тіла при цьому зменшується від
до
 .
Робоче тіло в процесі продовжує
розширюватися (
.
Робоче тіло в процесі продовжує
розширюватися ( )
)В ізотермічному процесі c-d (
 )
робоче тіло з’єднують з холодильником
із температурою
)
робоче тіло з’єднують з холодильником
із температурою
 і відбирають у нього певну кількість
тепла
і відбирають у нього певну кількість
тепла
 .
Робоче тіло при цьому стискається (
.
Робоче тіло при цьому стискається ( )
)Нарешті в адіабатичному процесі d-a робоче тіло при незмінній ентропії (отже, без витрат тепла) нагрівається від температури до температури і відновлює запас внутрішньої енергії до початкового значення (робоче тіло стискається в цьому процесі
 ).
).
Після
цих чотирьох етапів, цикл може повторюватися
безкінечно. Кожен раз за один цикл буде
виконуватися робота:
![]() .
.
Повна зміна ентропії в циклі, так само як і зміна внутрішньої енергії дорівнює нулю. Записуючи повну зміну ентропії в циклі Карно як суму змін в кожному з чотирьох етапів, можемо формально отримати вираз:
|
(55) |
де
ми врахували, що
![]() .
.
Користуючись рівнянням Клаузіуса маємо:
|
(56) |
де врахували ізотермічність процесів (незмінністю температур). Підставляючи (56) у (55) маємо для циклу Карно наступну умову:
|
(57) |
з
якої вже неважко отримати вираз для
коефіцієнту корисної дії циклу Карно:
![]() . Остаточно маємо формулу Карно:
. Остаточно маємо формулу Карно:
|
(58) |
ефективність
циклу Карно, таким чином, визначають
лише температури нагрівача та холодильнику
![]() .
Зауважимо, що формула (58) отримана без
жодних припущень щодо природи робочого
тіла, отже, його властивості не є важливими
для циклу Карно.
.
Зауважимо, що формула (58) отримана без
жодних припущень щодо природи робочого
тіла, отже, його властивості не є важливими
для циклу Карно.
Теорема Карно стверджує:
„жодна теплова машина, працююча по будь-якому термодинамічному циклу не може мати к.к.д вищий від (58), якщо вона працює поміж нагрівачем та холодильником з температурами відповідно”.
Важливим
наслідком теореми Карно є неможливість
такого циклу, температура холодильника
якого би дорівнювала абсолютному нулю
температури:
![]() .
Оскільки при умові нульової температури
цикл Карно мав би
,
що неможливо з огляду на причини,
розглянуті вище. Тому неможливість
теплового циклу, для якого
(отже,
),
а звідси і циклу Карно, для якого
,
вважають третьою формою вже знайомого
нам по двох інших формулюваннях другого
закону термодинаміки. Отож недосяжність
абсолютного нуля температур, є прямим
наслідком другого закону термодинаміки.
.
Оскільки при умові нульової температури
цикл Карно мав би
,
що неможливо з огляду на причини,
розглянуті вище. Тому неможливість
теплового циклу, для якого
(отже,
),
а звідси і циклу Карно, для якого
,
вважають третьою формою вже знайомого
нам по двох інших формулюваннях другого
закону термодинаміки. Отож недосяжність
абсолютного нуля температур, є прямим
наслідком другого закону термодинаміки.

