
- •6.1. Магнитное поле в вакууме
- •6.2. Магнитное поле в веществе
- •6.3. Электромагнитная индукция
- •7.1. Колебательное движение
- •7.2 Упругие волны. Электромагнитные волны
- •8.1 Взаимодействие света с веществом
- •8.2 Интерференция света
- •8.3 Дифракция света
- •9.1 Квантовые свойства электромагнитного излучения
- •9.2. Фотоэффект. Эффект комптона.
- •9.3. Фотоны – кванты электромагнитного излучения. Корпускулярно-волновой дуализм света и вещества
- •9.4. Развитие физики атома. Возникновение квантовой механики Атом Бора
- •Частица в бесконечно глубокой потенциальной яме
- •Теория атома
- •10.1. Физика атомного ядра
- •10.2. Ядерные реакции
- •10.3. Основные представления физики элементарных частиц
Частица в бесконечно глубокой потенциальной яме
Рассмотрим частицу, потенциальная энергия которой в интервале координат [0,l] равна нулю, а вне этого интервала бесконечно велика. Внутри такой потенциальной ямы стационарное уравнение Шредингера имеет вид такой же, как для свободной частицы (U=0):
(ħ2/2m)![]() E
(x)
(9.4.4)
E
(x)
(9.4.4)
Ища решение (9.4.4)
в виде осциллирующей функции
![]() ,
удовлетворяющей граничным условиям
,
удовлетворяющей граничным условиям
![]() ,
можно получить, что для частицы полная
энергия квантована, то есть возможен
только дискретный набор полных энергий:
,
можно получить, что для частицы полная
энергия квантована, то есть возможен
только дискретный набор полных энергий:
![]() , n=1,
2, 3, (9.4.5)
, n=1,
2, 3, (9.4.5)
Целое число n, нумерующее допустимые значения полной энергии называется квантовым числом. Каждому квантовому состоянию с определенным значением полной энергии En соответствует своя волновая функция:
![]() (9.4.6)
(9.4.6)
Рис. 9.4.3
Решенная выше простейшая задача отражает следующие общие свойства частицы, находящейся в потенциальной яме любой формы.
1) Частица, локализованная в потенциальной яме, может обладать только определенными дискретными значениями полной энергии En. Невозможно существование локализованных частиц с нулевой энергией. Состояние частицы с минимальной полной энергией называется основным состоянием.
2) Волновая функция частицы в состоянии с наименьшей полной энергией не обращается в ноль нигде в пределах потенциальной ямы. Волновые функции частицы во всех состояниях с бóльшими энергиями могут принимать нулевые значения в пределах ямы. Точки, где волновая функция обращается в ноль, называются узлами волновой функции. Количество узлов увеличивается на единицу при переходе к каждому следующему по энергии состоянию.
Теория атома
Атом водорода. Атомные спектры.
Первый постулат Бора электроны могут двигаться вокруг атомного ядра, не излучая электромагнитную энергию, только по стационарным орбитам, определяемым из условия квантования момента импульса электрона:
![]() ,
n
= 1,
2, ... (9.5.1)
,
n
= 1,
2, ... (9.5.1)
где mе – масса электрона; υn – скорость электрона на n-й орбите; rn – радиус n-й стационарной орбиты; n – номер стационарной орбиты; ħ − величина, связанная с постоянной Планка h соотношением ħ = h/ 2π, обычно также называемая постоянной Планка.
Второй постулат Бора каждой разрешенной условием квантования электронной орбите соответствует определенное дискретное значение энергии. Переход с более удаленной от ядра орбиты на более близкую орбиту происходит скачкообразно и сопровождается испусканием кванта электромагнитного излучения.
Энергия испускаемого кванта Е, а также его частота , определяется из соотношения:
Е= Еm Еn = h, (9.5.2)
где Еm энергия электрона на орбите m; Еn − энергия электрона на орбите n.
Из постулатов Бора следует, что полная энергия электрона на n-й орбите атома водорода Еn может быть рассчитана по формуле:
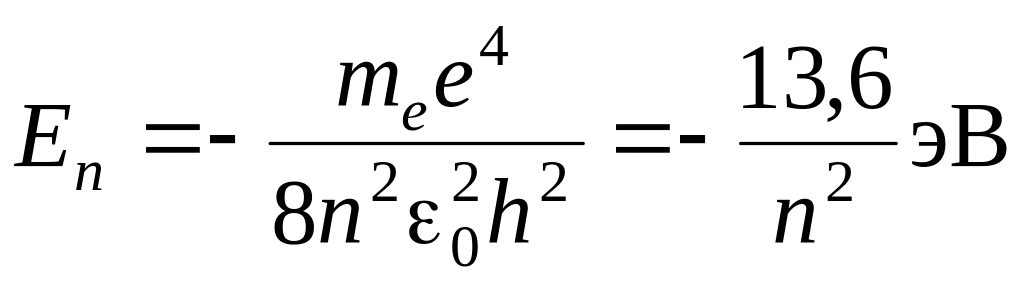 , (9.5.3)
, (9.5.3)
где n – номер стационарной орбиты, на которой находится электрон.
При переходе электрона с орбиты m, более удаленной от ядра, на более близкую к ядру орбиту n, согласно второму постулату Бора и выражению для полной энергии электрона на стационарной орбите, частота кванта излучения определяется соотношением:
![]() .
(9.5.4)
.
(9.5.4)
Это так называемая сериальная формула для спектра частот атома водорода, где R = 3,28984∙1015 Гц − постоянная величина, называемая постоянной Ридберга (полезно помнить, что hR = 13,6 эВ).
Теорию Бора можно успешно использовать не только для атома водорода, но и при рассмотрении водородоподобных атомов, т.е. ионов других химических элементов, состоящих из ядра с зарядом Ze и одного электрона (Не+, Li2+, Be3+, …), обладающих сходными оптическими свойствами. Так, сериальная формула для водородоподобных ионов имеет вид аналогичный сериальной формуле для водорода:
![]() , (9.5.5)
, (9.5.5)
где Z – заряд ядра в относительных единицах (при Z = 1 формула переходит в сериальную формулу для водорода).
Теория атома Бора явилась промежуточным звеном в понимании новых квантовых закономерностей физики микромира. Принципы квантования электронных орбит, предложенные Бором в его теории атома, получили дальнейшее теоретическое обоснование в квантовой механике.
Квантовые числа. Спин электрона. Принцип Паули. Бозоны и фермионы.
В квантовой механике
состояние частицы задается волновой
функцией
(или пси-функцией) Ψ![]() ,
которая является комплексной величиной,
и поэтому недоступна наблюдению.
Доступной эксперименту физической
величиной является плотность
вероятности,
т.е. вероятности
w
нахождения частицы в единице объема,
которую позволяет определить пси-функция
Ψ
:
,
которая является комплексной величиной,
и поэтому недоступна наблюдению.
Доступной эксперименту физической
величиной является плотность
вероятности,
т.е. вероятности
w
нахождения частицы в единице объема,
которую позволяет определить пси-функция
Ψ
:
![]() . (9.5.6)
. (9.5.6)
Общее уравнение Шрёдингера (основное уравнение квантовой механики):
−![]() , (9.5.7)
, (9.5.7)
где Ψ
– волновая функция, описывающая
нестационарное
состояние частицы; Δ − оператор Лапласа;
m
– масса частицы;U(![]() )
– потенциальная энергия;i
− мнимая
единица.
)
– потенциальная энергия;i
− мнимая
единица.
ψ-функции, в случае решения уравнения для атома водорода, содержат три целочисленных параметра − n, l, m. В квантовой механике n называют главным квантовым числом, определяющим энергию связанных состояний электрона.
Движение электрона
в атоме характеризуется орбитальным
моментом импульса, его модуль Мl
связан с так называемым орбитальным
(или азимутальным)
квантовым числом:
![]() .
.
Орбитальное квантовое число l характеризует форму электронного облака (т.е. характер распределения по объему атома плотности вероятности появления электрона) и может принимать значения 0, 1, 2, … (п − 1).
Проекция орбитального
момента на направление z
равняется
![]() ,
при этом оказывается, что ml
также
квантуется и принимает (2l+1)
значение: ml
=
0, ±1, ±2, ±3, …. ±l.
Число ml
называют магнитным
орбитальным квантовым числом.
Квантовое число
ml
определяет ориентацию электронного
облака в пространстве.
,
при этом оказывается, что ml
также
квантуется и принимает (2l+1)
значение: ml
=
0, ±1, ±2, ±3, …. ±l.
Число ml
называют магнитным
орбитальным квантовым числом.
Квантовое число
ml
определяет ориентацию электронного
облака в пространстве.
Кроме перечисленных
выше характеристик электрона в атоме,
имеется еще одна характеристика − это
собственный
момент импульса
электрона
Ms,
называемый
также спином.
Эта величина
имеет исключительно квантовую природу
и не имеет классических аналогов.
Величина спинового момента электрона
равна
![]() ,
где
,
где
![]() − величина, называемая магнитным
спиновым
квантовым числом.
Обычно это число (в единицах ħ)
также называют спином.
− величина, называемая магнитным
спиновым
квантовым числом.
Обычно это число (в единицах ħ)
также называют спином.
Электронная конфигурация многоэлектронного атома.
Значения квантовых чисел n, l, ml, ms полностью определяют состояние электрона в одноэлектронном атоме. Подобная задача для многоэлектронных атомов может быть решена лишь приближенно, т.к. становится существенным взаимное влияние электронов друг на друга. В отличие от одноэлектронного атома, энергия электрона в многоэлектронном атоме будет зависеть не только от n, но и от l.
Распределение электронов по уровням энергии с различными n и l называют электронной конфигурацией многоэлектронного атома.
Совокупность электронов атома с одинаковыми значениями квантового числа п образует электронную оболочку. Данному значению главного квантового числа п соответствует 2п2 состояний, отличающихся друг от друга значениями квантовых чисел l, ml, ms.
Оболочки подразделяют на подоболочки, отличающиеся квантовым числом l. Различные состояния в подоболочке отличаются значениями квантовых чисел ml и ms. Число состояний в подоболочке равно 2(2l + 1). Заселение подоболочек электронами происходит в соответствии с принципом Паули.
Бозоны (или бозе-частицы) это частицы с нулевым или целочисленным спином. Бозоны подчиняются статистике Бозе − Эйнштейна (отсюда − название частиц), согласно которой в данном квантовом состоянии может находиться произвольно большое число бозонов определенного типа.
Фермионы (или ферми-частицы) это частицы, обладающие полуцелым спином. Системы одинаковых фермионов подчиняются квантовой статистике Ферми − Дирака, сформулированной для систем тождественных (одинаковых) частиц с полуцелым спином.
Принцип Паули: в атоме не может быть электронов с одинаковыми значениями всех четырех квантовых чисел.
Испускание и
поглощение света.
Правило
отбора для квантового числа l.
Испускание и поглощение света происходит
при переходах электрона в атоме с одного
уровня энергии на другой. В квантовой
механике доказывается, что для квантового
числа l
действует
правило отбора, согласно которому
возможны только те переходы между
уровнями, при которых l
изменяется
на единицу:
![]() Это правило есть следствие закона
сохранения момента импульса, связано
с тем, что фотон, обладая моментом
импульса ħ,
при испускании уносит из атома этот
момент, а при поглощении − привносит.
Это правило есть следствие закона
сохранения момента импульса, связано
с тем, что фотон, обладая моментом
импульса ħ,
при испускании уносит из атома этот
момент, а при поглощении − привносит.
