
- •Вариант 8
- •Тема 1:Растворы и их роль в жизнедеятельности
- •Тема 2:Буферные системы и их роль в организме человека
- •Тема 3:Химическая термодинамика и её применение к биосистемам
- •Тема 4:Химическая кинетика и её значение для изучения скоростей и механизмов биохимических процессов
- •Тема 5: Химические свойства и биологическая роль биогенных элементов
- •Тема 6: Классификация, номенклатура органических соединений. Общие закономерности реакционной способности органических соединений
- •Тема 7: Карбоновые кислоты и их функциональные производные.
- •Тема 8: Аминокислоты, пептиды, белки
- •Задача №1
- •Тема 9: Углеводы: моносахариды, ди- и полисахариды
- •Задача №2
- •Тема 10: Биологически активные гетероциклы. Нуклеиновые кислоты.
- •Задача №2
- •Тема 11:Растворы вмс. Свойства биополимеров
Тема 3:Химическая термодинамика и её применение к биосистемам
Дайте краткий ответ на теоретические вопросы:
1.Теплота и работа. Теплоты химических реакций при постоянной температуре или P и V.
Ответы:
Теплота - является мерой энергии переданной от одного тела к другому, за счет разницы температур этих тел. Работа - является мерой энергии, переданной от одного тела к другому за счет перемещения масс под действием каких-либо сил.
Классификация термодинамических процессов
по постоянству параметров
- Изохорный процесс – постоянный объем;
- Изобарный процесс – постоянное давление;
- Изотермический процесс – постоянная температура;
- Изобарно-изотермический процесс – процесс , протекающий в организме человека, характеризующийся постоянством давления и температуры.
2.Энтропия как мера неупорядоченности системы (уравнение Больцмана)
Ответы:
Энтропия - это параметр характеризующий хаотичность движения частиц, является мерой молекулярного, атомного и ионного беспорядка.
С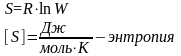 точки зрения статистической термодинамики,
энтропию можно рассматривать как меру
беспорядка или наиболее вероятного
состояния системы:
точки зрения статистической термодинамики,
энтропию можно рассматривать как меру
беспорядка или наиболее вероятного
состояния системы:
где W – вероятность существования вещества;
К – постоянная Больцмана:
 ,
,
где R – газовая постоянная;
NA – число Авогадро, NA= 6,02 • 1023 частиц
Энтропия также, как и энтальпия, является функцией состояния, то есть определяется начальным и конечным состоянием.
Решите задачи:
Задача 1
Определите
как изменится энтропия в следующей
реакции:
 ,
полученный ответ подтвердите расчетами,
если:
,
полученный ответ подтвердите расчетами,
если:

Решение:
ΔS<0, так как в реакции число молей веществ а газообразном состоянии уменьшается, значит энтропия тоже уменьшается(S1>S2).
По первому следствию из закона Гесса:

Задача №2
Мужчина выпил на вечеринке в пересчете на абсолютный спирт 46 г этанола С2Н5ОН. Считать, что этанол полностью окисляется в организме по уравнению:
С2Н5ОН(ж) + 3О2(г) = 2СО2(г) + 3Н2О(ж)
Н0обр (С2Н5ОН) = 1278 кДж/моль;
Н0обр (Н2О) = 286 кДж/моль;
Н0обр (СО2) = 394 кДж/моль.
Вопросы:
1.На основании какого закона проводятся термохимические расчеты?
Термохимические расчеты проводят на основании закона Гесса.
2.По какому уравнению можно рассчитать стандартную энтальпию окисления глюкозы?
Стандартная энтальпия окисления этанола может быть рассчитана по уравнению:
DН0окисл. (С2Н5ОН) = 2DН0обр (СО2) + 3DН0обр (Н2О) ‑ DН0обр(С2Н5ОН) =
2×(‑ 394) + 3×(‑ 286) – (‑ 278) = ‑ 788 – 858 + 278 = ‑ 1368кДж.
3.Каким является процесс окисления спирта: экзотермическим или эндотермическим?
Так как DН0окисл. (С2Н5ОН) < 0, то процесс окисления спирта является экзотермическим.
4.Какое количество энергии получит организм пациента?
1368 кДж
5.Какое время мужчина должен бегать трусцой (расход энергии 920кДж/ч), чтобы компенсировать излишества?
Что бы компенсировать излишества, мужчина должен бегать трусцой
1368 кДж / 920 кДж/ч = 1,49 ч.
Ответьте на тесты:
1. Открытой термодинамической системой является
клетка (животная или растительная)
биогеоценоз
2. Для живых организмов характерно состояние
стационарное
3.Процессы, протекающие в организме человека, являются
изобарно-изотермическими
4. Энергия, зависящая только от термодинамического состояния системы
внутренней энергией
Занятие №4
