
- •Лабораторная работа №3 тема: «дисперсные системы. Растворы. Основы электрохимии»
- •Теоретическая часть
- •Константа равновесия электролитической диссоциации – константа диссоциации.
- •(Превращение химической энергии в электрическую)
- •Окислительно-восстановительные реакции – реакции, при которых вследствие окисления и восстановления происходит изменение степеней окисления элементов.
- •Ответить на контрольные вопросы
Лабораторная работа №3 тема: «дисперсные системы. Растворы. Основы электрохимии»
Теоретическая часть
В технике в большинстве случаев инженер имеет дело с дисперсными системами, которые состоят из дисперсной фазы и дисперсионной среды. Дисперсная фаза – совокупность раздробленных частиц, количественной мерой которых α является условный диаметр (м) или степень дисперсности D = 1/α, м-1.
По степени дисперсности системы классифицируются на молекулярно-дисперсные (α < 10-7 м), тонкодисперсные, коллоидные растворы (α = 10-7 – 10-5 м) и грубодисперсные (α > 10-5 м).
Растворы. Растворы – гомогенные системы переменного состава, состоящие из 2-х или более компонентов. Растворы характеризуются концентрацией, плотностью, удельной теплоемкостью, подчиняются законам Рауля и Вант-Гоффа. Относительное понижение давления пара над раствором пропорционально молярной доле растворенного летучего вещества (закон Рауля):
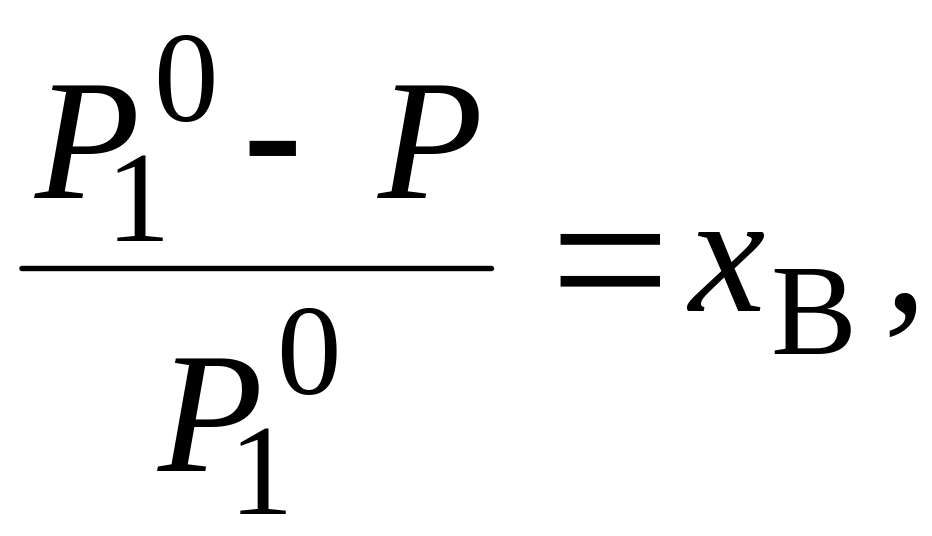 (5.1)
(5.1)
где
![]() ,
Р
– давление насыщенного пара растворителя
соответственно над растворителем и над
раствором.
,
Р
– давление насыщенного пара растворителя
соответственно над растворителем и над
раствором.
Повышение температуры кипения ΔТкип, понижение температуры замерзания ΔТзам пропорционально моляльной концентрации растворенного вещества (ΔТкип = Кэ·сm, ΔТзам = Kкр.·cm).
Криоскопическая константа Ккр. – величина, показывающая на сколько градусов раствор, состоящий из 1 моля неэлектролита и 1000 г данного растворителя, замерзает ниже, чем чистый растворитель: Ккр. (Н2О) = 1,86 оС; Ккр. (ССl4) = 29,8 oC.
![]() (5.2)
(5.2)
где m0 – масса растворителя; mВ – масса растворяемого вещества; М – молярная масса растворяемого вещества.
Концентрация растворов – количественное содержание растворенного вещества в данном растворе.
Процентная концентрация (%) – массовое содержание растворенного вещества в 100 массовых частях раствора.
Молярная концентрация (с) – число молей растворенного вещества в 1 л раствора.
Молярная концентрация эквивалента сэкв (N) – число молей эквивалента вещества в 1 л раствора.
Моляльная концентрация (сm) – число молей растворенного вещества в 1000 г растворителя.
Плотность раствора (ρ, кг/м3) определяется ареометром.
Для определения концентрации растворов используют весовой, объемный, различные физико-химические методы анализа (фото-колориметрия, потенциометрия, полярография, кулонометрия и т.д.).
Растворы электролитов – ионные проводники с полярным или ионным типом связи в полярных растворителях, проводящие электрический ток в растворенном или расплавленном состоянии (растворы кислот, солей, оснований).
Распад веществ с ионным или полярным типом связи под действием полярных молекул растворителя – электролитическая диссоциация.
Растворы электролитов характеризуются активностью «а»:
а = γ·с, (5.3)
где γ – коэффициент активности; с – концентрация.
В разбавленных растворах γ → 1, активность соизмерима с концентрацией.
Растворы электролитов характеризуются активностью (а), электропроводностью (χ, См∙см-1), степенью диссоциации (α), изотоническим коэффициентом (i), константой диссоциации Кдис. Растворы электролитов подчиняются законам идеальных растворов при введении изотонического коэффициента i, величина которого зависит от числа частиц, находящихся в единице объема раствора.
