
- •1.Углеводороды. Алканы. Определение. Реакция свободно – радикального замещения – галогенирование, нитрование.
- •3. Угливодороды. Алкины. Определение. Химические свойства: реакции галогенирования, гидрогалогенирования, гидротации на примере пропана.
- •4.Угливодороды. Алкины. Химические свойства: кислотные свойства, реакции окисления и восстановления на примере ацителена.
- •5.Ароматические углеводороды. Гамологи аренов. Реакции боковой цепи.
- •7. Спирты. Определение. Химические свойства: реакция этерификации, отличие от многоатомных спиртов.
- •8.Фенолы. Определение. Химические свойства одноатомных фенолов – реакция углеводородного радикала.
- •9. Реакция гидролиза ацетилсалициловой кислоты.
- •10. Альдегиды. Определения. Химические свойства: взаимодействие с циановодородной кислотой, с водой.
- •11.Амиды кислот. Определение. Мочевина. Получение. Характеристика свойств: основные свойства.
- •12. Амины. Определение. Химические свойства: основные свойства, реакции алкилирования и ацилирования.
- •13. Соли диазония. Определение. Реакция азосочетания с фенолами и ароматическими аминами.
- •14.Аминокислоты. Определение. Химические свойства: кислотно-основные свойства.Реакция поликонденсации (образование дипептида).
- •15. Пятичленные гетероциклы с одним гетероатомом: пиррол, тиофен, фуран. Структурные формулы . Реакции сульфирования и нитрования для пиррола.
- •16. Одноосновные карбоновые кислоты. Определение. Химические свойства: реакция этерификации, образование галогенангидридов.
- •17. Сложные эфиры. Определение. Химические свойства: кислотный и щелочной гидролиз сложных эфиров на примере этилового эфира уксусной кислоты.
- •18. Триацилглицерины. Жиры. Определение. Химические свойства: гидролиз, гидрогенизация.
- •19. Двухосновные карбоновые кислоты. Определение. Особенности поведения при нагревании (специфические свойства)щавельной и янтарной кислот.
- •20.Гидроксикислоты. Определение. Характеристика специфических свойств (отношение к нагреванию).
- •21. Фенолокислоты. Определение. Химические свойства: реакции по фенольной гидроксильной группе.
- •22. Реакция окисления глюкозы реактивом Фелинга.
- •36. Качественная реакция на Теобромин (Theobrominum)
- •37. Реактив Толленса. Его применение в качестве реактива в органической химии.
- •38. Качественная реакция на глютаминовую кислоту (acidum qlytaminicum)
- •3 9. Качественая реакция на салициловую кислоту (Salicylic acid)
- •40. Качественная реакция на антипирин с нитратом натрия в кислой среде.
- •57. Качественная реакция на первичный ароматический амин на примере анилина.
- •58. Как отличить салициловую кислоту от ацетилсалициловой с помощью качественной реакции.
- •61. Качественная реакция на бензойную кислоту, условия проведения реакции.
- •66. Реакция гидролиза этилового эфира уксусной кислоты. Условия реакции.
- •67.Специфические свойства β – гидроксикислот (отношение к нагревании)
- •68.Качественная реакция на уксусную кислоту – реакция этерификации
- •73Вопрос
- •74Вопрос
- •75 Вопрос
- •97. Применение растительных масел в медицине. Напишите общую формулу триацилглицерина.
- •98. Уксусная кислота. Латинское название. Применение в медицине салицилового эфира уксусной кислоты (ацетилсалициловой кислоты)
- •99. Глюкоза. Структурная формула, латинское название, применение в медицине.
- •100. Глютаминовая кислота. Структурная формула, латинское название, применение в медицине.
- •101. Аминоуксусная кислота (глицин). Структурная формула, латинское название, применение в медицине.
- •102. Кальция глюконат. Структурная формула, латинское название, применение в медицине.
1.Углеводороды. Алканы. Определение. Реакция свободно – радикального замещения – галогенирование, нитрование.
УВ – органическое соединение молекулы которых состоит из атомов углирода и водорода делятся на алимфатические (т.е не цеклические) и карбоцеклические (замкнутых в цепь).
Алканы – насыщенные предельные УВ, молекулы которых состоят из атомов углерода и водорода связанных между собой только сигма связями. (~)
Реакция свободно - радикального замещения:
Реа-я галогенирование (хлорирование метана)
1этап:инецирование цепи
CE2
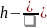 2CE
2CE
2этап рост цепи
2.
CH4+CE2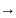 CH2CE+HCE
(C1
хлор
метан)
CH3CE+CE2
CH2CE2+HCE
(диодин
хлор
метан)
CH2CE2+CE2
CHCE3+HCE
(1,1,1три
хлор
метан)
CHCE2+CE2
CCE4+HCE
(1,1,1,1 тетра
хлор
метан)
CH2CE+HCE
(C1
хлор
метан)
CH3CE+CE2
CH2CE2+HCE
(диодин
хлор
метан)
CH2CE2+CE2
CHCE3+HCE
(1,1,1три
хлор
метан)
CHCE2+CE2
CCE4+HCE
(1,1,1,1 тетра
хлор
метан)
3. CE + CE CE2
Реа-я нитрования – при действии на алканы разбав. HNO3 (азотная кислота) 10% при 140t цельсия атом водорода замещается на нитро группу (р-я Коновалова)
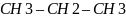 –
HNO3
–
HNO3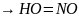 2
2
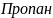 (1)CH3
(1)CH3
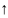
(1)H
2С
–
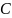 –
СH(3)
– CH2(2)
– (1)СH3
–
СH(3)
– CH2(2)
– (1)СH3
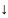
(1)CH3 (1)CH3
1-перв. Атом,2-втор. Атом,3-третич. Атом.
CH3
– CH2
– CH3
– HNO3
HO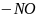 2-нитропропан
2-нитропропан
CH3 – CH – CH3
NO2
2.Алкены. Реакции окисления алкенов (реа-я окисления этилена KMnO4 (перманганат калия) в нейтральной или слабощелочной среде, реа-я окислительного расщепления =связи).
Алкены- алкенами называются ненасыщенными УВ в молекулах которых имеются одна двойная связь и имеющая общая формула (CnH2n) .
Реа-я окисления этилена KMnO4 в нейтральной или слабощелочной среде.
CH2=CH2 – 2KMnO4+4H2O CH2 – CH2 + 2MnO2
бурый
 OH
OH
OH
OH
Этилдиол-1,2
Реа-я окислительного расщепления двойной связи.
O
H3C
– CH≠CH – CH3
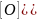 2CH3
– C
2CH3
– C

OH
Бутен – 2
3. Угливодороды. Алкины. Определение. Химические свойства: реакции галогенирования, гидрогалогенирования, гидротации на примере пропана.
УВ – органическое соединение молекулы которых состоит из атомов углирода и водорода делятся на алимфатические (т.е не цеклические) и карбоцеклические (замкнутых в цепь).
Алкины – не предельная УВ имеющие одну тройную связь и отвечающие общей формуле (SnH2n-1).
Реа-я галогенирования:
Br Br
CH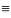 CH
+ Br2
CH
CH
CH
+ Br2
CH
CH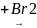 CH
– CH 1,2,3-тетрабромэтан
CH
– CH 1,2,3-тетрабромэтан
1,2-бромэтан
Br Br Br Br
Br
CH
C
– CH3
+ HBr
CH2
= C – CH3
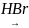 CH3
–
C
– CH
CH3
–
C
– CH
2-бромпропен-1 Br Br
2,2-дибромпропан
Реа-я гидрогалогенирования:(взаимодействия с водородом)
CH
C
– CH3
+ HH
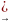 CH2
= CH – CH3
+
CH2
= CH – CH3
+
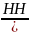 CH3
– CH2
– CH3
CH3
– CH2
– CH3
Пропен-1
Реа-я гидротации (взаимодействие с водой):
O
CH
CH+H
– OH [ CH2=CH]
CH3
– C
CH2=CH]
CH3
– C
Этин уксусный альдегид H
H3C
– C
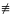 CH+H – OH
CH+H – OH
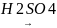 [CH3
– C = CH2]
CH3
– C – CH пропанол-2
[CH3
– C = CH2]
CH3
– C – CH пропанол-2

OH O
