
«Бейорганикалық химия» пәнінен
5В060600- мамандығының студенттеріне арналған воуд сұрақтары
3 Жауап
1$$$. Кейбір реакциялар үшін активтенедіру энергиясы (ЕА) және реакцияның жылу эффектісі (∆H) мынадай мәндерге ие: ЕА=100 кДж/моль; ∆H=-20 кДж. Катализатор қатысында ЕА және ∆H мәндері тең болуы мүмкін:
ЕА=60, ∆H= -20
ЕА=50, ∆H= -20
ЕА=40, ∆H= -20
ЕА=60, ∆H= +20
ЕА=50, ∆H= +20
ЕА=70, ∆H= +20
ЕА=50, ∆H= +20
2$$$. Кейбір реакциялар үшін активтендіру энергиясы (ЕА) және реакцияның жылу эффектісі (∆H) мынадай мәндерге ие: ЕА=50 кДж/моль; ∆H= +40 кДж. Катализатор қатысында ЕА және ∆H мәндері тең болуы мүмкін:
ЕА=30, ∆H= +40
ЕА=20, ∆H= +40
ЕА=10, ∆H= +40
ЕА=60, ∆H= +40
ЕА=70, ∆H= +40
ЕА=80, ∆H= +40
ЕА=90, ∆H= +40
3$$$. Молекулалығы (М) және реакция реті (n) FeO+ C↔ Fe+CO:
М=2
n=0
М≠n
М=1
n=2
М=0
n=1
4$$$. Молекулалығы (М) және реакция реті (n) CO+Cl2↔ COCl2:
М=2
n=2
М=n
М=1
n=0
М=0
n=1
5$$$. Реакция жылдамдығы:
Активтендіру энергиясы кері пропорционалды
Концентрацияға тура пропорционалды
Температураға тура пропорционал
Қысымға кері пропорционалды
Температураға кері пропорциона
Қысымға кері пропорционалды
Активтендіру энергиясы тура пропорционалды
6$$$. Реакция жылдамдығы жоғары болған сайын:
Химиялық реакцияның константасы жоғары мәнді
Активтендіру энергиясы аз шама
Жартылай айналу периоды аз шама
Химиялық реакцияның константасы аз
Активтендіру энергиясы улкен шама
Жартылай периоды үлкен
Жартылай периоды кіші
7$$$. Идеал ерітінділердің заңдары:
Рауль
Вант-Гофф
Коновалов
Генри
Лавуазье-Лаплас
Гесс
Авогадро
8$$$. Температураның жоғарылауынан төмендегі заттың судағы ерітіндісі өседі:
Нарий карбонаты
Натрий ацетаты
Натрий нитраты
Кальций карбонаты
Мыс сульфаты
Натрий сульфаты
Натрий роданиді
9$$$. «Ерігіштік көбейтіндісі» түсігінін қолданады:
Кальций карбонаты
Күміс хлориді
Барий сульфаты
Калий гидроксиді
Натрий сульфаты
Калий сульфаты
Магний гидроксиді
10$$$. ЕК(Ba3(PO4)2=6*10-39 кезіндегі тұнбаға түсу жағдайына барий фосфаты иондары концентрациясы көбейтіндісінің мәні:
1,5*10-24
15*10-23
6*10-21
3*10-44
6*10-43
6*10-42
6*10-22
11$$$.Дұрыс тұжырымды көрсетіңіз(КК-аз еритін қосылыс иондарының тепе-теңдіксіз концентрацияларының көбейтіндісі, ал ЕК-тепе-теңдікті концентрацияларының көбейтіндісі):
КК<ЕК кезінде тұнба ериді
КК>ЕК кезінде тұнба түседі
КК=ЕК кезінде тұнба ерітіндімен тепе-теңдікте болады
КК>ЕК кезінде тұнба ерітіндімен тепе-теңдікте болады
КК>ЕК кезінде тұнба түседі
КК=ЕК кезінде тұнба түседі
КК=ЕК кезінде тұнба ериді
12$$$. ЕК( PbСІ2 )=1,7*10-5 кезіндегі PbСІ2-нің тұнбаға түсу жағдайы
[Pb2+]*[СІ-]2 =2,2*10-2
[Pb2+]*[СІ-]2 =3,4*10-4
[Pb2+]*[СІ-]2 =5,6*10-3
[Pb2+]*[СІ-]2 =1,1*10-8
[Pb2+]*[СІ-]2 =1,1*10-8
[Pb2+]*[СІ-]2 =1,2*10-8
[Pb2+]*[СІ-]2 =1,3*10-8
13$$$. Жүйе СаСО3→Са2++СО32- үшін ерігіштік көбейтіндісін(ЕК) қолданып, оның тұнбаға түсу жолын көрсетіңіз(ЕК(СаСО3)=5*10-9):
CdCl2; EK(CdCO3) =2.5*10-14
MnCl2; EK(MnCO3) =8.8*10-11
AgNO3; EK(Ag2CO3) =6.2*10-12
NiCl2; EK(NiCO3) =1.3*10-7
MgCl2; EK(MgCO3) =1*10-6
K2CO3 EK(MgCO3) =1*10
K2SO3 EK(MgCO3) =1*10
14$$$.BaSO4 ерігіштік көбейтіндісі (ЕК)1,1*10-10тең. BaSO4(г/л) ерігіштігін есептеу:
2,45*10-3г/л
24,5*10-4г/л
0,245*10-2г/л
2,45*103г/л
24,5*104г/л
0,245*102г/л
2,45*10-4г/l
15$$$. Mg(OH)2 магний гидроксидінің 180С-та ерігіштігі 1,7*10-4моль/л тең. Осы температурада ерігіштік көбейтіндісін есептеу.
1,96*10-11
19,6*10-12
0,196*10-10
19,6*10-11
19,6*10-13
1,96*10-10
1,96*10-14
16$$$. Келесі қышқылдар үшін молярлық және нормалдық концентрациялары бір-біріне тең:
HBr
HNO3
HCl
H2CO3
H2SO4
Hl
H2SO3
17$$$. Молярлық және нормалдық концентрациялары бір-біріне тең болатын негіздер үшін:
NaOH
NH4OH
KOH
Cu(OH)2
Al(OH)3
Mn(OH)2
Fe(OH)3
18$$$. Тұздар үшін эквиваленттік факторы 1-ге тең:
NaNO3
NaCl
AgNO3
ZnSO4
Cu(NO3)
Na2S
Na2CO3
19$$$. Қатты заттың ерігіштігі тәуелді:
еріген заттың полярлығы
еріткіштің полярлығы
температуралар
қысым
катализатор
гибиторларин
катализатор табиғаты
20$$$. КОН ерітіндісімен реакциясында, егер КН₂РО₄; К₂НРО₄; К₃РО₄ түзілсе, Н₃РО₄ - тің эквиваленттік молярлық массасы тең:
A) 98
B) 49
C) 32,7
D) 44
E )50
F)5 8
G)60С
21$$$. Сұйытылған ерітінділердің коллигативтік қасиеттеріне жатады:
A) ерітіндінің қатаю температурасының төмендеуі
B) ерітінді бетіндегі қаныққан бу қысымының төмендеуі
C) ерітіндінің қайнау температурасының төмендеуі
D) ерітінді концентрациясының кемуі
E) атмосфералық қысымның артуы
F) ерітінді көлемінің өзгеруі
G) ерітінді концентрациясының артуы
22$$$. Барлық жуйелер дисперстік дәрежесі бойынша бөлінеді:
A) дисперсті жүйелерге
B) шын ерітінділерге
C) коллоидты жүйелерге
D) балқымаларға
E) қаныққан ерітінділерге
F) қанықпаған ерітінділерге
G) нашар еритін ерітінділерге
23$$$.Егер электролиттік диссоциалану дәрежесі-90% болса,онда 200,300,400 молекуладан диссоциацияланған молекула саны (N):
A) 360
B) 270
C) 180
D) 200
E) 400
F) 250
G) 330
24$$$.Температураны 40 С-қа көтергенде реакция жылдамдығы 81,16,256 есе артқан.Реакцияның температуралық коэффициенті :
A) 2
B) 4
C)3
D) 1
E) 5
F) 7
G) 8
25$$$. IIA топшасының металдары:
A) бериллийден басқасы амфотерлік қасиеттер қөрсетпейді
B) қышқылдармен барлық металдар әрекеттеседі
C) бериллийден басқа барлық металдар сумен жақсы әрекеттеседі
D) галогендермен тікелей әрекеттеспейді
E) тұздар ерітінділерінің электролизі нәтижесінде алынады
F) оттегімен тек оксидтер түзеді
C) коррозияға төзілді материалдар алуда колданады
26$$$. Кешен ионының зарядына байланысты кешен қосылыстары жіктеледі:
A) анионды
B) бейтарап
C) катионды
D) аквокешендер
E) аминкешендер
F) полигалогенидтер
G) карбонилдер
27$$$.Электролит ерітінділерінде реакция соңына дейін жүреді :
A) Тұнбаға түсу
B) газ бөліну
C) су түзілуі
D) жылу бөліну
E) жаксылап араластыру
F) жылу сіңіру
G)энергия бөліну
28$$$.Калий хлоридінің концентрациясы 2моль/л,3моль/л,4моль/л ерітіндісінің диссоциациялану дәрежесі 80% болса,ерітіндідегі калий иондарының саны:
A) 14,45,10
B) 19,26,10
C) 9,63,10
D) 15,10
E) 30,10
F)22,10
G)12,65,10
29$$$. рН-10,11,12 болған жағдайдағы сутек электродының потенциал мәні:
A) -0,649В
B) -0,59В
C) -0,708В
D) 0,59В
E) 0,708В
F) 0,908В
G)0,649В
30$$$.Мына элементтер қатарында электртерістілік төмендейді:
A) Cl- S –P- Si -Al
B) Br- Se- As- Ge- Ga
C) O -N –C- Si- Ca
D) Be- B-C -H -Al
E) Na –Al- C –H- Cl
F) B -Si –As- C- H
G) B -Si –As- 0- H
315$$$. Мына қатарларда атом радиустары артады:
A) F –Cl- Br
B) Li –Na- K
C) N –P- Bi
D) Mg -Ba -H
E) Zn -Li -O
F) Al -B -Si
G) K-S –
32$$$. N2+3H2=2NH3 реакциядағы сутектің концентрациясын 2есе,3есе,4есе азайтқанда реация жылдамдығы:
A) 8есе кемиді
B) 27есе кемиді
C) 64есе кемиді
D) 5есе кемиді
E) 64есе артады
F) 27 есе артады
G) өзгермейді
33$$$.Ауыспалы элементтерге сәйкес келеді:
A) d – элементтер
B) ІВ тобы
C) ІІІВ тобы
D) s - элементтер
E) ІІА тобы
F) p – элементтер
G. ) ІІВ тобы
34$$$. Бас квант саны анықтайды:
A) Электрондық қабатта электрондардың максимал санын
B) Электрондық орбиталдің мөлшерін
C) Атомдағы электронның энергиясын
D) Электрондық орбиталдің пішінін
E) беттік тегіс түйіндерінің саны
F) электронның орбиталь моментінің мөлшерін
G)Энергетикалық деңгей
35$$$. 3d, 4f, 7s электрондарға сәйкес келетін қосымша l квант сандарының мәні:
A) 2
B) 3
C) 0
D) 5
E) 4
F) 6
G) 7
36$$$. Атомның негізгі күйінде электрондарының энергетикалық деңгейлерде, деңгейшелерде және орбиталдарда орналасуы анықталады:
A) Паули принципімен
B) Хунд ережесімен
C) Клечковский ережесімен
D) Шредингер теңдеуімен
E) Бор постулаттарымен
F).Атомдар
G.)Молекулалар
37$$$.2s, 3p, 3d энергетикалық деңгейшелерде максимал электрон сандары:
A) 2
B) 6
C) 10
D) 12
E) 14
F) 32
G).15
38$$$.3d, 5f, 2s энергетикалық деңгейшелерде максимал электрон сандары:
A) 10
B) 14
C) 2
D) 18
E) 24
F)18
G)2
39$$$. Кәдімгі жағдайда хлор әрекеттесетін қосылыстар
A)калий иодидімен иод түзіп
B) калий бромидімен бром түзіп
C) темірмен темір (III) хлоридін түзіп
D) темірмен темір (II) хлоридін түзіп
E) перманганатпен марганец хлоридін түзіп
F) оттекпен оксид түзіп
G) дихроматпен хром (III) хлоридін түзіп
40$$$. Күміс хлориді мына қосылыстарда ериді.
A) аммиакта
B) аммоний карбонатында
B) натрий карбонатында
C) аммоний сульфатында
D) сілтілерде
E) күкірт қышқылында
G). калий цианидінде
41$$$. Үшінші периодта солдан оңға қарай натрийдан хлорға қарай:
A) атомдардың иондану потенциалы артады
B) электрон қосылғышығы артады
C) атомдардың электртерістілігі артады
D) атомдардың иондану потенциалы кемиді
E) электрон қосылғышығы төмендейді
F) атомдар радиустары артады
G.) Электртерістілігі кемиді
42$$$. Бериллий топшасы элементтерінде жоғарыдан төмен қарай , берилийден барийге қарай;
A) атомдардың иондану потенциалы кемиді
B) электрон қосылғышығы төмендейді
C) атомдар радиустары артады
D) увеличение потенциала ионизации
E) электрон қосылғышығы артады
F) элементтер радиустары төмендейді
G) атомдардың электртерістілігі артады
43$$$. Бериллий топшасы элементтерінде жоғарыдан төмен қарай , берилийден барийге қарай;
A) атомдардың иондану потенциалы кемиді
B) атомдардың электртерістілігі кемиді
C) элементтер радиустары артады
D) атомдардың иондану потенциалы артады
E) электрон қосылғышығы артады
F) элементтер радиустары кемиді
G)электртерістілігі артады
53$$$. Жәй заттар – типтік тотықсыздандырғыштар:
A) сутегі
B) көміртегі
C) магний
D) оттегі
E) озон
F.) натрий
G.) хлор
44$$$. Мына қатарларда солдан оңға қарай иондар радиустары өседі:
A) Al+3, Mg+2, Na+
B) Be+2, Mg+2, Ca+2
C) Cl-, S-2, P-3
D) Na+, Mg+2, Al+3
E) Ca+2, Mg+2, Be+2
F) P-3, -3, S-2, Cl-
G.) S-2, Cl-
, 45$$$. sp3, sp2, sp типті гибридтену молекласының кеңістіктік құрылымы:
A) тетраэдр
B) жазық үшбұрыш
C) сызықтық
D) жазық квадрат
E) ромб
F) гантель
G) шар
46$$$. АО- дың sp-гибридтенуі молекулаларда:
A) СО2
B) HCN
C) C2H2
D) C2H6
E) H2CO3
F) H2SO4
G) CuCl2
47$$$. АО- дың sp2-гибридтенуі молекулаларда:
A) C6H6
B) BF3
C) H2SiO3
D) СО2
E) HCN
F.) HCI
G). SО2
48$$$. АО- дың sp3-гибридтенуі молекулаларда:
A) C2H6
B) NH3
C) CCl4
D) C2H4
E) COCl2
F) CO2
G)H2O
49$$$. CH4, PCl5 және SF6 молекулаларында көміртектің, фосфор және күкірттің гибридтену түрі:
A) sp3
B) sp3d
C) sp3d2
D) spd
E) sp
F) sp3d3
G) ) sp3d5
50$$$. BeCl2 BF3 және SF6 молекулаларында бериллий, бор және күкірттің гибридтену түрі:
A) sp
B) sp2
C) sp3d2
D) sp33d
E) spd
F) spd4
G) sp2d
51$$$. sp-гибридтенуі мына электрон бұлттарының қабысуымен түзіледі:
A) s – s
B) s - px
C) px - px
D) py - py
E) pz - pz
F.) px - pz
G.) p - sx
52$$$.Сызықтық конфигурация мына молеклаларда:
A) СО2
B) BeF2
C) HgCl2
D) NH3
E) H2O
F) SO3
G. ) SO2
53$$$.Тригональді жазық конфигурация мына молеклаларда:
A) BF3
B) AlCl3
C) GaH3
D) СО2
E) BeF2
F) HgCl2
G) NH3
54$$$. Тетраэдрлік конфигурация мына молеклаларда:
A) SiCl4
B) CH4
C) GeH4
D) C2H4
E) COCl2
F) H2CO3
G) H2SO4
55$$$. Сызықтық, тетраэдрлік кеңістіктік құрылым мына молекулаларда:
A) BeCl2
B) CO2
C) CH4
D) H2S
E) H2O
F.)HCI
G.)HI
56$$$.Көміртек диоксиді молекуласының құрылысы, σ- және π – байланыстарының саны,
көміртегі атомнының гиридтену түрі:
A) сызықтық
B) 2σ және 2π
C) sp
D) бұрыштық
E) 2σ және 0π
F) sp²
G.) sp3
57$$$.Коваленттік полюссіз байланыс мына молекулаларда:
A) H2
B) O2
C) СІ2
D) Na2O
E) Mg
F) HCl
G)NaCI
58$$$. Коваленттік полюсті байланыс мына молекулаларда:
A) HCl
B) НІ
C) НҒ
D) H2
E) O2
F) СІ2
G) NаСІ
59$$$. Мына қосылыстарда ең жоғарғы иондану дәрежесі:
A) K-Cl
B) K-I
C) Na-Cl
D) S-H
E) Fe-Cl
F.) F-Cl
G.) C-H
60$$$. Мына бөлшектерде донорлы – акцепторлы механизм бойынша байланыс түзілді:
A) NH3
B)
ВH![]()
C) H2SiF6
D) GeH4
E) C2H4
F) COCl2
G). CCl2
61$$$.Ассоциаттарды түзуге қабілетті молекулалар:
A) Суда
B) Аммиак
C) Гидразин
D) Тұз қышқылы
E) Күкірт қышқылы
F) Натрий гидроксиді
G)Тұз қышқылы
62$$$.Донор бола алады:
A) Азот
B) Хлорид-анион
C) Оттегі
D) Бериллий
E) Сутегі
F) Кремний
G) Темір
63$$$. Акцептор бола алады:
A) Темір
B) Кремний
C) Сутегі
D) Азот
E) Фторид-анион
F) Оттегі
G) Хлорид-анион
64$$$. Ковалентті байланыс қасиеті:
A) бағытталуы
B) қанығуы
C) полярлығы
D) иондану дәрежесі
E) диссоциация
F).иондану
C.)электртерістілігі
65$$$. Азот молекуласында σ- және π- байланыстарының саны, байланыс еселігі:
A) 3
B) 1σ
C) 2π
D) 2
E) 3π
F) 2σ
G. ) 3σ
65$$$. Фтор молекуласында σ- және π- байланыстарының саны, байланыс еселігі:
A) 1
B) 1σ
C) 0π
D) 3
E) 1π
F) 2σ
G)5
66$$$. Хлор молекуласында σ- және π- байланыстарының саны, байланыс еселігі:
A) 1
B) 1σ
C) 0π
D) 2
E) 2π
F) 2σ
G)5
67$$$. ВБ теориясы бойынша көміртегі (II) оксиді молекуласында:
A) С және О атомдарының қос байланысы 2р- электрондардың жұптасуы есебінен түзіледі
B) біреуі - донорлы-акцепторлы механизм бойынша С бос 2р-орбиталі есебінен, О электрондық жұбынан
C) үштік байланыс
D) қос байланыс
E) бір байланыс алмасу механизмі бойынша түзіледі
F.)төрттік байланыс
G).электрон жұбы
68$$$. Көміртегі (IV) оксиді молекуласына тән:
A) 2π- байланыстар
B) 2σ- байланыстар
C) сызықтық молекула
D) 1σ-, 2π- байланыс
E) тетраэдр
F) sp3-гибридтену
G.) sp2-гибридтену
69$$$. Орталық атомының sp –гибридтенуі молекулада:
A) CO2
B) COS
C) CS2
D) CH4
E) COCl2
F) CSCl2
G) ) CCl2
70$$$. Орталық атомының sp2 –гибридтенуі молекулаларда:
A) COCl2
B) CSCl2
C) H2CO3
D) CCl4
E) Cl2
F) C2H2
G). C2H4
71$$$. Орталық атомының sp3 –гибридтенуі молекулаларда:
A) CCl4
B) CH4
C) NH3
D) C6H6
E) CO2
F. ) C3H6
G. ) C2H4
72$$$. σ- байланыс электрондық бұлттардың қаптасуы кезінде түзіледі:
A) s - s
B) s - px
C) px - px
D) py - px
E) py - pz
F) pz - pz
G. ) py - pz
73$$$. Донорлы-акцепторлы механизм бойынша түзіледі:
A)
![]()
B)
![]()
C)
![]()
D)
![]()
E)
![]()
F)
![]()
G)HCI
74$$$.σ-байланысына, π- и δ- байланысына, σ- и π- σ- байланысына қатысады:
A) σ-байланысына s-орбиталдардың электрондары
B) σ- және π- байланысына р-орбиталдардың электрондары
C) σ-, π- және δ- байланысына d-орбиталдардың электрондары
D) σ- және π- байланысына s және p -орбиталдардың электрондары
E) σ-, π- және δ- байланысына s және p -, d-орбиталдардың электрондары
F) σ- байланысына s және p -орбиталдардың электрондары
байланысына s және p -орбиталдардың электрондары
G) σ-связывании – тек d-орбиталдардың электр
75$$$. Cl2, SO2, HCN молекулаларының кеңістіктік конфигурациясы:
A) гантел тәрізді
B) бұрыштық
C) сызықтық
D) жазықүшбұрыштық
E) тетраэдрлік
F.).үшбұрышты
G.) шар
76$$.Орталық атомның sp-, sp2-, sp3-гибридті орбиталдарының геометриялық пішіні:
A) сызықтық
B) жазық үшбұрыштық
C) тетраэдр
D) бұрыштық
E) октаэдh
F) сызықты
С) гантель
77$$$. Орталық атомның sp2-, sp3d-, sp3d2 -гибридті орбиталдарының геометриялық пішіні:
A) жазық үшбұрышты
B) тригоналді бипирамида
C) октаэдр
D) бұрышты
E) тетраэдр
F) сызықтық
G)пирамида
78$$$.Мына молекулада валенттік бұрыш 180о тең:
A) BeCl2
B) CO2
C) XeF2
D) H2O
E) H2S
F) SO2
G) ) СO2
79$$$. Бейтараптану реакциясы:
A) HCl + NaOH NaCl + H2O
B) 2HCl + Ca(OH)2 CaCl2 + 2H2O
C) HNO3 + KOH KNO3 + H2O
D) Fe(OH) 3 Fe(OH) 3 Fe2 O3 + H2O
Fe2 O3 + H2O
E) Zn + CuSO4 ZnS Fe(OH) 3 Fe2 O3 + H2O
O4 +H2O
F) Fe(OH) 3 Fe2 O3 + H2O
G) Fe(OH) 3 Fe2 O3 + H2O
80$$$.FeCl3 гидролизі күшейеді:
A) Сілті қосқанда
B) Температурны жоғарылатқанда
C) FeCl3 концентрациясын жоғарылатқанда
D) Қысымды жоғарылатқанда
E) Катализаторды қосқанда
F) Қышқылды қосқанда
G.)Температураны төмендеткенде
81$$$. Донорлы-акцепторлы механизм бойынша түзіледі:
A)
B)
C)
D)
E)
F)
82$$$. Алмасу механизм бойынша түзіледі:
A)
B)
![]()
C)
![]()
D)
E)
F)
83$$$. σ-байланысына, π- и δ- байланысына, σ- и π- σ- байланысына қатысады:
A) σ-байланысына s-орбиталдардың электрондары
B) σ- және π- байланысына р-орбиталдардың электрондары
C) σ-, π- және δ- байланысына d-орбиталдардың электрондары
D) σ- және π- байланысына s және p -орбиталдардың электрондары
E) σ-, π- және δ- байланысына s және p -, d-орбиталдардың электрондары
F) σ- байланысына s және p -орбиталдардың электрондары
байланысына s және p -орбиталдардың электрондары
84$$$. CH4, NH3, H2O молекулаларының кеңістіктік конфигурациясы
A) тетраэдрлік
B) тригональді-пирамидальді
C) бұрыштық
D) жазықүшбұрыштық
E) сызықтық
F) плоскоквадратная
85$$$. H2, СО2, Н2О молекулаларының кеңістіктік конфигурациясы
A) гантел тәрізді
B) сызықтық
C) бұрыштық
D) жазықүшбұрыштық
E) тетраэдрлік
F) жазықквадратты
86$$$. Cl2, SO2, HCN молекулаларының кеңістіктік конфигурациясы:
A) гантел тәрізді
B) бұрыштық
C) сызықтық
D) жазықүшбұрыштық
E) тетраэдрлік
F) жазықквадратты
87$$$. SiF4, PCl3, SiF6 молекулаларының кеңістіктік конфигурациясы:
A) тетраэдрлік
B) тригоналді -пирамидалді
C) октаэдрлік
D) жазықүшбұрыштық
E) сызықтық
F) бұрыштық
88$$$.1800 бұрыш молекулаларда:
A) CO2
B) BeCl2
C) HCN
D) H2CO3
E) SiF4
F) SO2
89$$$.Орталық атомның sp-, sp2-, sp3-гибридті орбиталдарының геометриялық пішіні:
A) сызықтық
B) жазық үшбұрыштық
C) тетраэдр
D) бұрыштық
E) октаэдр
F) тригоналді пирамида
90$$$. Орталық атомның sp-, sp2-, sp3d-гибридті орбиталдарының геометриялық пішіні:
A) сызықтық
B) жазық үшбұрыштық
C) тригоналді бипирамида
D) бұрыштық
E) октаэдр
F) тетраэдр
G) тербелмелі
91$$$. Орталық атомның sp2-, sp3d-, sp3d2 -гибридті орбиталдарының геометриялық пішіні:
A) жазық үшбұрышты
B) тригоналді бипирамида
C) октаэдр
D) бұрышты
E) тетраэдр
F) сызықтық
92$$$. Ковалентті химиялық байланыс мынадай байланыс болып табылады:
A) қанныққан
B) бағытталған
C) берік
D) қаннықпаған
E) бағытталмаған
F) әлсіз
93$$$. Иондық химиялық байланыс мынадай байланыс болып табылады:
A) бағытталмаған
B) қаннықпаған
C) берік
D) бағытталған
E) қанныққан
F) әлсіз
94$$$. Мына молекулада валенттік бұрыш 180о тең:
A) BeCl2
B) CO2
C) XeF2
D) H2O
E) H2S
F) SO2
95$$$. Негіздік оксидтер:
A) CaO
B) Na2O
C) K2O
D) P2O5
E) SO3
F) CuO
96$$$. Күшті қышқылдар:
A) H2SO4
B) HCl
C) HNO3
D) H3PO4
E) HNO2
F) H2S
97$$$. Әлсіз қышқылдар:
A) HNO2
B) H3PO4
C) H2CO3
D) HNO3
E) HClO4
F) HCl
98$$$. Бір негізді қышқылдар:
A) HCl
B) HI
C) HBr
D) H2CO3
E) H2SO4
F) H3PO4
99$$$. Екі негізді қышқылдар:
A) H2S
B) H2SO4
C) H2CO3
D) H3PO4
E) HNO3
F) H3AsO4
100$$$. Бейтараптану реакциясы:
A) HCl + NaOH = NaCl + H2O
B) 2HCl + Ca(OH)2 = CaCl2 + 2H2O
C) HNO3 + KOH = KNO3 + H2O
D) Fe(OH) 3 = Fe2 O3 + H2O
E) Zn + CuSO4 = ZnSO4 + Cu
F) NH3 + HCl = NH4Cl
101$$$. Алмасу реакциясы:
A) AgNO3 + NaCl = AgCl ↓+ NaNO3
B) Na2SO4 + BaCl2= BaSO4↓ + 2NaCl
C) (NH4)2S + ZnCl2 = ZnS↓ + NH4Cl
D) Na + O2 = Na2 O
E) H2SO4 + NaOH = Na2SO4 + H2O
F) Cl2 + Na = NaCl
102$$$. Қосылу реакциясы:
A) NH3 + HCl = NH4Cl
B) S + O2 = SO2
C) Na + O2 = Na2 O
D) 2HCl + Ca(OH)2 = CaCl2 + 2H2O
E) HNO3 + KOH = KNO3 + H2O
F) AgNO3 + NaCl = AgCl + NaNO3
103$$$. Ыдырау реакциясы:
A) CaCO3 = CaO + CO2
B) NH4Cl = NH3 + HCl
C) Cu(OH)2 = CuO + H2O
D) S + O2 = SO2
E) Na + O2 = Na2 O
F) HNO3 + KOH = KNO3 + H2O
104$$$.Амфотерлі гидроксидтер:
A) Al(OH)3
B) Cr(OH)3
C) Zn(OH)2
D) Fe(OH)2
E) NaOH
105$$$. Амфотерлі гидроксидтер:
A) Be(OH)2
B) Al(OH)3
C) Fe(OH)3
D) NH4OH
E) Mg(OH)2
F) Ba(OH)2
106$$$. Амфотерлі гидроксидтер:
A) Sn(OH)2
B) Zn(OH)2
C) Sb(OH)3
D) Ni(OH)2
E) NaOH
F) KOH
107$$$. Қышқыл түзбейтін оксидтер:
A) NO
B) BaO
C) Ag2O
D) P2O3
E) SО2
F) CO2
108$$$. Кальцийдің дигидрофосфатында фосфордың , кальцийдің, оттегінің массалық үлесі:
A) 26
B) 27
C) 17
D) 92
E) 64
F) 02
109$$$. Азот (V) оксидінің 1\4 моль, 1\10 моль, 2 моль салмағы:
A) 27 г
B) 10,8
C) 216г
D) 32г
E) 44г
F) 49г
110$$$. Ерітінділерден мырышты жеңіл ығыстырады:
A) Кадмий
B) Кобальт
C) Мыс
D) Магний
E) Натрий
F) Калий
111$$$. Қышқылдармен де, сілтілермен де әрекеттеседі:
A) Мырыш
B) Бериллий
C) Алюминий
D) Натрий
E) Магний
F) Көміртегі
112$$$. Амфотерлі оксидтер:
A) Cr2O3
B) MnO2
C) ZnO
D) Mn2O3
E) CrO3
F) MnO
113$$$. Мына тұздардың сулы ерітінділерінің әрекеттесуінен химиялық реакция жүреді:
A) барий нитраты мен аммоний сульфаты
B) натрий карбонаты мен тұз қышқылы
C) калий гидроксиді мен азот қышқылы
D) калий сульфаты мен рубидий дихроматы
E) барий гидроксиді мен и магний нитраты
F) калий перманганаты мен натрий сульфаты
114$$$. Тотықтырғыш емес қышқылдардан мына металдар сутегін ығыстырады:
A) Марганец, темір
B) Мырыш, магний
C) алюминий, галлий
D) Платина, алтын
E) күміс, қорғасын
F) мыс, палладий
115$$$. Сұйылтылған күкірт қышқылымен өңдегенде ерітіндіге айналатын металл қоспалары:
A) Магний, барий, мырыш
B) Бериллий, қалайы, хром
C) Марганец, темір, алюминий
D) Скандий, теллур, қорғасын
E) Таллий, алюминий, галлий
F) Платина, алтын, күміс
116$$$.Тұз ерітіндісінен басқа металды ығыстыратын металл;
A) темір + мыс сульфаты (II)
B) мырыш + күміс нитраты
C) мыс + күміс нитраты (I)
D) күміс + сынып нитраты
E) Никель + магний хлориді
F) Хром + алюминий сульфаты
117$$$. Суда ерімейтін хлоридтер:
A) СuCl2
B) Hg2Cl2
C) PbCl2
D) NaCl
E) BaCl2
F) MnCl2
118$$$.Зертханада оттегін мына реакция бойынша алады:
A)
KClO3
![]()
B) KMnO4
C) NaNO3
D) SeO2
E) SiO2
F) FeSO4
119$$$. Зертханада хлорды мына реакция бойынша алады:
A) HCl(конц) + MnO2 →
B) HCl + KMnO4 →
C)
NaCl(раствор)
![]()
D) HClO →
E) HCl + KOH + HClO3 →
F) K2MnO4 + NaCl →
120$$$. Fe + H2SO4(конц) →.. реакциясында түзілетін өнімдер:
A) Fe2(SO4)3
B) SO2
C) H2O
D) Cu3N2
E) SO3
F) H2FeO4
121$$$. Cu + HNO3(суйыт) → …
A) Cu(NO3)2
B) NO
C) H2O
D) Cu3N2
E) NO2
F) Cu(NO2)2
122$$$. Cu + H2SO4(конц) →… реакциясында түзілетін өнімдер:
A) CuSO4
B) SO2
C) H2O
D) CuS
E) SO3
F) SO
123$$$. Аммоний дихроматының термиялық ыдырауында түзіледі:
A) N2
B) Cr2O3
C) H2O
D) N2O
E) Cr(OH)3
F) NH2NO3
124$$$. Металлдарға тән қасиет:
A) Электрөткізгіштік
B) жылуөткізгіштік
C) майырылғыштық
D) Конденсация
E) Кристалдануы
F) бағыталғыштық
125$$$. Металлдарға тән қасиет:
A) Механикалық беріктігі
B) Жоғары балқу температурасы
C) Жоғары беріктілік
D) Сутектік байланыс түзуі
E) Кристалдануы
F) бағыталғыштық
126$$$. Қайтымсыз реакция:
A) NH4NO3 → N2O + H2O
B) Fe(OH)3 → Fe2O3 + H2O
C) (NH4)2Cr2O7 → N2 + Cr2O7 + H2O
D) CO + H2 → CO2 + H2
E) 2NO2 → 2NO + O2
F) FeO + CO → Fe + CO2
127$$$. Қайтымды реакция:
A) N2 + 3H2 = 3NH2
B) H2 + I2 = 2HI
C) CO + H2 = CO2 + H2
D) NаОH + HCl = NaСl + H2О
E) ВаСl2 + H2SO4 = BaSO4 + HCl
F) KNO3 = KNO2 + O2
128$$$. Қайтымды реакция:
A) H2O = H+ + OH-
B)
HCO![]() = H+
+ CO
= H+
+ CO
C) 2SO2 + O2 = 2SO3
D) NаОH + HCl = NaСl + H2О
E) ВаСl2 + H2SO4 = BaSO4 + HCl
F) KNO3 = KNO2 + O2
129$$$. Суда еритін тұздар:
A) Mg3(PO4)2
B) CaSiO3
C) PbS
D) Ca(CH3COO)2
E) NaF
F) Ba(NO3)2
130$$$. Суда ерімейтін тұздар:
A) CaSiO3
B) PbI2
C) HgCl2
D) Ca(CH3COO)2
E) NaF
F) Ba(NO3)2
131$$$. Суда ерімейтін тұздар:
A) СuCO3
B) Bi2S3
C) NiS
D) Ca(CH3COO)2
E) NaF
F) Ba(NO3)2
132$$$. Фосфат-аниондармен тұнба түзетін катиондар:
A) Ag+
B) Mg2+
C) Ba2+
D) Na+
E) K+
F) Rb+
133$$$. Катионы, необразующие с фосфат-анионами осадок:
A) K+
B) Rb+
C) Cs+
D) Ag+
E) Mg2+
F) Ba2+
134$$$. К3[Fe(CN)6] кешенді қосылысында кешентүзушінің d-орбиталдарының тармақталу энергиясы жұптасқан энергиядан жоғары. Аталған кешен:
A) төменгіспинді
B)парамагнитті
C)октаэдрлі
D) жоғарыспинді
E)диамагнитті
135$$$. Келтірілегн фазалық ауысудан эндотермиялық болатыны:
A) Hg(с) = Hg(г)
B) Na(қ) = Na(г)
C) SO3(с) = SO3(г)
D) I2(г) = I2(қ)
E) H3PO4(с) = H3PO4(қ)
F) TiCl4(г) = TiCl4(с)
136$$$. Келтірілегн фазалық ауысудан эндотермиялық болатыны:
A) I2(қ) = I2(г)
B) S(ромб.) = S(г)
C) NaOH(қ) = NaOH(г)
D) H3PO4(с) = H3PO4(қ)
E) TiCl4(г) = TiCl4(с)
F) Hg(г) = Hg(с)
137$$$. Термодинамика ғылыми пән ретінде:
A)энергияның бір формадан басқаға ауысуы, жүйенің бір бөліктен басқаға ауысуы
B) химиялық және физикалық үрдістермен жүретін энергетикалық тиімділік
C) үрдістердің өздігінен жүру бағыты мен мүмкіндігі
D) химиялық және физикалық үрдістердің жылдамдығы
E)заттардың қасиеттеріне молеклалар құрылысының әсері
F) бейорганикалық және органикалық заттар молекуласындағы химиялық байланыс табиғатын
138$$$. Жүйенің энтропиясы өседі:
A) Қатты зат балқығанда
B) Газ таралғанда
C) Сұйықтың қайнау үрдісінде
D) конденсация кезінде
E) газ сығымдалғанда
F) ерітінділерден кристалғанда
139$$$. 2NO2(г) = N2O4(г) ; ∆H<0 тепе-теңдік жүйесінде:
A) бастапқы заттар жағына
B) көлем ұлғаюы жағына
C) N2O4 концентрациясының төмендеуі жағына
D) өнім түзілу жағына
E) көлем сығылу жағына
F) N2O4 концентрациясының көбеюі жағына
140$$$. Реакциялық қоспаға катализаторды ендіру:
A) белсендіру энергиясын төмендетеді
B) химиялық тепе-теңдікке әсер етпейді
C) тура және кері реакциялардың жылдамдығын арттырады
D) белсендіру энергиясын арттырады
E) тек тура реакцияның жылдамдығын арттырады
141$$$. Реакция өздігінен жүреді, егер:
A) ΔН < 0
B) ΔS > 0
C) ΔG < 0
D) ΔН > 0
E) ΔS < 0
142$$$. Реакция өздігінен жүрмейді, егер:
A) ΔН > 0
B) ΔS < 0
C) ΔG > 0
D) ΔН < 0
E) ΔS > 0
143$$$. 0< ΔН; FeCl3 + 3KSCN = Fe(SCN)3 + 3KCl; ΔН< 0 реакциясында тепе-теңдік оң жаққа ығысады, егер:
A) FeCl3 концентрациясын жоғарылату
B) KSCN концентрациясын жоғарылату
C) Fe(SCN)3 концентрациясын төмендету
D) Еріткіш қосу
E) Қышқыл қосу
144$$$. 0< ΔН; FeCl3 + 3KSCN = Fe(SCN)3 + 3KCl; ΔН< 0 реакциясында тепе-теңдік сол жаққа ығысады, егер:
A) КCl концентрациясын жоғарылату
B) Fe(SCN)3 концентрациясын жоғарылату
C) Температураны жоғарылату
D) Еріткіш қосу
E) Қышқыл қосу
145$$$. ΔН= +566 кДж; 2CO + O2 = 2CO2; ΔН= -566 кДж 0 реакциясында тепе-теңдік оң жаққа ығысады, егер:
A) O2 концентрациясын жоғарылату
B) CО концентрациясын жоғарылату
C) Температураны төмендету
D) Қысымды төмендету
E) СО2 концентрациясын жоғарылату
146$$$. ΔН= -180 кДж; N2 + O2 = 2NO; ΔН= +180 кДж реакциясында тепе-теңдік оң жаққа ығысады, егер:
A) O2 концентрациясын жоғарылату
B) N2 концентрациясын жоғарылату
C) Температураны жоғарылату
D) Температураны төмендету
E) Қысымды жоғарылату
147$$$. ΔН= +483 кДж; 2Н2 + O2 = 2Н2O; ΔН= -483 кДж реакциясында тепе-теңдік сол жаққа ығысады, егер:
A) Н2O концентрациясын жоғарылату
B) Қысымды төмендету
C) Температураны жоғарылату
D) Н2O концентрациясын төмендету
E) Қысымды жоғарылату
148$$$.Қысымды жоғарылату реакцияларда өнімнің шығымын жоғарылатады:
A) 2NO(г) + O2(г) = 2NO2(г)
B) PCl3(г) + Cl2(г) = PCl5(г)
C) 6HF(г) + N2(г) = 2NF3(г) + 3H2(г)
D) ZnS(т) + H2(г) = Zn(т) + H2S(г)
E) 2NO2(г) = 2NO(г) + O2(г)
149$$$. C + CO₂ ↔ 2CO жүйенің тепе-теңдік тұрақтысының өрнектелуін және егер CO₂ концентрациясын 4 есе төмендеткенде және жүйеде қысымды жоғарылатқанда тура реакцияның жылдамдығы қалай өзгеретінін көрсетіңіз:
А)
![]()
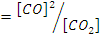
В) 4 есе төмендейді
C) 2 есе жоғарылайды
D) Kp=[ CO₂][C][ CO₂]
E) 0,25 есе төмендейді
150$$$. FeCl3+3KCNS=3KCl+Fe(CNS)3 реакциясында KCNS концентрациясын 2,3,4 есе жоғарылату тура реакция жылдамдығын өсіреді:
A) 8 есе
B) 27 есе
C) 81 есе
D) 256 есе
E) 9 есе
151$$$. Температуаны 100, 200, 300 жоғарылату реакция жылдамдығын өсіреді (ɣ=2):
A) 2
B) 4
C) 8
D) 30
E) 240
152$$$. Температуаны 200, 300, 400 жоғарылату реакция жылдамдығын өсіреді (ɣ=3):
A) 27
B) 81
C) 3
D) 30
E) 40
153$$$. Температуаны 200, 300, 400 жоғарылату реакция жылдамдығын өсіреді (ɣ=4):
A) 16
B) 64
C) 256
D) 30
E) 40
154$$$.Еріген затты еріткішке қосу мынаған алып келеді:
А) ерітіндінің қайнау температурасын жоғарылатады
B) еріткіштің қаныққан бу қысымын төмендетеді
C) осмостық қысымды көтереді
D) қайнау температурасын төмендетеді
E) қату температурасын жоғарылатады
155$$$. рН 6,2- ге тең ерітіндідегі [H⁺], [OH⁻] және судың иондық көбейтіндісінің мәні:
A) 6,3 ∙ 10⁻7
B) 1,6 ∙ 10⁻8
C) 10-14
D) 3 ∙ 10⁻²
E) 5,4 ∙ 10⁻⁸
156$$$. 0,2 М бір негізді әлсіз қышқыл етітіндісінің α=0,03. [H⁺], рН және Кw мәндері тең:
A) 6 ∙ 10⁻³
B) 2,22
C) 10⁻14
D) 9,78
E) 3 ∙ 10⁻²
F) 5,4 ∙ 10⁻⁸
157$$$. Күшті электролиттер:
A) Na2SO4
B) HCl
C) Cu(NO3)2
D) NH4OH
E) CH3COOН
158$$$. Күшті электролиттер:
A) HNO3
B) HCl
C) HI
D) H2CO3
E) CH3COOH
159$$$. Күшті электролиттер:
A) K2SO4
B) KNO3
C) NaCl
D) H3PO3
E) H2O
160$$$. Әлсіз электролиттер:
A) HCOOH
B) H2SiO3
C) H2S
D) HNO3
E) H2SO4
161$$$. Әлсіз электролиттер:
A) HNO2
B) H3BO3
C) H3PO3
D) HClO4
E) H2SO4
162$$$. Әлсіз электролиттер:
A) H2S
B) H2SO3
C) H2CO3
D) KNO3
E) NaNO3
163$$$. Әлсіз қышқыл тұздары:
A) KCN
B) Na2C2O4
C) K2SO3
D) KI
E) NaCl
164$$$. Әлсіз қышқыл тұздары:
A) Na2B4O7
B) CH3COONa
C) K2S
D) KNO3
E) KI
165$$$.рН > 7 тұздар ерітінділерінде:
A) Na3PO4
B) K2CO3
C) LiNO2
D) CrCl₃
E) MnSO₄
166$$$. рН > 7 тұздар ерітінділерінде:
A) NaH2PO4
B) KHCO3
C) LiCN
D) CrCl₃
E) MnSO₄
167$$$. рН < 7 тұздар ерітінділерінде:
A) ZnCl2
B) MnSO4
C) Fe(NO3)2
D) Na3PO4
E) K2CO3
168$$$. рН < 7 тұздар ерітінділерінде:
A) Zn(NO3)2
B) FeSO4
C) FeCl3
D) Na3PO4
E) K2CO3
169$$$. рН = 7 тұздар ерітінділерінде:
A) KNO3
B) Li2SO4
C) NaCl
D) Rb2SiO3
E) ZnCl2
170$$$. рН = 7 тұздар ерітінділерінде:
A) Rb2SO4
B) NaCl
C) KNO3
D) ZnCl2
E) MnSO4
171$$$. FeCl3 гидролизі күшейеді:
A) Сілті қосқанда
B) Температурны жоғарылатқанда
C) FeCl3 концентрациясын жоғарылатқанда
D) Қысымды жоғарылатқанда
E) Катализаторды қосқанда
172$$$. Na2CO3 гидролизі күшейеді:
A) Қышқылды қосқанда
B) Температурны жоғарылатқанда
C) Na2CO3 концентрациясын жоғарылатқанда
D) Қысымды жоғарылатқанда
E) Катализаторды қосқанда
173$$$. FeCl3 гидролизі әлсірейді:
A) Қышқылды қосқанда
B) FeCl3 концентрациясын төмендеткенде
C) Температурны төмендеткенде
D) Қысымды жоғарылатқанда
E) Катализаторды қосқанда
174$$$. Al(NO3)3 гидролизі әлсірейді:
A) Қышқылды қосқанда
B) Al(NO3)3 концентрациясын төмендеткенде
C) Температурны төмендеткенде
D) Қысымды жоғарылатқанда
E) Катализаторды қосқанда
175$$$. Сірке қышқылының диссоциациялану тұрақтысы 1,8 ∙ 10⁻5 . 0,1 М калий ацетаты ерітіндісінде гидролиздену тұрақтысы, гидролиздену дәрежесі және [OH-] тең:
A) 5,56 ∙10-10
B) 7,5 ∙ 10⁻⁵
C) 7,5 ∙ 10⁻6
D) 9,59 ∙10⁻3
E) 6,8 ∙ 10⁻6
176$$$. Қышқыл орта мына тұздар ерітінділерінде:
A) NH4Cl
B) FeCl2
C) Cu SO4
D) NaCH3COO
E) Na2СО3
177$$$. Сілтілік орта мына тұздар ерітінділерінде:
A) Nа 2S
B) K2CO3
C) Na2SO3
D) NaNO3
E) KCl
178$$$. Сулы ерітінділерінде гидролизденеді:
A) натрий сульфиті
B) натрий сульфиді
C) натрий нитриті
D) натрий нитраты
E) натрий хлориді
179$$$. Сулы ерітінділерінде қайтымсыз гидролизденеді:
A) алюминий сульфиді
B) фосфор (V) хлориді
C) бор хлориді
D) натрий фосфаты
E) цезий нитраты
180$$$. Тек тотықтырғыш қасиет көрсетеді:
A) KMnO4
B) K2Cr2O7
C) HNO3
D) MnO₂
E) FeSO₄
181$$$. Тек тотықтырғыш қасиет көрсетеді:
A) HNO3
B) K2CrO4
C) H2O2
D) MnO2
E) Cr2(SO4)3
182$$$. Тек тотықсыздандырғыш қасиет көрсетеді:
A) K2S
B) FeSO4
C) HCl
D) H2Cr2O7
E) K2MnO4
183$$$. Тек тотықсыздандырғыш қасиет көрсетеді:
A) H2S
B) Mg
C) CO
D) MnCl2
E) Cr(NO2)2
184$$$. Тотықтырғыштық-тотықсыздандырғыштық қасиет көрсетеді:
A) MnO2
B) Cr2(SO4)3
C) H2O2
D) Na2S
E) CO2
185$$$. Молекулаішілік тотығу-тотықсыздану реакциясы:
A) (NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
B) 2Cu(NO3)2 = 2CuO + 4NO2 + O2
C) CH4 = C + 2H2
D) P + 5HNO3 = H3PO4 + 5NO2 + H2O
E) PCl3 + Cl2 = PCl5
186$$$. Молекулаішілік тотығу-тотықсыздану реакциясы:
A) 3AuF = AuF3 + 2Au
B) 2KMnO4 = K2MnO4 + MnO2 + O2
C) 2KNO3 = 2KNO2 + O2
D) CaCO3 = CaO + CO2
E) 2Fe(OH)3 = Fe2O3 + 3H2O
187$$$. Диспропорциялану реакциясы:
A) 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
B) 2NO2 + H2O = HNO3 + HNO2
C) 3H2MnO4 = MnO2 + 2HMnO4 + 2H2O
D) (NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
E) 2Al(OH)3 = Al2O3 + 3H2O
188$$$. Диспропорциялану реакциясы:
A) 3CrO2 = Cr2O3 + CrO3
B) 4KClO3 = KCl + 3KClO4
C) NH4NO2 = N2 + 2H2O
D) CH4 + H2O = CO + H2
E) CO + H2O = CO + H2
189$$$. Азот мына қосылыстарда теріс тотығу дәрежесін көрсетеді:
A) NH3
B) N2H2
C) NH2OH
D) HNO2
E) Cu(NO3)2
190$$$. Қай реакция тотығу-тотықсыздану реакциясы бола алады:
A) Аg + Н2SO4 = Аg2SO4 + SO2 + Н2O
B) КМnO4 + КОН = К2МnO4 + O2 + Н2O
C) Н2S + НСlO = S + НСl + Н2O
D) Nа2СrO4 + Н2SO4 = Na2Сr2O7 + Н2O + Nа2SO4
E) Вi(NО3)3 + 2КОН = Вi(ОН)2NО3 + 2КNО3
191$$$. Қай реакция тотығу-тотықсыздану реакциясы бола алмайды:
A) Н2SO4 + ВаС12 = ВаSO4 + 2НСl
B) СuSO4 + КОН = Сu(ОН)2 + К2SO4
C) Nа2Сr2O7 + NаОН = 2Nа2СrO4 + Н2O
D) НСlO4 + SO2 + Н2O = НСl + Н2SO4
E) К2МnO4 + Н2O = КМnO4 + МnO2 + КОН
192$$$. НСlO4 + SO2 + Н2O = НСl + Н2SO4 реакциясындағы тотықтырғыш, тотықсыздандырғыш және тотығу-тотықсыздану реакциясының типін анықтаңыз:
A) НСlO4
B) SO2
C) Молекула аралық
D) НСl
E) Н2SO4
193$$$. Аg + Н2SO4 = Аg2SO4 + SO2 + Н2O реакциясындағы тотықтырғыш, тотықсыздандырғыш және тотығу-тотықсыздану реакциясының типін анықтаңыз:
A) S+6
B) Аg
C) Молекула аралық
D) Н+
E) S+4
194$$$. Күшті тотықтырғыштар:
A) K2Cr2O7
B) KMnO4
C) K2CrO4
D) H2
E) Zn
195$$$.PbO2 реакциясында тотықтырғыш:
A) PbO2 + MnSO4 + HNO3 →
B) PbO2 + Н2О2 →
C) PbO2 + КI + НNO3(разб) →
D) PbO2 + CaO →
E) PbO2 + NaOH →
196$$$. Қосылыстарда хлордың тотығу дәрежесі:
A) -1
B) +3
C) +7
D) -2
E) +4
197$$$. KJ + H2O2 + H2SO₄ → J2 + K2SO₄ + H2O реакциясында сутегі пероксидінің, калий иодидінің рөлін және теңдеудің оң жағының коэффициенттерінің қосындысы нешеге тең:
A) Тотықтырғыш
B) Тотықсыздандырғыш
C) 4
D) Орта
E) Катализатор
198$$$. FeSO4 + K2CrO4 + H2SO4 → …… реакциясында тотықтырғыш, тотықсыздандырғыш және тотықтырғыш қабылдаған электрондар санын анықтаңыз:
A) Хром
B) Темір
C) 6
D) оттегі
E) 1
199$$$. PbS + H2O2 → PbSO₄ + H2O реакциясындағы сутегі пероксидінің моль санын, тотықсыздандырғыштың берген электрондар саны мен тотықтырғыш қабылдаған электрондар санын анықтаңыз:
A) 4
B) 8
C) 2
D) 3
E) 1
200$$$. S + H2O + Cl2→ H2SO4 + HCl реакциясындағы тотықсыздандырғыштың берген электрондар саны мен тотықтырғыш қабылдаған электрондар санын және теңдеудің оң жақ бөлігінің коэффициенттер қосындысын анықтаңыз:
A) 6
B) 2
C) 8
D) 3
E) 5
