
Питання1. Алотропні модифікації карбону
Карбон
– хім.
елемент 4-ї групи, на останній оболонці
має 4 валентних електрона. Електронна
формула 1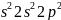 .
Для
нього можливі гібріди
.
Для
нього можливі гібріди
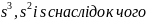 і
утворюються різні форми карбону.
і
утворюються різні форми карбону.
Алотропні модифікації карбону - природні : алмаз, графіт, фулурен, вуглецеві нанотрубки; штучні: карбін, графен, аморфний вуглець у вигляді сажі і деревного вугілля
Алмаз
Поширеними природними алотропними видозмінами карбону є алмаз і графіт. Ці речовини відрізняються між собою розміщенням атомів у вузлах кристалічних ґраток.
В алмазі щодо будь-якого атома карбону 4 сусідніх атоми розташовані в кутах правильного тетраедра. Завдяки такому розташуванню атомів карбону всі зв’язки рівноцінні (прості ковалентні), а відстані між атомами — однакові.
Алмаз прозорий, безбарвний, не проводить електричного струму, дуже добре заломлює світло. Алмази використовують для різання скла, буріння гірських порід (алмазні різці,свердла, шліфувальні круги), для різання і шліфування металів.
Спеціально оброблений алмаз називають діамантом, він високо цінується серед ювелірних прикрас.
Графіт
У кристалічній ґратці графіту атоми карбону розташовані окремими шарами. Зв’язки між атомами реалізуються лише в шарі, який нагадує бджолиний стільник. Кожний атом карбону сполучений із 3-ма іншими атомами простими ковалентними зв’язками за рахунок трьох валентних електронів. 4-ий електрон переходить від одного атома до іншого в шарі. Графіт досить м’який ( олівець). Графіт непрозорий, сірого кольору, з металічним блиском, масний на дотик і досить м’який. Проводить електричний струм і тепло. Графітовий порошок використовують для змащування рухомих частин машин і механізмів, щоб зменшити силу тертя. Завдяки електропровідності його використовують у хімпромисловості як матеріал для електродів, а завдяки теплопровідності — у теплообмінниках.
Карбін
Карбін спочатку добули синтетичним способом, а потім виявили в природі у вигляді прожилок і вкраплень у графіті. Атоми Карбону в карбіні сполучені в прямолінійні карбон-карбонові ланцюги =С=С=С= або –С_С–С_С–, розташовані паралельно один до одного. Це біла тверда речовина з надзвичайно довгими молекулами.
Карбін має напівпровідникові властивості, які посилюються під дією світла. На цій властивості базується його практичне застосування у фотоелементах.
Фулерени
Фулере́ни — п’ята алотропна модифікація вуглецю. Відкриті в 1985 Робертом Керлом, Гарольдом Крото й Річардом Смолі, ці невеличкі молекули, що складаються тільки з атомів карбону. Свою назву фулерени отримали за прізвищем архітектора Бакмінстера Фулера, сконструював купол і павільйон США на виставці у Монреалі у 1967 році у вигляді сполучених пентагонів та гексагонів.
Першовідкривачі
отримали Нобелівську премію з хімії за
1996 рік. Найвідоміший фулерен —
молекула
 ,
яка має ідеальну форму футбольного
м'яча. Природні фулерени можна знайти
в сажі.
,
яка має ідеальну форму футбольного
м'яча. Природні фулерени можна знайти
в сажі.
Вуглецеві нанотрубки— протяжні циліндричні структури діаметром від одного до декількох десятків нанометрів і завдовжки до декількох мікрон складаються з однієї або декількох згорнутих в трубку гексагональних графітових площин (графенів) і закінчуються зазвичай півсферичною головкою.
Питання 2. Фізичні і Хімічні властивості алотропів карбону
Фізичні властивості алотропів карбону
Будова кристала графіту обумовлена sp2-гібридизацією. Кристали графіту належать до гексагональної сингонії. Відстань між атомами (сусідніми) в шестикутнику становить 0,141 нм, а між плоскими нормальними шарами – 0,340 нм, що обумовлює слабкий зв’язок між шарами.
Графіт - м’яка темно-сіра електропровідна речовина зі слабким металічним блиском і густиною 2,22×102 кг/м3 та температурою плавлення Тs = 4070 К. Він належить до найбільш тугоплавких простих речовин. Із графіту готують електроди для електролізу.
Алмаз при T>2073 К перетворюється в графіт (ентальпія перетворення – 1,8 кДж/моль). Атоми карбону в структурі алмазу зє’днані міцним ковалентним зв’язком з чотирма сусідніми атомами, розміщеними у вершинах тетраедра, з малою міжатомною відстанню (0,154 нм), що обумовлює його унікальну твердість (10 за шкалою Маоса). Більшість кристалів вибірково поглинають електромагнітне випромінювання в IЧ - області (λ=8-10мкм) та УФ - області (λ = 0,3 мкм). Вони називаються алмазом першого типу. Кристали алмазу другого типу прозорі при λ = 0,22-1000 мкм. Різниця спектроскопічних властивостей обумовлена ймовірно наявністю домішок.
Питомий електричний опір алмазу першого типу
ρ ~ 1012-1014 Ом×м (діелектрик). Деякі кристали алмазу другого типу мають ρ = 5 Ом×м, вони є домішковими напівпровідниками (н/п) р-типу. Бувають кристали алмазу з ρ ~ 10-2 Ом×м.
Якісний склад графіту й алмазу однаковий: при спалюванні обох речовин утворюється тільки вуглекислий газ СО2. За стандартних умов найбільш стійкою формою вуглецю є графіт. За певних умов алмаз перетворюється на графіт, а графіт — на алмаз.
Питання 3. Методи синтезу алмазу.
синтезу було здійснено у 1953р. Теоретичною основою для успішної реалізації його стала розрахована О.І.Лейпуським (1939) та Мак-Квіном і Банді (1984) діаграма стану вуглецю (рис.1.17).

Перший метод
Перетворення графіту в алмаз
– це поліморфний перехід, оскільки одна кристалічна решітка атомів карбону перетворюється в іншу. Але поліморфний перехід являє собою перехід від однієї кристалічної решітки до іншої тієї самої хімічної сполуки. Перетворення їх - це хімічний процес, який відбувається зі зміною валентного стану карбону, природи хімічного зв’язку (розриваються ковалентні зв’язки карбону в графіті та утворюються нові -зв’язки С-С в алмазі) та структури вуглецевого скелета. Перетворення можна трактувати як фазовий перехід однієї кристалічної решітки в іншу без зміни валентного стану карбону і природи С-С зв’язків, тобто як чисто фізичний процес Хімічний синтез алмазу
Другий метод
Хімічний синтез алмазу
– не просто фізичне укладання атомів карбону у певному порядку, це ще й утворення ковалентних σ-зв’язків атомів С, які перебувають у стані
sp3-гібридизації, тобто хімічний процес. При синтезі алмазу та графіту в умовах надвисокого тиску (НВТ) відбувається не тільки перебудова однієї
кристалічної решітки в іншу, а ще й зміна типу гібридизації валентних електронів карбону (sp2→sp3), що супроводжується розривом π-зв’язків та утворенням нових ковалентних σ-зв’язків між атомами карбону.

Рисунок 1.18 - Діаграма стану системи графіт –алмаз
із областями отримання алмазу різними методами
У процесі можна виділити три стадії:
- утворення мономера поліконденсації
- зворотна стадія полімеризації,
- стадія поліконденсації,
Питання 4 Методи одержання АПП ( термохімічні ).
Метод гарячої спіралі
точкового нагріванн
лазерне напилення
Методу одержання АПП у реакторі з гарячою спіраллю полягає у такому. Суміш метану (3-7%) із воднем подається до реактора, у якому температура 870-1070 К і підтримується тиск 9-13 кПа. Нагрівник із W - спіралі встановлюється над підкладкою (0,4-0,5 см), яку нагрівають до 1170-2470 К. Між підкладкою і нагрівником створюється різниця потенціалів 100 В. У результаті розпаду метану в атмосфері водню відбувається конденсація АПП на підкладку.
У методі точкового нагрівника роль точкового джерела відіграє контакт між двома графітовими стержнями, через які пропускається електричний струм. При температурі підкладки до 400 К і тискові атомів карбону 10-3-10-2Па АПП осаджуються зі швидкістю 0,1-1,0 нм/с. При осадженні атомів карбону з низькою енергією структура плівки слабо упорядкована і близька до графітної.
Метод лазерного напилення завдяки своїй простоті та відтворюваності результатів набуває все більшого застосування. При густині потоку енергії на поверхню етод лазерного напилення за складом і енергією частинок пари близький до методу осадження із іонних пучків.
Питання 5. Методи одержання АПП ( на атмосфері ).
Ще цей метод називають -метод одержання АПП у полум’ї або бар’єрному розряді.
У першому випадку синтез полікристалічних АПП відбувається зі швидкістю близько 25 нм/с при горінні ацетилену в кисні при атмосферному тиску.
Другий
метод був запропонований у 1993 році
Шварцем і Салгом. Суть його полягає в
наступному. Реакційна камера (рис.
1.22), що складається із двох

Рисунок 1.22 – Схема нанесення АПП у бар’єрному
розряді
плоскопаралельних електродів 1 і 2, між якими розміщується діелектричний бар’єр 3 (скляна пластина товщиною 1,5 мм), і вакуумно-ущільненого (6) газового проміжку 4 (товщина 1 мм), через який прокачується (5) реактивний газ (CH4, C2H2, C2H2+H2, C2H2+Ar).
Тиск у камері – атмосферний. При подачі на високовольтний електрод однополярних мікросекундних імпульсів напруги в 100-200 мкс, амплітуди від -17 до +17 кВ і частотою повторення 0,2-3 кГц, у газовому проміжку виникає бар’єрний розряд. Реактивний газ дисоціює, а із
утворених радикалів на бар’єрі і на заземленому електроді осаджується АПП.
