
- •1. Химическая посуда
- •2. Гравиметрическое определение сульфата бария
- •3.Фиксанальное титрование
- •4. Спектрофотометрические методы
- •4.1. Определение меди спектрофотометрическим методом
- •4.2. Спектрофотометрическое определение железа с 1,10 - фенантролином
- •5. Красители
- •6. Определение хпк ускоренным методом.
4.2. Спектрофотометрическое определение железа с 1,10 - фенантролином
Суть метода:
ъВ основе данного метода количественного определения железа лежит реакция катионов железа (II) с 1,10-фенантролином, в результате которой образуются оранжево-красные комплексные ионы, в которых один катион железа (II) связан с тремя молекулами 1,10-фенантролина [3]. Содержащиеся в анализируемом растворе ионы железа (III) предварительно восстанавливают солянокислым гидроксиламином [2]:
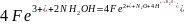 [2]
[2]
 [3]
[3]
Образование комплекса железа (II) с 1,10-фенартролином происходит в широком диапазоне рН: его окраска стабильна при рН=2-9 и сохраняется в течение длительного времени. Измерения оптической плотности полученных растворов проводят при = 510 нм.
Приготовление стандартного раствора железа и реактивов:
Стандартный раствор железа. 0,8634 г железоаммонийных квасцов (FeNH4(SO4)2∙12H2O) количественно переносят в мерную колбу на 100 мл, добавляют дистиллированную воду в количестве, необходимом для растворения соли (≈ 50 мл). Затем вводят 2,5 мл концентрированной серной кислоты, доводят до метки дистиллированной водой и тщательно перемешивают содержимое колбы. В 1 мл такого раствора содержится 1 мг железа. Для приготовления рабочего раствора железа стандартный раствор разводят в 100 раз. Рабочий раствор готовят непосредственно перед определением.
Раствор 1,10-фенантролина. 100 мг 1,10-фенантролина моногидрата растворяют в 100 мл дистиллированной воды.
Раствор гидроксиламина. 10 г гидроксиламина гидрохлорида растворяют в 100 мл дистиллированной воды.
Ацетатный буфер. 10 г уксуснокислого натрия (CH3COONa ∙ 3H2O) растворяют в 100 мл дистиллированной воды.
Ход работы:
В мерные колбы на 50 мл внести пипетками 1, 2, 5, 10 и 20 мл рабочего раствора железа
В каждую колбу добавить 0,5 мл раствора гидроксиламина, 4 мл ацетатного буфера и 2,5 мл 1,10 - фенолфталеина.
Приготовить холостую пробу на дистиллированной воде со всеми реактивами, кроме раствора железа
Содержимое колб довести до метки дистиллированной водой и перемешать
Расчет концентрации каждого раствора
Расчет концентрации полученного раствора
Расчет ведется для калибровочного раствора железа, который готовили внесением 10 мл рабочего раствора в колбу на 50 мл
Рассчитаем количество железа в 1000 мл раствора
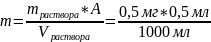 (9)
(9)
где А – аликвота железа, введённого в колбу на 50 мл.
Тогда количество железа в колбе на 50 мл будет равно:
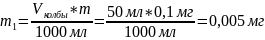 (10)
(10)
Концентрация рабочего раствора железа - 0,005 мг/л
Измерить оптическую плотность полученных стандартов на спектрофотометре СФ-2000.
Концентрация железа в калибровочном растворе, мг/л
0,1
0,2
0,5
1
2
Оптическая плотность раствора (D)
0,02
0,05
0,1
0,27
0,59
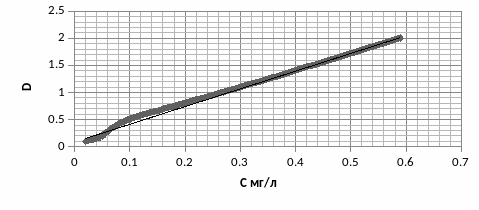
Построить калибровочный график по 5 точкам.
Задача:
Дан раствор с неизвестной концентрацией железа. Измерить оптическую плотность данного раствора с помощью спектрофотометра. По калибровочному графику определить концентрацию железа в этом растворе.
Спектрофотометр показал, что оптическая плотность раствора равна 0,18. Концентрация по калибровочному графику равна 0,52.
