
- •1. Химическая посуда
- •2. Гравиметрическое определение сульфата бария
- •3.Фиксанальное титрование
- •4. Спектрофотометрические методы
- •4.1. Определение меди спектрофотометрическим методом
- •4.2. Спектрофотометрическое определение железа с 1,10 - фенантролином
- •5. Красители
- •6. Определение хпк ускоренным методом.
Министерство образования и науки Российской Федерации
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ТЕХНОЛОГИИ И ДИЗАЙНА»
ИНСТИТУТ ПРИКЛАДНОЙ ХИМИИ И ЭКОЛОГИИ
Кафедра: Инженерной химии и промышленной экологии.
Направление подготовки: 240100.62 Энерго- и ресурсосберегающие процессы в химической технологии, нефтехимии и биотехнологии.
Квалификация: Бакалавр.
Отчёт по учебной практике
Срок практики с _____ по _____ 2015г.
Студент 2 курса ХДА-6 группы
Струковой В.В.
Руководитель практики от университета
Доц. Левина В.И.
Санкт-Петербург
2015
Cодержание
1.Химическая посуда 3
2. Гравиметрическое определение сульфата бария 4
3.Фиксанальное титрование 6
4.Спектрофотометрические методы 7
4.1. Определение меди фотоколориметрическим методом 7
4.2. Спектрофотометрическое определение железа с 1,10-фенантролином 9
5.Красители 12
6.Определение ХПК ускоренным методом 12
Список использованной литературы 15
1. Химическая посуда
Применяемую в химических лабораториях посуду можно разделить на несколько групп:
К группе общего назначения относятся те предметы химической посуды, которые всегда должны быть в лабораториях и без которых нельзя провести большинство работ. К ним относятся: пробирки, воронки (простые и делительные), стаканы, плоскодонные колбы, конические колбы, колбы Бунзена, холодильники (прямые и обратные), кристаллизаторы, тройники, краны.
К группе специального назначения относятся те предметы химической посуды, которые употребляются для одной определенной цели: пикнометры, дефлегматоры, ареометры, круглодонные колбы и др.
К мерной посуде относятся: пипетки, бюретки, мерные колбы, мерные цилиндры и мензурки.
Мерные цилиндры (рис. 1) – стеклянные толстостенные сосуды с нанесенными на наружной стенке делениями, указывающими объем в миллилитрах. Мерные цилиндры бывают различной емкости – от 5 мл до 2 л.

2. Гравиметрическое определение сульфата бария
Суть метода:
Гравиметрическим (весовым) анализом называют метод количественного химического анализа, основанный на точном измерении массы определяемого компонента пробы, выделенного в элементарном виде, либо в виде соединения определенного состава. Методы гравиметрического анализа можно подразделить на 2 группы:
1. Методы отгонки. В методах отгонки определяемую составную часть исследуемого объекта отгоняют. Примером такого метода может быть определение двуокиси углерода в карбонатных породах. Для этого из навески карбоната (например, СаСО3) действием соляной кислоты выделяют СО2, который отгоняют в предварительно взвешенный приемник с поглотителем (смесью СаО и NaOH). Затем по увеличению массы приемника рассчитывают количество СО2. Необходимо помнить, что метод отгонки не является универсальным и может быть применен только в тех случаях, если проба содержит летучий компонент или когда определяемый компонент при той или иной реакции может превращаться в летучее вещество.
2. Методы осаждения. В методах осаждения навеску анализируемого вещества тем или иным способом переводят в раствор, после чего определяемый компонент осаждают в виде малорастворимого соединения. Выпавший осадок выделяют фильтрованием, тщательно промывают, прокаливают (или высушивают) и точно взвешивают. По массе осадка и формуле определяемого компонента рассчитывают его содержание в процентах от массы навески. В данном методе наиболее важной является именно операция осаждения. От того, насколько удачно выбран осадитель и какое количество его прибавлено, в каких условиях проведено осаждение, в значительной степени зависит точность результатов анализа. Необходимо помнить, что полученные в ходе анализа осадки часто приходится прокаливать, а при прокаливании многие осадки претерпевают химические изменения. Таким образом, взвешивают часто соединение в точности не того состава, которое было получено при осаждении, а то, которое получено в результате прокаливания. Поэтому различают осаждаемую и весовую формы. Осаждаемая форма – это то соединение, которое осаждается из раствора при взаимодействии с соответствующим осадителем. Весовая форма – это соединение, которое взвешивают для получения окончательного результата анализа. Например, при определении Al3+ или Fe3+ осаждаемой формой являются Al(OH)3 и Fe(OH)3, а весовой – безводные окиси Al2O3 и Fe2O3 соответственно.
Ход работы:
Взять заданную навеску сульфата натрия (0,7040 г) и стакан на 600 мл. В стакан налить 50 мл дистиллированной воды, прибавляют 25 мл соляной кислоты (1:1 (об.)) и нагреть раствор почти до кипения.
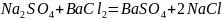 [1]
[1]
Рассчитать массу хлорида бария, необходимую для осаждения сульфата натрия. К вычисленному объему добавить 10 % избытка раствора осадителя. Нагреть раствор.
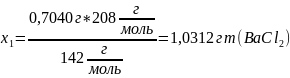 чистого
(1)
чистого
(1)
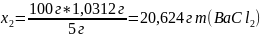 5%
- го раствора (2)
5%
- го раствора (2)
 с
избытков в 10% (3)
с
избытков в 10% (3)
К вычисленной массе хлорида бария добавить 50 мл растворенного в воде сульфата натрия. Раствор нагреть почти до кипения. Далее горячий раствор хлорида бария очень медленно, по каплям прилить к горячему раствору сульфата натрия. После того, как осадок осядет на дно стакана, проверить полноту осаждения, для чего к прозрачному раствору добавить несколько капель хлорида бария.
Раствор аккуратно декантируют на предварительно взвешенный фильтр(1,4695 г). Осадок в стакане промывают 2-3 раза теплой водой при перемешивании, декантируя промывную жидкость после оседания осадка. Фильтрат из стакана, стоящего под воронкой, выливают.
Фильтр помещают в стакан и подсушивают на горячей плитке или в сушильном шкафу до полного испарения воды.
Взвешивают фильтр с осадком и определяют вес осадка.
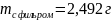
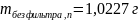
По результатам анализа рассчитывают процент экспериментально полученного осадка от теоретического (рассчитанного по уравнению).
Масса осадка по уравнению
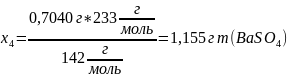 теоретическая
(4)
теоретическая
(4)
Процент экспериментально - полученного осадка сульфата бария
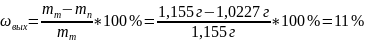 (5)
(5)
