
Способы перевода вещества в окрашенное состояние
Способностью поглощать в видимой области обладает очень небольшое количество соединений. Однако существует возможность путем химических превращений перевести большое число веществ в интенсивно поглощающие в видимой области соединения. Реакции аналита и реагента, приводящие к образованию окрашенных соединений, могут быть, в случае неорганических веществ, и реакциями комплексообразования и окисления-восстановления. Реакции с органическими реагентами существенно повышают чувствительность и селективность фотометрических определений. Кроме того, повысить чувствительность фотометрических реакций, можно проводя их в двухфазной системе вода-органический растворитель. Причем, как правило, реагент и определяемое вещество вносят в водную фазу, а образующееся окрашенное соединение локализуется в фазе органического растворителя. Такой метод называется экстракционно-фотометрическим. Органические кислоты и основания при ионизации образуют соответствующие ионы, способные объединяться в ионную пару с ионами красителя и экстрагироваться в органический растворитель.
Основные требования к реагентам и реакциям в фотометрии следующие:
Предпочтение отдается соединениям, интенсивно поглощающим в видимой области и имеющим пологий максимум в спектре;
Реакция с определяемым веществом должна быть контрастной (максимум спектра поглощения образующегося соединения должен существенно отличаться от максимума спектра поглощения исходного вещества);
Реакция должна протекать быстро и до конца;
Реагенты должны быть высокоселективными (специфичными).
Количественный фотометрический анализ
Закон Бугера-Ламберта-Бера устанавливает линейную связь между оптической плотностью (А – absorption или D – density) и концентрацией С вещества в растворе:
![]() (6)
(6)
где С выражено в моль/л, l – в см.
Поскольку
![]() зависит от длины волны света, количественный
анализ обычно начинается со снятия
спектра вещества. Это необходимо для
выбора для выбора длины волны, при
которой будет производиться анализ.
Обычно, фотометирование выполняется
при длине волны максимума спектра
поглощения вещества, так как здесь
наблюдается максимальная чувствительность.
Если веществ имеет несколько максимумов
поглощения, лежащих как в видимой, так
и УФ области, выбирают максимумы лежащие
в видимой области спектра. Это связано
с тем, что в ультрафиолете сильно
поглощают многочисленные примеси, что
приводит к большим ошибкам в анализе.
зависит от длины волны света, количественный
анализ обычно начинается со снятия
спектра вещества. Это необходимо для
выбора для выбора длины волны, при
которой будет производиться анализ.
Обычно, фотометирование выполняется
при длине волны максимума спектра
поглощения вещества, так как здесь
наблюдается максимальная чувствительность.
Если веществ имеет несколько максимумов
поглощения, лежащих как в видимой, так
и УФ области, выбирают максимумы лежащие
в видимой области спектра. Это связано
с тем, что в ультрафиолете сильно
поглощают многочисленные примеси, что
приводит к большим ошибкам в анализе.
В случае строгого выполнения закона Бугера-Ламберта-Бера (о чем можно судить только по линейности графика D - C), зная коэффициент экстинкции при длине волны λ можно рассчитать содержание этого вещества в анализируемом растворе по формуле:
С = D/ l (7)
Это так называемый метод эталона.
Коэффициент экстинкции или коэффициент молярного поглощения представляет собой оптическую плотность раствора с концентрацией 1 моль/л, помещенного в кювету с толщиной поглощающего слоя 1 см. Он имеет размерность см2/моль, однако принято приводить значение молярного коэффициента поглощения без обозначения его размерности. В практической работе измерение D = невозможно, так как оптические плотности 1М растворов намного превышают те значения, которые доступны измерению. Наиболее простой способ получения величины коэффициента экстинкции путем расчета по формуле:
= D/Cl (8)
Однако определённая таким образом величина может существенно отличаться от истинного значения.
В медицине при анализе биологических жидкостей или при других рутинных анализах, когда заранее известна линейность зависимости оптической плотности от концентрации, для определения содержания вещества (Сх) чаще всего используют метод стандарта: определяют оптическую плотность стандартного раствора (Dст) точно известной концентрации (Сст) и оптическую плотность исследуемого раствора (Dх), затем находят величину Сх:
![]() (9)
(9)
При использовании методов стандарта и эталона важно, чтобы концентрация эталонного раствора была близка к концентрации анализируемого раствора
Если необходимо проводить анализ большого числа образцов, то удобно пользоваться методом калибровочного графика. Готовят несколько калибровочных растворов точно известной концентрации (С1–С5) и определяют их оптическую плотность. Затем строят графическую зависимость оптической плотности от концентрации. Определив оптическую плотность исследуемого раствора (Dх), по графику находят неизвестную концентрацию вещества (Сх). Метод более трудоемкий, но наиболее точный. В отличие от других методов, метод калибровочного графика позволяет определять концентрацию окрашенных растворов даже в тех случаях, когда основной закон светопоглощения не соблюдается. Для построения градуировочной кривой в таких случаях готовят значительно больше стандартных растворов, отличающихся друг от друга по концентрации не более чем на 10 %.
Теоретически калибровочный график должен представлять собой прямую линию, выходящую из начала координат, тангенс угла наклона которой к оси концентрации равен ε (Рис 1. 1). Однако чаще график имеет вид как на Рис.1. 2. D0 называется холостым определением или холостым опытом. Основными причинами его возникновения являются: 1)наличие примесей определяемого вещества в растворителях и реактивах, 2) наличие окрашенных примесей в реагентах 3) поглощение света (частичное) самим реагентом. Последний случай характеризуется близостью спектров поглощения реагента и образующегося соединения и наиболее часто встречается в фотометрии водных растворов. В таких случаях говорят о низкой контрастности фотометрической реакции.
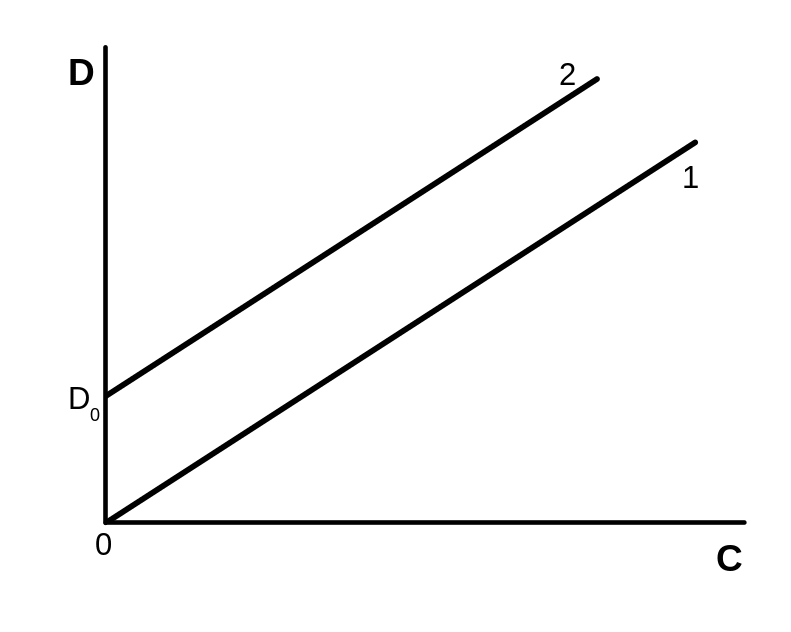 Рис. 1. Зависимость D
от С
Рис. 1. Зависимость D
от С
1 теоретическая
2 при наличии поглощающих примесей
Для устранения ошибок холостого опыта, как непостоянной величины, используют следующий прием: в качестве раствора сравнения используют не чистый растворитель, а растворитель с реагентом, но без пробы анализируемого вещества. В этом случае раствор сравнения слегка окрашен и, как правило, имеет оптическую плотность равную D0.
Часто калибровочный график отклоняется от прямой линии в области высоких концентраций. Это ухудшает точность определения. Причиной таких отклонений может служить протекание фотометрических реакций не до конца.
Следует заметить, что состав фона стандартного, калибровочных и исследуемого раствора должен быть одинаковым, а также то, что закон Бугера-Ламберта-Бера без ограничений выполняется только для разбавленных растворов и в условиях монохроматического светового потока (чем выше степень монохроматичности светового потока, тем шире диапазон определяемых концентраций, чувствительность и селективность определения).
Определение концентрации растворов методом добавок основано на сравнении оптической плотности раствора до и после добавления известного количества определяемого вещества. Метод добавок обычно применяют для устранения мешающего влияния посторонних веществ, для оценки правильности методики фотометрического анализа, а иногда и для упрощения работы. Этот метод позволяет создать одинаковые условия для фотометрирования исследуемого и стандартного (с добавкой) окрашенных растворов, поэтому его целесообразно применять для анализа малых количеств различных компонентов в присутствии больших количеств посторонних веществ при анализе соловых растворов. Неизвестную концентрацию находят расчетным или графическим способами.
Пусть оптическая плотность исследуемого раствора с концентрацией Сх равна Dx. После внесения добавки, концентрация определяемого компонента в которой равна Сд, оптическая плотность раствора станет Dx+д. Пусть, для анализа взята аликвота исследуемого раствора Vx к которой добавлено Vд мл стандартного раствора. Тогда для обоих растворов можно записать:
Dx= ε Cx l (10)
Dx+д
=
![]() (11)
(11)
откуда
Сх
=
![]() (12)
(12)
Добавки следует брать в таких количествах, чтобы не происходило «потери точности на вычитание». Минимальная разность Dx+д-Dx должна быть не менее 0,1. Для повышения точности используют также метод двойных и многократных добавок.
Рассмотренные выше методы количественного фотометрического анализа применимы к однокомпонентным растворам или к тем случаям анализа сложных растворов, когда удается выбрать такую длину волны, на которой кроме определяемого компонента больше ничего не поглощает. Однако часто приходится определять два и более компонентов в одном растворе. При этом возможны варианты, когда кривые светопоглощения обоих веществ не перекрываются, перекрываются на некотором участке спектра или по всему спектру.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Фотометрическое определение железа
