
Окислительно-восстановительное титрование
К окислительно-восстановительным относятся химические процессы, которые сопровождаются изменением степени окисления атомов веществ, участвующих в реакции.
Вещества, атомы которых в ходе реакции понижают степень окисления благодаря присоединению электронов, называются окислителями, т.е. они являются акцепторами электронов. При этом окислители сами восстанавливаются. Восстановители, являясь донорами электронов, окисляются.
Продукт восстановления окислителя называется восстановленной формой, а продукт окисления восстановителя – его окисленной формой. Окислитель со своей восстановленной формой составляет полупару окислительно-восстановительной системы, а другой полупарой является восстановитель со своей окисленной формой. Таким образом, восстановитель с окисленной формой и окислитель со своей восстановленной формой составляют две полупары (редокс пары) окислительно-восстановительной системы.
Все ОВ процессы (редокс реакции) можно разделить на три типа
а) межмолекулярные, когда в ходе реакции ОВ переход электронов происходит между частицами различных веществ. Например
![]()
В данной реакции
роль окислителя в присутствии Н3О+
играют ионы
![]() а в качестве восстановителя выступают
ионы
а в качестве восстановителя выступают
ионы
![]()
б) дисмутационные (диспропорционирования), в ходе которых переход электронов происходит между частицами одного и того же вещества. В результате диспропорционирования степень окисления одной части атомов понижается за счет другой части таких же атомов, степень окисления которых становится больше.
Например:
![]()
в) внутримолекулярные, в которых переход электронов происходит между двумя атомами, входящими в состав одной и той же частицы вещества, приводящие к разложению вещества на более простые.
Например:![]()
Оценка окислительно-восстановительной способности вещества.
Для выяснения возможности протекания ОВ реакции нужно знать ОВ потенциалы вступающих в реакцию веществ.
ОВ потенциал (редокс потенциал) характеризует электрическую работу, затрачиваемую на отрыв электрона от частицы при ее переводе из восстановленной формы в окисленную.
Количественно зависимость редокс-потенциала от концентрации окисленной и восстановленной форм выражают уравнением Нернста–Петерса:
![]()
где R –газовая постоянная, равна 8,314 Дж/моль·К;
Т – абсолютная температура раствора;
n- число отдаваемых или приобретаемых электронов;
F- число Фарадея, равное 96484,56 Кл·моль (количество электричества, соответствующее переносу 1 моль электронов);
[окисл] – концентрация окисленной формы;
[восст] – концентрация восстановленной формы;
Ео - обозначает нормальный стандартный окислительно-восстановительный потенциал системы.
Самопроизвольное протекание окислительно-восстановительной реакции при стандартных условиях возможно, если Ео (окислителя) Ео (восстановителя).
При 25о формула Нернста-Петерса принимает вид
![]()
При 20о формула Нернста-Петерса принимает вид
![]()
Нормальные редокс-потенциалы некоторых редокс пар по отношению к нормальному водородному электроду даны в справочниках. По ним можно
а) сравнить величины нормальных редокс-потенциалов различных систем;
б) установить какую роль (окислителя или восстановителя) будут играть атомы, молекулы, или ионы данного вещества;
в) предсказать возможное направление ОВ реакции, состав продуктов реакции и рассчитать константу равновесия;
г) быстро и точно составить уравнение ОВ реакции.
Окислительно-восстановительные реакции в титриметрии
ОВР, основой которых является обмен электронами, протекают между двумя редокс-парами.
Условно ОВ реакции относятся к 3-му типу и в общем виде они записываются:
![]()
При рассмотрении вопроса о возможности их использования в титриметрии необходимо дать ответ на следующие вопросы:
протекают ли реакция между данным окислителем и восстановителем?
Ответ на этот вопрос дается путем сравнения табличных значений нормальных редокс-потенциалов окислителя и восстановителя;
2) имеется ли скачок на кривой титрования, т.е. Е0 0, где Е0 = Е0ок - Е0восс
Титрование по методу окисления – восстановления возможно если Е0 0,4 В.Только в этом случае обеспечивается необходимая полнота и скорость реакции.
Кроме того, о наличии скачка титрования конкретной ОВ реакции судят по значению ее константы равновесия.
![]()
С![]() уществует
связь между константой равновесия
редокс-реакции К и разностью
нормальных редокс-потенциалов Е0.
Величину К вычисляют, исходя из ЭДС
полной реакции
уществует
связь между константой равновесия
редокс-реакции К и разностью
нормальных редокс-потенциалов Е0.
Величину К вычисляют, исходя из ЭДС
полной реакции
![]()
где n-число электронов, переходящих в процессе стехиометрической реакции.
Титрантами в ОВ
титровании служат растворы окислителя
и восстановителя. Если раствор
восстановителя титруется стандартным
раствором окислителя то метод называют
«оксидиметрия», если же раствор окислителя
титруется стандартным раствором
восстановителя то метод называют
«редуктометрия» В зависимости от условий
окислитель и восстановитель могут
вступать в реакции, в которых участвует
разное количество электронов. Поэтому
часто титранты не имеют постоянного
эквивалента. Например, в кислой среде
ион MnO4¯ присоединяет
5 электронов, в щелочной - 1, в нейтральной
- 3. Поэтому в кислой среде молярная
масса эквивалента М(![]() KMnO4)
= 158,04/5 = 31,6 г/моль, в щелочной среде
М(KMnO4) = 158,04; в
нейтральной - М(
KMnO4)
= 158,04/5 = 31,6 г/моль, в щелочной среде
М(KMnO4) = 158,04; в
нейтральной - М(![]() KMnO4)
= 158,04/3 = 52,68 г/моль.
KMnO4)
= 158,04/3 = 52,68 г/моль.
Методы ОВ титрования называют по типу применяемого титранта. Наиболее широкое применение нашли следующие виды ОВ титрования: перманганатометрия – титрант KMnO4, йодометрическое - титранты растворы йода (J2) и тиосульфата натрия (Na2S2O3), броматометрическое (титрант КBrO3), бромометрическое (титрант Br2 (КBrO3 + KBr), дихроматометрическое (K2Cr2O7), церийметрическое - Се(SO4)2 и др.
Способы установления Т.Э.
Для определения точки эквивалентности при окислительно-восстановительном титровании используют:
а) безиндикаторные методы. В случае, когда раствор титруемого вещества или титранта имеют окраску, ТЭ можно определить по исчезновению или появлению этой окраски, соответственно;
б) специфические индикаторы – изменяющие цвет при появлении титранта или исчезновении определяемого вещества. Например, для системы J2/2J-, специфическим индикатором является крахмал, окрашивающий растворы, содержащие J2 в синий цвет, а для ионов Fe3+ специфическим индикатором являются ионы SCN- (ионы тиоцианата), образующийся комплекс окрашен в кроваво-краный цвет;
в) ОВ (редокс-) индикаторы – изменяющие цвет при изменении ОВ потенциала системы. Одноцветные индикаторы – дифениламин, двухцветные – ферроин.
Редокс – индикаторы существуют в двух формах – окисленной (Indок) и восстановленной (Indвосс), причем цвет одной формы отличается от другой. Переход индикатора от одной формы в другую и изменение его окраски происходит при определенном потенциале перехода, который наблюдается при равенстве концентраций окисленной и восстановленной форм индикатора и по уравнению Нернста –Петерса:
![]()
Интервал перехода редокс-индикаторов очень невелик в отличие от кислотно-основных индикаторов.
Кривые ОВ титрования
Кривые ОВ титрования ОВ изображают изменение ОВ потенциала системы по мере приливания раствора титранта.
Редуктометрия, когда раствор окислителя титруется стандартным раствором восстановителя
![]()
В редуктометрии кривые титрования рассчитывают:
1)
![]()
![]()
2)
![]()
![]()
3)
![]()
![]()

Оксидиметрия, когда раствор восстановителя титруется стандартным раствором окислителя
![]()
В оксидиметрии кривые титрования рассчитывают:
1)
![]()
2)
3)
![]()
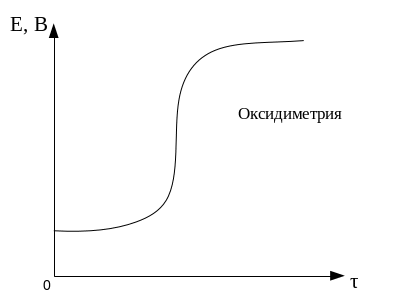
Пример. Рассчитаем кривую титрования 100 см3 раствора FeSO4 c молярной концентрацией эквивалента 0,1 моль/дм3 раствором КMnO4 такой же концентрации.
Уравнение реакции:
![]()
Константа равновесия этой реакции равна
![]()
Большое числовое
значение константы равновесия показывает,
что равновесие реакции практически
целиком сдвинуто вправо. После добавления
первых же капель титранта в растворе
образуются две ОВ пары:
![]() ,
потенциал каждой из которых можно
вычислить по уравнению Нернста:
,
потенциал каждой из которых можно
вычислить по уравнению Нернста:
![]()
![]()
В данном случае раствор восстановителя титруется раствором окислителя, т.е. титрование относится к методу оксидиметрии, расчет кривой титрования проводим по соответствующей схеме.
1) До Т.Э.
![]()





2) В Т.Э.
![]()
3) После Т.Э.
![]()




Расчетные данные для построения кривой титрования
№ п/п |
τ |
Расчетная формула |
E, В |
1 |
0,10 |
|
0,71 |
0,50 |
0,77 |
||
0,90 |
0,83 |
||
0,99 |
0,89 |
||
0,999 |
0,95 |
||
2 |
1 |
|
1,39 |
3 |
1,001 |
|
1,47 |
1,01 |
1,49 |
||
1,10 |
1,50 |
||
1,50 |
1,505 |
По данным таблицы строим кривую титрования:

Для ошибки титрования ± 0,1 % скачок титрования
∆E = Eτ=1,001 - Eτ=0,999 = 1,47 – 0,95 = 0,52.
Для ошибки титрования ± 1,0 % скачок титрования
∆E = Eτ=1,01 - Eτ=0,99 = 1,49 – 0,89 = 0,60.
В области ТЭ при переходе от раствора недотитрованного на 0,1 % к раствору перетитрованному на 0,1 % потенциал изменяется больше, чем на 0,5 В. Скачок потенциала позволяет использовать для обнаружения ТЭ непосредственно потенциометрические измерения или ОВ индикаторы, окраска которых изменяется при изменении потенциала. Кроме того в этом случае в качестве титранта используется окрашенный раство, следовательно Т.Э. можно определить по появлению слабо-розовой окраски от одной избыточной капли перманганата калия.
