
- •Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •Вариант № 4
- •5. Константа скорости омыления этилацетата едким натром при 9,4с равна 2,37 л⋅моль-1⋅мин-1, а при 14,4с равна 3,204 л⋅моль-1⋅мин-1.
- •Вариант № 6
- •Вариант № 6
- •Вариант № 7
- •4. Реакция омыления метилацетата при 298 к описывается уравнением:
- •5. Реакция первого порядка при температуре 70 0с завершается на 40% за 60 мин. При какой температуре реакция завершается на 80% за 120 мин, если энергия активации равна 60 кДж/моль?
- •9. В одной из теорий мономолекулярных реакций предложен следующий механизм активации молекул (схема Линдемана):
- •Вариант № 8
- •Вариант № 9
- •Вариант № 10
Вариант № 10
1. Сколько граммов муравьиной кислоты образуется при окислении формальдегида перекисью водорода через 1 час после начала реакции, если смешать 1л 1н раствора НСОН с 3л 2н раствора ? Константа скорости этой реакции при 60С равна 0,7544 л⋅моль-1·час-1.
2. Реакция
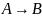 необратима и имеет минус первый порядок.
Идет ли до конца реакция? Если да, то
чему равно время окончания такой реакции?
необратима и имеет минус первый порядок.
Идет ли до конца реакция? Если да, то
чему равно время окончания такой реакции?
Ответ:
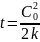
3. В газофазной реакции А + В D скорость измерялась при различных парциальных давлениях реагентов (температура 300 К). Получены следующие данные:
pA, Торр |
pB, Торр |
v, мольл-1с-1 |
4.0 9.0 13.0 |
15.0 12.0 9.0 |
2.5910-7 1.0510-6 1.6410-6 |
Определите порядки реакции по веществам А и В.
4. Кинетика реакции целого порядка описывается уравнением:
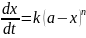
Определите порядок реакции n и константу скорости k, если известно, что скорость реакции зависит от времени следующим образом:
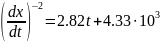
(концентрация выражена в Па, время – в секундах).
5. Разложение некоторого вещества является реакцией второго порядка с энергией активации 23,1 кДж/моль. При 300 К разложение этого вещества проходит со скоростью 95% в час. Вычислите температуру, при которой это вещество разлагается со скоростью 77,5% в мин.
6. Кинетика обратимой реакции AR B измерена при двух температурах. Получены следующие экспериментальные данные:
1) T = 20 °C
t, мин |
0 |
10 |
20 |
|
Содержание B в смеси, % |
2.0 |
21.5 |
31.0 |
39.7 |
2) T = 40 °C
t, мин |
0 |
3 |
9 |
|
Содержание B в смеси, % |
2.0 |
27.1 |
45.2 |
50.7 |
Рассчитайте:
а) энергии активации прямой и обратной реакций;
б) константы равновесия при двух температурах;
в) тепловой эффект прямой реакции.
7. Для разложения перекиси водорода,
катализируемой ионами
 ,
обнаружено, что в зависимости от
температуры порядок реакции изменяется
от 0 до 2.
,
обнаружено, что в зависимости от
температуры порядок реакции изменяется
от 0 до 2.
Исходя из механизма реакции:

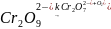
найдите кинетическое уравнение реакции и объясните изменение её порядка с температурой.
8. В системе протекают две параллельные реакции:
A + B продукты (k1), A + C продукты (k2).
Отношение k1/k2 = 7. Начальные концентрации веществ В и С одинаковы. К моменту времени t прореагировало 50% вещества В. Какая часть вещества С прореагировала к этому моменту?
9. Реакция Бутлерова RI + HI RH + I2 имеет экспериментальный второй порядок:
Для этой реакции предложен следующий механизм:
RI R + I (медл., k1),
R + HI RH + I (быстр., k2),
R + I2 RI +I (быстр., k3),
I + I + M I2 + M (быстр., k4)
(М - произвольная частица, уносящая избыток энергии, выделяющийся при рекомбинации атомов иода). Совместим ли этот механизм с экспериментальным кинетическим уравнением? Если нет, то какое дополнительное приближение необходимо сделать для того, чтобы данная теоретическая схема соответствовала опытным данным? Выразите экспериментальную константу скорости и энергию активации через соответствующие величины для отдельных стадий.
10. Каталитическое окисление CO на однородной поверхности Pd протекает следующим образом:
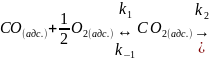
Равновесие на поверхности устанавливается
быстро. Вторая стадия – медленная.
Используя уравнение Ленгмюра для
многокомпонентной адсорбции, выведите
формулу для зависимости скорости реакции
образования газообразного
 от парциальных давлений всех участников
реакции.
от парциальных давлений всех участников
реакции.
