
- •Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •Вариант № 4
- •5. Константа скорости омыления этилацетата едким натром при 9,4с равна 2,37 л⋅моль-1⋅мин-1, а при 14,4с равна 3,204 л⋅моль-1⋅мин-1.
- •Вариант № 6
- •Вариант № 6
- •Вариант № 7
- •4. Реакция омыления метилацетата при 298 к описывается уравнением:
- •5. Реакция первого порядка при температуре 70 0с завершается на 40% за 60 мин. При какой температуре реакция завершается на 80% за 120 мин, если энергия активации равна 60 кДж/моль?
- •9. В одной из теорий мономолекулярных реакций предложен следующий механизм активации молекул (схема Линдемана):
- •Вариант № 8
- •Вариант № 9
- •Вариант № 10
Вариант № 8
1. Сколько времени потребуется, чтобы 0,05 н – раствор омылился на 25% при помощи 0,10 н – раствора NaOH, если константа скорости этой реакции равна 3,19 (л⋅моль-1·мин-1).
Во сколько раз на это потребуется больше времени, если исходные вещества будут разбавлены вдвое?
2. Установлено, что реакция 2-го порядка (один реагент) завершается на 75% за 92 мин при исходной концентрации реагента 0,24 М. Какое время потребуется, чтобы при тех же условиях концентрация реагента достигла 0,16 М?
3. Раствор
 в
в
 разлагается при 40С,
выделяя кислород со следующей скоростью:
разлагается при 40С,
выделяя кислород со следующей скоростью:
Время, мин |
20 |
40 |
60 |
80 |
100 |
|
|
11.4 |
19.9 |
23.9 |
27.2 |
29.5 |
34.75 |
Определить порядок реакции и константу скорости.
4. Пользуясь зависимостью между временем полураспада и начальным давлением, определите порядок реакции конверсии пара-водорода в орто-водород при температуре 923 К.
P0, мм.рт.ст. |
50 |
100 |
200 |
400 |
|
648 |
450 |
318 |
222 |
5. Для реакции
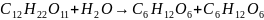
константа скорости при температуре 298.2 К равна 0.765 л⋅моль–1⋅мин–1, а при температуре 328.2 К – 35.5 л⋅моль–1⋅мин–1. Найдите энергию активации этой реакции и константу скорости при температуре 313.2 К.
6. В реакции
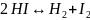
известны константы скорости прямой и обратной реакций: при температуре 500 °С k2 = 23.3, k–2 = 1.05⋅103, а при температуре 700 °С k2 = 9.05⋅103, k–2 = 2.08⋅105 (все константы выражены в см3⋅моль–1⋅с–1).
1. Рассчитайте энергии активации и предэкспоненциальные множители прямой и обратной реакций.
2. Рассчитайте константы равновесия при двух указанных температурах.
3. Определите ∆H и ∆S прямой реакции в предположении ∆Cp = 0.
4. В реакционный сосуд ввели иодоводород при температуре 500 °С. Какая часть иодоводорода разложится?
7. Цис-транс-изомеризация стильбена (1,2-дифенилэтилена) – обратимая реакция первого порядка. Рассчитайте константы скорости прямой и обратной реакций, используя следующие экспериментальные данные:
t, с |
0 |
1830 |
3816 |
7260 |
12006 |
|
Доля цис-изомера, % |
100 |
88.1 |
79.3 |
70.0 |
48.5 |
17.0 |
8. Реакция разложения вещества А может протекать параллельно по трем направлениям:
Концентрации продуктов в смеси через 10 мин после начала реакции были равны: [B] = 1.6 моль⋅л–1, [C] = 3.6 моль⋅л–1, [D] = 7.8 моль⋅л–1.
Определите константы скорости k1 – k3, если период полураспада вещества А равен 8 мин.
9. Конденсация ацетона (CH3)2CO в водном растворе катализируется основаниями, которые обратимо реагируют с ним с образованием карбанаиона C3H5O–. Карбанион реагирует с молекулой ацетона и дает продукт реакции. Упрощённый механизм выглядит так:
AH + B A– + BH+ (k1),
A– + BH+ AH + B (k2),
A– + AH продукт (k3).
Используя метод стационарных концентраций, найдите концентрацию карбаниона и выведите уравнение для скорости образования продукта.
10. Рассмотрите механизм ферментативного катализа с двумя промежуточными комплексами:

Используя метод квазистационарных концентраций и уравнение материального баланса, покажите, что скорость реакции описывается уравнением типа Михаэлиса–Ментен:
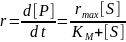
Найдите выражения для эффективной максимальной скорости и эффективной константы Михаэлиса через константы скорости отдельных стадий.

 ,
см3
,
см3