
- •Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •Вариант № 4
- •5. Константа скорости омыления этилацетата едким натром при 9,4с равна 2,37 л⋅моль-1⋅мин-1, а при 14,4с равна 3,204 л⋅моль-1⋅мин-1.
- •Вариант № 6
- •Вариант № 6
- •Вариант № 7
- •4. Реакция омыления метилацетата при 298 к описывается уравнением:
- •5. Реакция первого порядка при температуре 70 0с завершается на 40% за 60 мин. При какой температуре реакция завершается на 80% за 120 мин, если энергия активации равна 60 кДж/моль?
- •9. В одной из теорий мономолекулярных реакций предложен следующий механизм активации молекул (схема Линдемана):
- •Вариант № 8
- •Вариант № 9
- •Вариант № 10
Вариант № 7
1. 0,01 н раствор
 омыляется 0,002 н раствором NaOH в течение
23 минут на10 %. Через сколько минут он
будет омылен до такой же степени 0,005 н
раствором щелочи? Считается, что
диссоциация NaOH в таких разбавленных
растворах будет полной(αкаж. = 1).
омыляется 0,002 н раствором NaOH в течение
23 минут на10 %. Через сколько минут он
будет омылен до такой же степени 0,005 н
раствором щелочи? Считается, что
диссоциация NaOH в таких разбавленных
растворах будет полной(αкаж. = 1).
2. В реакции 2-го порядка А+ВD начальные концентрации веществ А и В равны, соответственно, 2,0 моль/л и 3,0 моль/л. Скорость реакции равна 1,210-3 моль/(лс) при [А]= 1,5 моль/л. Рассчитайте константу скорости и скорость реакции при [В]=1,5 моль/л.
3. В реакцию введены эквивалентные
количества фенилпропионата натрия и
йода:
 .
.
Определить порядок реакции, если в двух
опытах на титрование 25 см3 пробы
пошло следующее количество раствора
гипосульфита натрия (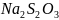 ).
).
Номер опыта |
Первый опыт |
Второй опыт |
|||
Время, час |
0 |
29 |
0 |
34,5 |
|
Объём , см3 |
24,96 |
8,32 |
21,00 |
7,00 |
|
4. Реакция омыления метилацетата при 298 к описывается уравнением:
CH3COOCH3 + NaOH = CH3COONa + CH3OH.
Для этой реакции получены следующие кинетические данные:
Время, мин |
3 |
5 |
7 |
10 |
15 |
25 |
СNaOH, ммоль/л |
7,40 |
6,34 |
5,50 |
4,64 |
3,63 |
2,54 |
Исходные концентрации щелочи и эфира одинаковы и равны 0,01 моль/л. Определите порядок реакции и константу скорости.
5. Реакция первого порядка при температуре 70 0с завершается на 40% за 60 мин. При какой температуре реакция завершается на 80% за 120 мин, если энергия активации равна 60 кДж/моль?
6. Окисление оксида азота (II) кислородом воздуха – реакция третьего порядка. В таблице приведена экспериментальная зависимость константы скорости этой реакции от температуры.
T, C |
80 |
143 |
228 |
300 |
413 |
564 |
|
41.8 |
20.2 |
10.1 |
7.1 |
4.0 |
2.8 |
Рассчитайте энергию активации и предэкспоненциальный множитель для этой реакции.
7. Для обратимой реакции первого порядка Кравн=8, а k1=0,4 с-1. Вычислите время, при котором концентрации веществ А и В станут равными, если начальная концентрация вещества В равна 0.
8. Дана кинетическая схема:
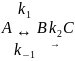
Составьте и решите систему кинетических уравнений для этой схемы ([A]0=a, [B]0=[C]0=0). Когда достигается максимум концентрации промежуточного вещества В?
9. В одной из теорий мономолекулярных реакций предложен следующий механизм активации молекул (схема Линдемана):
активация: A + A A* + A (k1),
дезактивация: A + A* A + A (k–1),
распад: A* продукты (k2).
Используя метод квазистационарных концентраций, выведите уравнение для скорости мономолекулярной реакции и определите порядок реакции при больших и малых концентрациях [A].
10. Рассчитайте концентрацию неконкурентного ингибитора I (KI = 2.9⋅10–4 моль⋅л–1), необходимую для 90%-ного подавления ферментативной реакции.

 ,
см6∙моль-2∙с-1
,
см6∙моль-2∙с-1