
- •Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •Вариант № 4
- •5. Константа скорости омыления этилацетата едким натром при 9,4с равна 2,37 л⋅моль-1⋅мин-1, а при 14,4с равна 3,204 л⋅моль-1⋅мин-1.
- •Вариант № 6
- •Вариант № 6
- •Вариант № 7
- •4. Реакция омыления метилацетата при 298 к описывается уравнением:
- •5. Реакция первого порядка при температуре 70 0с завершается на 40% за 60 мин. При какой температуре реакция завершается на 80% за 120 мин, если энергия активации равна 60 кДж/моль?
- •9. В одной из теорий мономолекулярных реакций предложен следующий механизм активации молекул (схема Линдемана):
- •Вариант № 8
- •Вариант № 9
- •Вариант № 10
Вариант № 6
1. Начальный угол вращения плоскости поляризации 20%-го раствора тростникового сахара при 25C равен +24,09, конечное вращение равно –10,74. Средняя константа скорости инверсии равна 1,116∙10-2 мин-1. Найти процент проинвертированного сахара и угол вращения спустя 100 минут после начала реакции.
2. Скорость окисления бутанола-1 хлорноватистой кислотой не зависит от концентрации спирта и пропорциональна [НС1О]2. За какое время реакция окисления при 298 К пройдет на 90%, если исходный раствор содержал 0.1 мольл-1 НС1О и 1 мольл-1 спирта? Константа скорости реакции равна k = 24 лмоль–1мин–1.
3. Определите порядок реакции конверсии
пара
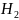 в орто
при 923 К, пользуясь зависимость между
временем полупревращения и начальным
давлением пара-водорода.
в орто
при 923 К, пользуясь зависимость между
временем полупревращения и начальным
давлением пара-водорода.
P∙10-5, Па |
0.067 |
0.133 |
0.267 |
0.533 |
, с |
648 |
450 |
318 |
222 |
4. Фенилдиазохлорид разлагается по уравнению:
C6H5N2Cl C6H5Cl + N2.
При температуре 323 К и начальной концентрации 10 гл-1 были получены следующие результаты:
t, мин |
6 |
9 |
12 |
14 |
18 |
22 |
24 |
26 |
30 |
|
|
19.3 |
26.0 |
32.6 |
36.0 |
41.3 |
45.0 |
46.5 |
48.3 |
50.4 |
58.3 |
Определите порядок реакции и константу скорости.
5. Константы
скорости реакции:
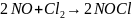 равны,
соответственно,
5,5 л2⋅моль-2⋅с-1
при
0С
и 19,4 л2⋅моль-2⋅с-1
при
60,2С.
Вычислите,
при какой температуре константа скорости
будет равна
1,0⋅107
см6⋅моль-2⋅с-1?
равны,
соответственно,
5,5 л2⋅моль-2⋅с-1
при
0С
и 19,4 л2⋅моль-2⋅с-1
при
60,2С.
Вычислите,
при какой температуре константа скорости
будет равна
1,0⋅107
см6⋅моль-2⋅с-1?
6. Реакция термического разложения этана является реакцией первого порядка. При 550°С константа скорости этой реакции равна 2,5105 сек-1, а при 630°С – 141,5105сек-1. Рассчитайте период полупревращения для этой реакции при 600°С.
7. Найдите зависимость концентрации вещества B от времени в системе ([A]0 = a):
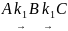
(константы скорости обеих стадий одинаковы).
8. Покажите, что при двух параллельных реакциях
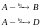
энергия активации суммарной реакции разложения A связана с энергиями активации отдельных стадий следующим образом:

9. При низких температурах скорость реакции СО(г) + NO2(г) СО2(г) + NO(г) описывается кинетическим уравнением: v = k [NO2]2. Предложите возможный механизм для этой реакции.
10. Найдите константу Михаэлиса и максимальную скорость гидролиза карбобензилоксиглицилфенилаланина под действием карбоксипептидазы по следующим кинетическим данным:

Вариант № 6
1. Разложение диметилового эфира:
 вполне удовлетворительно следует
уравнению реакции 1-го порядка.
вполне удовлетворительно следует
уравнению реакции 1-го порядка.
Используя приведенные ниже данные, вычислите константу скорости этой реакции и определите, через сколько минут начальное давление в системе увеличится вдвое.
Время (сек) |
0 |
219 |
299 |
564 |
|
Р, мм рт.ст. |
420 |
954 |
1054 |
1198 |
1258 |
2. Хлорид натрия-24 используют для изучения натриевого баланса живых организмов. Образец содержит 0.050 мг натрия-24. Через 24.9 ч содержание натрия-24 уменьшилось до 0.016 мг. Рассчитайте период полураспада натрия-24.
3. Реакция:
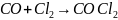 идет в присутствии катализатора. Так,
при 27С получены
следующие значения:
идет в присутствии катализатора. Так,
при 27С получены
следующие значения:
Время, мин |
0 |
18 |
30 |
42 |
|
0,01873 |
0,01764 |
0,01704 |
0,01644 |
Определите порядок реакции.
4. Кинетику кислотного гидролиза симм-ди(2-карбо-ксифенокси)-диметилового эфира изучали спектрофотометрически по выделению метилсалицилата и получили следующие данные:
Время, сут |
0 |
0.8 |
2.9 |
4.6 |
6.7 |
8.6 |
11.7 |
Опт. плотность |
0.129 |
0.141 |
0.162 |
0.181 |
0.200 |
0.213 |
0.229 |
Определите константу скорости 1 -го порядка реакции гидролиза.
5. В растворе содержатся 0,1 моля этилацетата и 0,1 моля едкого натра. При 10С в течение 15 минут реагирует 10% эфира, а при 25С за тот же промежуток времени 20%.
Вычислить, сколько эфира омылится при 55С в течение 5 минут.
6. В двух реакциях одинакового порядка разница энергий активации составляет Е2 – Е1 = 40 кДжмоль-1. При температуре 293 К отношение констант скорости равно k1/k2 = 2. При какой температуре константы скорости сравняются?
7. Реакция изотопного обмена протекает по механизму:

с начальными концентрациями [A]0 = a, [B]0 = b, [C]0 = [D]0 = 0. Найдите зависимость концентраций веществ A и B от времени и периоды полураспада этих веществ.
8. Дана кинетическая схема:

Составьте и решите систему кинетических уравнений для этой схемы ([A]0 = a, [B]0 = [C]0 = 0). При каких значениях констант скорости k1 – k3 концентрация промежуточного вещества В будет проходить через максимум?
9. Реакция разложения бромметана 2СН3Вг С2Н6 + Br2 может протекать по следующему механизму:
СН3Вr СН3 + Br (k1), СН3 + СН3Вr С2Н6 + Br (k2),
Вr + СН3Вг СН3 + Br2 (k3), 2CH3 -> С2Н6 (k4).
Используя метод стационарных концентраций, найдите выражение для скорости образования этана.
10. Определите значения константы Михаэлиса и максимальной скорости для гидролиза метилового эфира N-ацетил-L-валина, катализируемого α-химотрипсином. Экспериментальные данные о зависимости начальной скорости от концентрации субстрата:
[S]0, M |
r0∙106, М∙с-1 |
0.200 |
4.57 |
0.124 |
3.83 |
0.124 |
3.84 |
0.091 |
3.33 |
0.091 |
3.31 |
0.071 |
2.97 |
0.071 |
2.93 |
0.060 |
2.67 |
0.060 |
2.74 |

 ,
см3
,
см3 ,
моль∙л-1
,
моль∙л-1