
- •Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •Вариант № 4
- •5. Константа скорости омыления этилацетата едким натром при 9,4с равна 2,37 л⋅моль-1⋅мин-1, а при 14,4с равна 3,204 л⋅моль-1⋅мин-1.
- •Вариант № 6
- •Вариант № 6
- •Вариант № 7
- •4. Реакция омыления метилацетата при 298 к описывается уравнением:
- •5. Реакция первого порядка при температуре 70 0с завершается на 40% за 60 мин. При какой температуре реакция завершается на 80% за 120 мин, если энергия активации равна 60 кДж/моль?
- •9. В одной из теорий мономолекулярных реакций предложен следующий механизм активации молекул (схема Линдемана):
- •Вариант № 8
- •Вариант № 9
- •Вариант № 10
Вариант № 4
1. Монохлоруксусная кислота при действии воды переходит в гликолевую. Реакция протекает по уравнению:
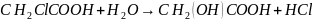 .
.
При большом избытке воды реакция является псевдомономолекулярной.
На основании приведенных данных вычислить константу скорости реакции и определить, через какое время количество всех трёх кислот будет одинаково.
Время (мин.) для отбора пробы |
0 |
600 |
780 |
2070 |
Объём, см3, израсходованных на титрование |
12.9 |
15.8 |
16.4 |
20.5 |
2. Гидролиз некоторого гормона – реакция 1-го порядка с константой скорости 0.125 лет–1. Чему станет равна концентрация 0,0100 М раствора гормона через 1 месяц? Рассчитайте период полураспада гормона.
3. Пользуясь дифференциальным методом Вант-Гоффа, определите порядок реакции полимеризации циановой кислоты в циануровую:
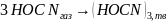 .
.
В одном опыте давление
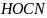 снизилось за 23 часа с 188,84 до 153,46 мм. рт.
ст., в то время как в другом опыте при
той же температуре – за 20 часов с 79,07 до
76,81 мм. рт. ст.
снизилось за 23 часа с 188,84 до 153,46 мм. рт.
ст., в то время как в другом опыте при
той же температуре – за 20 часов с 79,07 до
76,81 мм. рт. ст.
4. Разложение некоторого вещества является реакцией второго порядка с энергией активации 23,1 кДж/моль. При 300 К разложение этого вещества проходит со скоростью 95% в час. Вычислите температуру, при которой это вещество разлагается со скоростью 77,5% в мин.
5. Константа скорости омыления этилацетата едким натром при 9,4с равна 2,37 л⋅моль-1⋅мин-1, а при 14,4с равна 3,204 л⋅моль-1⋅мин-1.
Определите энергию активации этой реакции и найдите значение константы скорости при 45С.
6. В газовой фазе при 60 °С протекает реакция по следующему механизму:
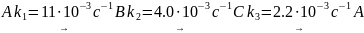
Начальные давления веществ A, B и C равны 4.00⋅104 Па, 1.33⋅104 Па и 0.64⋅104 Па соответственно. Во сколько раз уменьшится давление вещества A после окончания реакций? Во сколько раз в конечной смеси вещества C будет больше, чем вещества B, если исходную смесь нагреть до 100 С (известно, что энергия активации второй реакции на 20 кДж⋅моль–1 больше, чем энергия активации третьей реакции)?
7. Реакция разложения вещества А может протекать параллельно по трем направлениям:
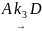
Концентрации продуктов в смеси через 5 мин после начала реакции были равны: [B] = 3.2 моль⋅л–1, [C] = 1.8 моль⋅л–1, [D] = 4.0 моль⋅л–1.
Определите константы скорости k1 – k3, если период полураспада вещества А равен 10 мин.
8. В системе протекают две параллельные реакции:
A + B продукты (k1), A + C продукты (k2).
Отношение k1/k2 = 7. Начальные концентрации веществ В и С одинаковы. К моменту времени t прореагировало 50% вещества В. Какая часть вещества С прореагировала к этому моменту?
9. Реакция Бутлерова RI + HI RH + I2 имеет экспериментальный второй порядок:

Для этой реакции предложен следующий механизм:
RI R + I (медл., k1),
R + HI RH + I (быстр., k2),
R + I2 RI +I (быстр., k3),
I + I + M I2 + M (быстр., k4)
(М - произвольная частица, уносящая избыток энергии, выделяющийся при рекомбинации атомов иода). Совместим ли этот механизм с экспериментальным кинетическим уравнением? Если нет, то какое дополнительное приближение необходимо сделать для того, чтобы данная теоретическая схема соответствовала опытным данным? Выразите экспериментальную константу скорости и энергию активации через соответствующие величины для отдельных стадий.
10. Начальная скорость окисления сукцината натрия в фумарат натрия под действием фермента сукциноксидазы была измерена для ряда концентраций субстрата:
[S], моль/л |
0,01 |
0,002 |
0,001 |
0,0005 |
0,00033 |
r, мм3∙мин-1 |
1,17 |
0.99 |
0.79 |
0.62 |
0.50 |
Определите константу Михаэлиса данной реакции.
