
- •Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •Вариант № 4
- •5. Константа скорости омыления этилацетата едким натром при 9,4с равна 2,37 л⋅моль-1⋅мин-1, а при 14,4с равна 3,204 л⋅моль-1⋅мин-1.
- •Вариант № 6
- •Вариант № 6
- •Вариант № 7
- •4. Реакция омыления метилацетата при 298 к описывается уравнением:
- •5. Реакция первого порядка при температуре 70 0с завершается на 40% за 60 мин. При какой температуре реакция завершается на 80% за 120 мин, если энергия активации равна 60 кДж/моль?
- •9. В одной из теорий мономолекулярных реакций предложен следующий механизм активации молекул (схема Линдемана):
- •Вариант № 8
- •Вариант № 9
- •Вариант № 10
Вариант № 1
1. Активность изотопа Po уменьшается за 14 дней на 6,85 %. Определите константу скорости распада, период полураспада и время, в течение которого распадется 90 % исходного количества изотопа.
2. В реакции 2-го порядка А+ВD начальные концентрации веществ А и В равны, соответственно, 2,0 моль/л и 3,0 моль/л. Скорость реакции равна 1,210-3 моль/(лс) при [А]= 1,5 моль/л. Рассчитайте константу скорости и скорость реакции при [В]=1,5 моль/л.
3. Восстановление оксида азота (II) протекает по уравнению:
 .
.
Определите порядок этой реакции, пользуясь зависимостью между временем расхода половины исходного вещества и начальной концентрацией, на основании следующих опытных данных.
Рнач, мм. рт. ст. |
340.5 |
288 |
|
102 |
140 |
4. Реакция омыления метилацетата при 298 К описывается уравнением:
CH3COOCH3 + NaOH = CH3COONa + CH3OH.
Для этой реакции получены следующие кинетические данные:
Время, мин |
3 |
5 |
7 |
10 |
15 |
25 |
СNaOH, ммоль/л |
7,40 |
6,34 |
5,50 |
4,64 |
3,63 |
2,54 |
Исходные концентрации щелочи и эфира одинаковы и равны 0,01 моль/л. Определите порядок реакции и константу скорости.
5. Реакция первого порядка при температуре 70 0С завершается на 40% за 60 мин. При какой температуре реакция завершается на 80% за 120 мин, если энергия активации равна 60 кДж/моль?
6. Константа скорости омыления этилацетата едким натром при 9,4С равна 2,37 л⋅моль-1⋅мин-1, а при 14,4С равна 3,204 л⋅моль-1⋅мин-1.
Определите энергию активации этой реакции и найдите значение константы скорости при 45С.
7. Для обратимой реакции первого порядка Кравн=8, а k1=0,4 с-1. Вычислите время, при котором концентрации веществ А и В станут равными, если начальная концентрация вещества В равна 0.
8. Один из методов оценки возраста
биологических объектов основан на
измерении содержания в них оптических
изомеров аминокислот. В живых организмах
отношение концентраций D- и L-изомеров
постоянно:
 .
В мертвых организмах происходит
рацемизация:
.
В мертвых организмах происходит
рацемизация:
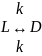
Чему равен возраст биологического
объекта, в котором
 ?
Решите задачу в общем виде и для образца,
содержащего аспарагиновую кислоту (k =
1.48⋅10-5 лет-1,
a = 0.07, b = 0.27).
?
Решите задачу в общем виде и для образца,
содержащего аспарагиновую кислоту (k =
1.48⋅10-5 лет-1,
a = 0.07, b = 0.27).
9. В одной из теорий мономолекулярных реакций предложен следующий механизм активации молекул (схема Линдемана):
активация: A + A A* + A (k1),
дезактивация: A + A* A + A (k–1),
распад: A* продукты (k2).
Используя метод квазистационарных концентраций, выведите уравненние для скорости мономолекулярной реакции и определите порядок реакции при больших и малых концентрациях [A].
10. Представьте соотношение
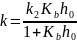 между k и
между k и
 в линейной форме, позволяющей определить
параметры
в линейной форме, позволяющей определить
параметры
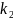 и
и
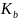 с помощью линейной регрессии.
с помощью линейной регрессии.
Вариант № 2
1. Превращение перекиси бензоила в диэтиловый эфир (реакция 1-го порядка) при 333 К прошло за 10 минут на 75,2%. Вычислите константу скорости этой реакции и определите время полупревращения.
2. Установлено, что реакция 2-го порядка (один реагент) завершается на 75% за 92 мин при исходной концентрации реагента 0,24 М. Какое время потребуется, чтобы при тех же условиях концентрация реагента достигла 0,16 М?
3. Найти порядок реакции:
 при 310С, если в одном
случае давление за 30 минут уменьшилось
с 786,8 до 693 мм. рт. ст., а в другом случае
за тот же промежуток времени с 535,3 до
468,1 мм. рт. ст.
при 310С, если в одном
случае давление за 30 минут уменьшилось
с 786,8 до 693 мм. рт. ст., а в другом случае
за тот же промежуток времени с 535,3 до
468,1 мм. рт. ст.
4. Пользуясь зависимостью между временем полураспада и начальным давлением, определите порядок реакции конверсии пара-водорода в орто-водород при температуре 923 К.
P0, мм.рт.ст |
50 |
100 |
200 |
400 |
|
648 |
450 |
318 |
222 |
5. Константа скорости реакции третьего
порядка, протекающей по уравнению:
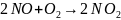 при 0С равна 3,63·10-3,
а при 86С равна1,12·10-3
л2⋅моль-2⋅мин-1.
при 0С равна 3,63·10-3,
а при 86С равна1,12·10-3
л2⋅моль-2⋅мин-1.
Вычислите энергию активации этой реакции и константу скорости при 50С.
6. Для реакции разложения йодистого водорода:

при двух разных температурах получены следующие значения констант скорости реакции (см3⋅моль-1⋅с-1):
|
|
|
666.8 |
0.259 |
15.59 |
698.6 |
1.242 |
67.00 |
Найти значения энергий активации прямой и обратной реакций и константу равновесия реакции при 533 К.
7. Константа скорости прямой реакции цис-транс-изомеризации бутена-2 при 417 С равна 8.52⋅10-7 с–1. Константа равновесия при этой температуре равна 1.14. В начальный момент времени присутствует только цис-изомер. Определите время, за которое прореагирует 30% бутена-2.
8. Покажите, что при двух параллельных реакциях
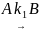

энергия активации суммарной реакции разложения A связана с энергиями активации отдельных стадий следующим образом:
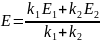
9. Конденсация ацетона (CH3)2CO в водном растворе катализируется основаниями, которые обратимо реагируют с ним с образованием карбанаиона C3H5O–. Карбанион реагирует с молекулой ацетона и дает продукт реакции. Упрощённый механизм выглядит так:
AH + B A– + BH+ (k1),
A– + BH+ AH + B (k2),
A– + AH продукт (k3).
Используя метод стационарных концентраций, найдите концентрацию карбаниона и выведите уравнение для скорости образования продукта.
10. Опишите кинетику реакции специфического основного катализа в квазиравновесном приближении. Выразите скорость образования продукта через:
а) текущую,
б) исходную концентрацию субстрата.
Как зависит эффективная константа скорости от pH? Коэффициенты активности и активность воды примите равными единице.


 ,
K
,
K
