
- •Магсумов тимур ильнурович
- •Зависимости термодинамических функций сольватации неполярных соединений от состава водно-органических смесей
- •Содержание
- •Введение
- •1. Литературный обзор
- •1.1. Термодинамические функции растворения и сольватации
- •1.1.1. Энергия Гиббса растворения и сольватации
- •1.1.2. Энтальпия растворения и сольватации
- •1.2. Соотношения между энергией Гиббса и энтальпией сольватации. Сольвофобные эффекты
- •1.3. Литературные данные по энергиям Гиббса растворения/сольватации в водно-органических смесях
- •1.4. Литературные данные по энтальпиям растворения в водно-органических смесях
- •1.5. Методы расчета термодинамических функций растворения в смешанных растворителях
- •1.5.1. Методы расчета термодинамических функций сольватации в водно-органических смесях
- •1.5.2. Расчет термодинамических функций сольватации методами компьютерного моделирования
- •Постановка задачи
- •2. Экспериментальная часть
- •2.1 Реактивы
- •2.2. Измерение коэффициентов активности при предельном разбавлении
- •2.3. Измерение энтальпий растворения
- •3. Результаты и обсуждение
- •3.2. Сольватация бензола в водно-органических смесях
- •3.3. Молекулярно-динамическое моделирование сольватации в водно-органических смесях
- •Основные результаты и выводы
- •Список использованной литературы
1.5. Методы расчета термодинамических функций растворения в смешанных растворителях
Теоретическое предсказание энергий растворения в водно-органических смесях – сложная задача. Существующие модели сольватации, в том числе эмпирические, предназначаются в первую очередь для описания свойств растворов в индивидуальных растворителях, при этом даже для растворов в чистой воде часто требуется использование специальных наборов параметров или уравнений. Для успешного расчета термодинамических функций сольватации в водно-органических смесях обязательно учитывать локальный состав растворителя вокруг растворенной молекулы (предпочтительную сольватацию). Такие универсальные методы, как МД- и МК-моделирование, требуют дополнительной оптимизации параметров взаимодействий для удовлетворительного воспроизведения экспериментальных физических свойств водно-органических смесей.
Поэтому ни один из предсказательных методов нельзя рассматривать как источник данных о сольватационных свойствах водно-органических смесей. Тем не менее, они полезны для проверки различных гипотез о молекулярном механизме сольватации и структуре окружения растворенной молекулы на основе экспериментальных данных. Ниже мы кратко рассмотрим некоторые из них.
1.5.1. Методы расчета термодинамических функций сольватации в водно-органических смесях
Существует множество уравнений и моделей для расчета энергии Гиббса растворения/сольватации в различных растворителях. Среди них теория регулярных растворов Гильдебранда [58], уравнение NTRL [59], модель UNIQUAC [60], групповые модели UNIFAC [61] и ASOG [62], корреляционные уравнения Абрахама [63]. Однако попытки применения большинства из них как к воде, так и к водно-органическим средам приводит к большим отклонениям от экспериментальных результатов.
Большее развитие получили чисто эмпирические методы оценки растворимости в водно-органических смесях на основе данных о растворимости в чистых компонентах смеси. Это связано с задачей определения растворимости лекарственных соединений в большом числе смесей различного состава, что делает прямые экспериментальные измерения трудоемкими и дорогостоящими.
Рассмотрим два таких метода:
Метод Ялковского [64]. Расчет растворимости в смешанном растворителе проводится, исходя из данных по растворимости в растворителях 1 и 2 (X1 и X2, соответственно) и состава растворителя (f1 и f2)
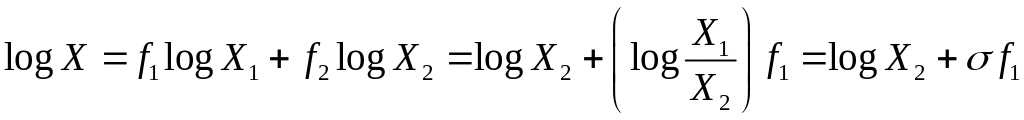 .
(22)
.
(22)
В работе [65] была показана линейная зависимость между σ и коэффициентом распределения октанол-вода (logKow). σ выражается уравнением
![]() ,
(23)
,
(23)
где M и N константы сорастворителя и не зависят от природы растворенного вещества. Метод в среднем дает погрешность, бо́льшую точности экспериментального определения растворимости (около 10%) и допустимых ошибок в фармацевтике (примерно 30%), однако является очень простым и требует минимального числа исходных данных.
Расширенная модель растворимости Гильдебранда. Мартинс и сотр. [66] модифицировали модель регулярных растворов, добавив в нее эмпирический параметр взаимодействия растворенное вещество-растворитель (WW). Это позволило расширить область применения модели. Выражение для растворимости выглядит следующим образом:
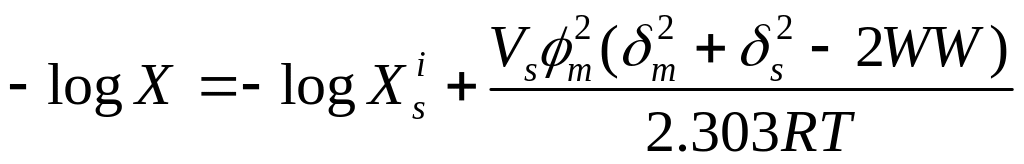 ,
(24)
,
(24)
где
![]() – идеальная растворимость вещества
(растворимость в идеальном растворе,
когда только кристалличность вещества
ограничивает растворимость),
– идеальная растворимость вещества
(растворимость в идеальном растворе,
когда только кристалличность вещества
ограничивает растворимость),
![]() –
мольный объем вещества,
–
мольный объем вещества,
![]() – объемная доля растворителя (принимается
равной единице из-за малых количеств
растворенного вещества). WW
рассчитывается разложением степенного
ряда WW = ∑ Aiδm, где δm
= f1δ1 +
f2δ2 (22), δ1
и δ2 – параметры Гильдебранда
чистых растворителей. Метод требует
знания большого количества экспериментальных
данных: энтальпии и энтропии испарения,
плотности, идеальной растворимости, а
также оценки δS.
Все это, а также зависимость δS
от полярности растворителя затрудняет
использование данного метода.
– объемная доля растворителя (принимается
равной единице из-за малых количеств
растворенного вещества). WW
рассчитывается разложением степенного
ряда WW = ∑ Aiδm, где δm
= f1δ1 +
f2δ2 (22), δ1
и δ2 – параметры Гильдебранда
чистых растворителей. Метод требует
знания большого количества экспериментальных
данных: энтальпии и энтропии испарения,
плотности, идеальной растворимости, а
также оценки δS.
Все это, а также зависимость δS
от полярности растворителя затрудняет
использование данного метода.
Для энтальпий сольватации инертных
газов и углеводородов в неводных бинарных
растворителях Батовым была показана
[44] связь с плотностью энергии когезии
растворителя. Избыточная энтальпия
растворения
![]() по отношению к аддитивной по составу
величине выражается уравнением:
по отношению к аддитивной по составу
величине выражается уравнением:
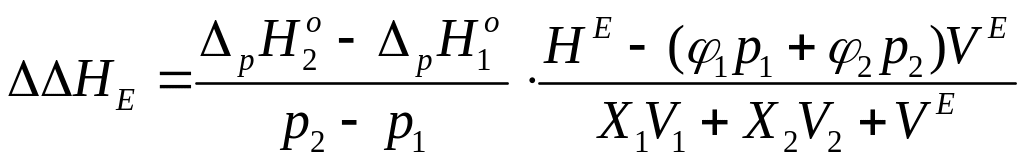 ,
(25)
,
(25)
где
![]() и
и
![]() – стандартная энтальпия растворения
вещества в растворителе 2 и 1,
– стандартная энтальпия растворения
вещества в растворителе 2 и 1,
![]() – избыточный объем смеси,
– избыточный объем смеси,
![]() ,
,
![]() – мольные доли компонентов смеси, p2,
p1 – плотности
энергии когезии растворителя 2 и 1
соответственно, φ2, φ1
– объемные доли компонентов смеси, HE
– избыточная энтальпия. Плотность
энергии когезии выражается через
энтальпию испарения растворителя:
– мольные доли компонентов смеси, p2,
p1 – плотности
энергии когезии растворителя 2 и 1
соответственно, φ2, φ1
– объемные доли компонентов смеси, HE
– избыточная энтальпия. Плотность
энергии когезии выражается через
энтальпию испарения растворителя:
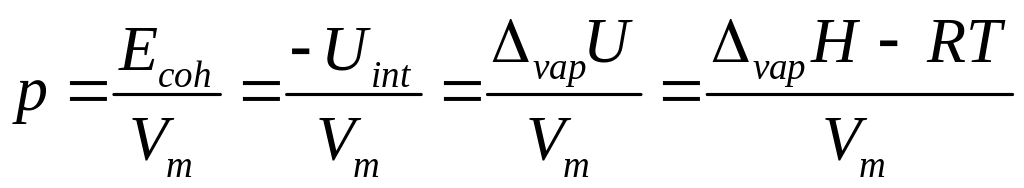 .
(26)
.
(26)
Для водно-органических смесей данное уравнение неприменимо. При этом, в частности, сольватация ксенона в смесях воды со спиртами хорошо описывается квадратным уравнениями вида
сНо = a0 + a1 р + a2 р2, (27)
сНо = b0 + b1 р + b2 р2 - 13.0 Х1, (28)
где p – плотность энергии когезии растворителя, X1 – мольная доля воды, а ai и bi – подгоночные коэффициенты. Для аргона энтальпия сольватации хорошо описывается только кубическим уравнением.
Для алканов в смесях воды с апротонными растворителями отклонение энтальпии растворения от аддитивного по составу растворителя значения с хорошей точностью (R2=0.9896) описывается сложной зависимостью от мольного объема углеводорода и избыточной плотности энергии когезии. Для описания теплового эффекта растворения бензола в смесях воды с апротонными растворителями использовались [41] сразу два уравнения: до максимума энтальпия хорошо описывается линейной зависимостью от избыточной плотности энергии когезии (рЕат), а от максимума и до чистой воды ∆∆НЕ пропорциональна (ратE)2.
Эти эмпирические и корреляционные уравнения, однако, не позволяют прояснить физическую природу максимума энтальпии сольватации при определенном содержании воды в смеси, или же получить какую-либо информацию о предпочтительной сольватации.
