
- •Магсумов тимур ильнурович
- •Зависимости термодинамических функций сольватации неполярных соединений от состава водно-органических смесей
- •Содержание
- •Введение
- •1. Литературный обзор
- •1.1. Термодинамические функции растворения и сольватации
- •1.1.1. Энергия Гиббса растворения и сольватации
- •1.1.2. Энтальпия растворения и сольватации
- •1.2. Соотношения между энергией Гиббса и энтальпией сольватации. Сольвофобные эффекты
- •1.3. Литературные данные по энергиям Гиббса растворения/сольватации в водно-органических смесях
- •1.4. Литературные данные по энтальпиям растворения в водно-органических смесях
- •1.5. Методы расчета термодинамических функций растворения в смешанных растворителях
- •1.5.1. Методы расчета термодинамических функций сольватации в водно-органических смесях
- •1.5.2. Расчет термодинамических функций сольватации методами компьютерного моделирования
- •Постановка задачи
- •2. Экспериментальная часть
- •2.1 Реактивы
- •2.2. Измерение коэффициентов активности при предельном разбавлении
- •2.3. Измерение энтальпий растворения
- •3. Результаты и обсуждение
- •3.2. Сольватация бензола в водно-органических смесях
- •3.3. Молекулярно-динамическое моделирование сольватации в водно-органических смесях
- •Основные результаты и выводы
- •Список использованной литературы
1.1.2. Энтальпия растворения и сольватации
Получить экспериментальные данные по энтальпиям растворения можно двумя путями:
Прямое определение теплового эффекта при растворении определенного количества вещества в таком количестве растворителя, что образующийся раствор можно принять бесконечно разбавленным и его разбавление не приводит к заметным тепловым эффектам. Энтальпия растворения в этом случае будет равна:
![]() ,
(17)
,
(17)
где Q – теплота, выделяющаяся или поглощаемая при растворении навески или заданного объема вещества; n, M, m, Vm и V – количество, молярная масса, масса навески, мольный объем и объем растворяемого вещества, соответственно.
Для определения тепловых эффектов могут использоваться различные методики. Основными являются: добавление растворяемого вещества посредством разбиения ампулы с ним, находящейся в растворителе, и постепенное добавление раствора или чистого жидкого вещества из микрошприца (титрование).
Определение энтальпии по температурной зависимости энергии Гиббса растворения. Согласно определению энергии Гиббса в закрытой системе,
![]() .
(18)
.
(18)
При постоянном давлении производная энергии Гиббса по температуре равна энтропии процесса с обратным знаком:
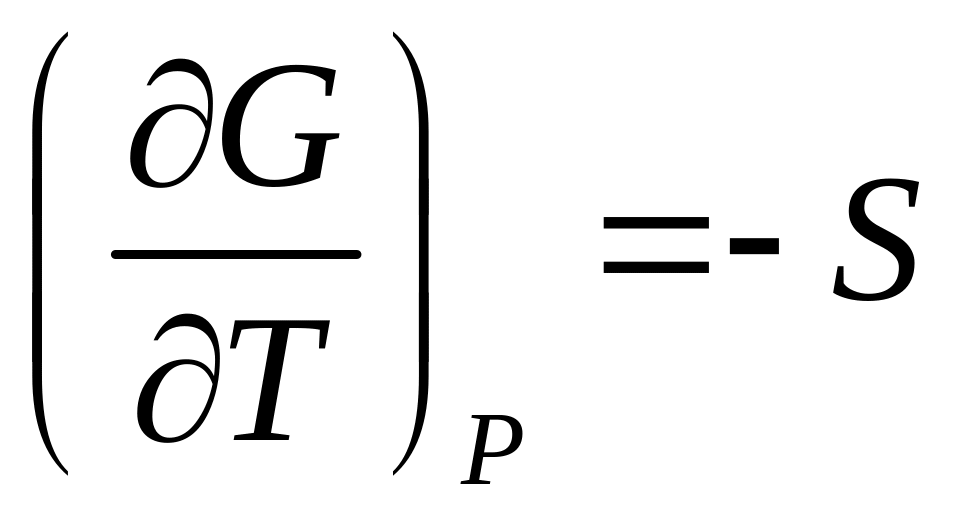 .
(19)
.
(19)
Энтальпию растворения можно рассчитать по уравнению:
 .
(20)
.
(20)
Данный подход часто используется для соединений с чрезвычайно низкой растворимостью или газообразных веществ, когда прямое калориметрическое определение невозможно.
1.2. Соотношения между энергией Гиббса и энтальпией сольватации. Сольвофобные эффекты
Помимо соотношений, вытекающих из начал термодинамики, для описания связи между различными физическими величинами часто используют так называемые экстратермодинамические соотношения. Их нельзя обосновать строго теоретически, но они хорошо описывают экспериментально измеряемые величины. Примером таких соотношений является уравнение Гаммета, которое связывает скорость реакции со структурой соединения.
Для многих физических и химических
процессов установлено существование
энтальпийно-энтропийной компенсации
[8]. Суть этого явления заключается в
наличии линейной (в редких случаях
нелинейной) зависимости между энтальпией
и энтропией (либо энергией Гиббса)
процесса. Было установлено, что энтропия
и энергия Гиббса сольватации линейно
коррелируют с энтальпией сольватации
различных соединений в неассоциированных
растворителях, и эта зависимость
описывается общим эмпирическим
уравнением![]() (21) [9].
(21) [9].
Для ассоциированных же растворителей
было показано наличие отклонения от
корреляции в сторону более положительных
значений энергии Гиббса. Таким образом,
самоассоциация приводит к понижению
растворимости – сольвофобному эффекту,
а величину отклонения можно считать
его количественной характеристикой.
Положение точек на графике
![]() против
против
![]() для растворов трет-бутилхлорида в
различных растворителях показано на
рисунке 1 [10]. Самое большое отклонение
наблюдается в случае воды (гидрофобный
эффект).
для растворов трет-бутилхлорида в
различных растворителях показано на
рисунке 1 [10]. Самое большое отклонение
наблюдается в случае воды (гидрофобный
эффект).
Гидрофобные и сольвофобные эффекты
обуславливают плохую растворимость
неполярных соединений в ассоциированных
средах и аномально низкие значения
энтропий растворения, обеспечивают
возможность образования супрамолекулярных
агрегатов, в том числе мицелл, и везикул
из амфифильных молекул, оказывают
большое влияние при 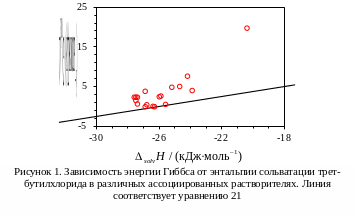 формировании
третичной структуры белков и нуклеиновых
кислот. При добавлении к воде органических
растворителей гидрофобный эффект
ослабляется, что приводит, в частности,
к денатурации белков и разрушению
мицелл. Важнейшей задачей является
сравнение и количественная характеристика
способности различных органических
веществ к подавлению гидрофобного
эффекта. Из вышесказанного понятно, что
такое сравнение может быть основано на
величинах термодинамических функций
растворения малополярных веществ в
водно-органических смесях с различным
содержанием воды. Однако имеющиеся в
литературе данные довольно скудны. Ниже
мы рассмотрим состояние экспериментальных
исследований разбавленных растворов
в водно-органических смесях более
подробно.
формировании
третичной структуры белков и нуклеиновых
кислот. При добавлении к воде органических
растворителей гидрофобный эффект
ослабляется, что приводит, в частности,
к денатурации белков и разрушению
мицелл. Важнейшей задачей является
сравнение и количественная характеристика
способности различных органических
веществ к подавлению гидрофобного
эффекта. Из вышесказанного понятно, что
такое сравнение может быть основано на
величинах термодинамических функций
растворения малополярных веществ в
водно-органических смесях с различным
содержанием воды. Однако имеющиеся в
литературе данные довольно скудны. Ниже
мы рассмотрим состояние экспериментальных
исследований разбавленных растворов
в водно-органических смесях более
подробно.
