
- •Магсумов тимур ильнурович
- •Зависимости термодинамических функций сольватации неполярных соединений от состава водно-органических смесей
- •Содержание
- •Введение
- •1. Литературный обзор
- •1.1. Термодинамические функции растворения и сольватации
- •1.1.1. Энергия Гиббса растворения и сольватации
- •1.1.2. Энтальпия растворения и сольватации
- •1.2. Соотношения между энергией Гиббса и энтальпией сольватации. Сольвофобные эффекты
- •1.3. Литературные данные по энергиям Гиббса растворения/сольватации в водно-органических смесях
- •1.4. Литературные данные по энтальпиям растворения в водно-органических смесях
- •1.5. Методы расчета термодинамических функций растворения в смешанных растворителях
- •1.5.1. Методы расчета термодинамических функций сольватации в водно-органических смесях
- •1.5.2. Расчет термодинамических функций сольватации методами компьютерного моделирования
- •Постановка задачи
- •2. Экспериментальная часть
- •2.1 Реактивы
- •2.2. Измерение коэффициентов активности при предельном разбавлении
- •2.3. Измерение энтальпий растворения
- •3. Результаты и обсуждение
- •3.2. Сольватация бензола в водно-органических смесях
- •3.3. Молекулярно-динамическое моделирование сольватации в водно-органических смесях
- •Основные результаты и выводы
- •Список использованной литературы
3.2. Сольватация бензола в водно-органических смесях
Бензол обладает большей растворимостью в воде, чем октан и толуол. Зависимости определенных нами и приведенных в литературе [17, 18, 41, 48–50] термодинамических функций сольватации бензола от состава водно-органической смеси приведены на рисунке 12.
Поведение термодинамических функций сольватации бензола в выбранных растворителях аналогично приведенным выше для толуола в смесях воды с ацетоном и тетрагидрофураном, но не с ацетонитрилом. Здесь также наблюдается нелинейность энергии Гиббса сольватации от состава растворителя, максимумы энтальпии при низких концентрациях органического сорастворителя и постоянство энтропии в смесях различного состава. Более высокая растворимость бензола в воде позволяет отследить данные закономерности при больших концентрациях воды.
Для энергии Гиббса сольватации зависимость наиболее близка к линейной в смеси воды с метанолом, который больше других растворителей «похож» на воду по размеру. Отклонения максимальны для трет-бутанола и достигают 7 кДж/моль (в 30% растворе). По всей видимости, имея разветвлённый углеводородный радикал, трет-бутанол оказывается более склонен к предпочтительной сольватации неполярного углеводорода, и его концентрация в окружении бензола значительно больше, чем в объеме раствора. Наиболее выраженные максимумы энтальпии сольватации проявляются в смесях воды с изопропанолом и трет-бутанолом. Для смеси N-метилформамид-вода максимума не удалось достигнуть из-за низкой растворимости бензола в этом растворителе и невозможности проведения калориметрического эксперимента в растворе с мольной долей воды выше 0.7. Для энтропии сольватации в смесях воды с изопропанолом и трет-бутанолом, как и с тетрагидрофураном, наблюдается рост при низких концентрациях органического сорастворителя.
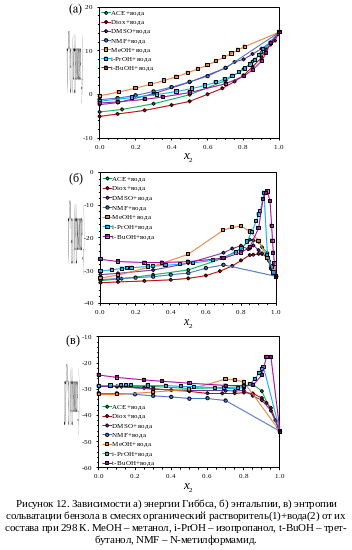
При рассмотрении графика против для водно-органических смесей в довольно широком диапазоне составов отклонения от корреляции, описываемой уравнением 21, невелики, и лишь при концентрациях воды порядка 0.8-0.95 мольных долей наблюдается существенное отклонение от прямой (рис. 13). Поскольку отклонения от этой корреляции интерпретируются [9] как следствие гидрофобных и сольвофобных эффектов, то можно заключить, что наиболее сильно из изученных растворителей гидрофобный эффект подавляет трет-бутанол: всего 0.05 мольных долей достаточно для его полного нивелирования. Это может быть связано с микрогетерогенностью водных растворов трет-бутанола [79], который агрегируется в кластеры при низких концентрациях, что может приводить к предпочтительной сольватации неполярных соединений этими кластерами.
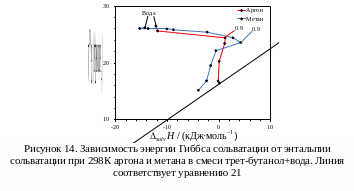
П роцесс
сольватации небольших неполярных
молекул аргона [11] и метана [12] имеет
также нелинейный вид графика
–
(рис. 14).
роцесс
сольватации небольших неполярных
молекул аргона [11] и метана [12] имеет
также нелинейный вид графика
–
(рис. 14).
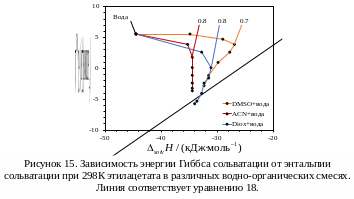
 Вид
графиков
–
для полярных веществ, например, этилацетата
[19], который может образовывать водородные
связи за счет акцепторного атома
кислорода (рис. 15), или молекулы
лекарственных препаратов напроксена
[57] и фенацетина [27] (рис. 16), часто
оказывается аналогичным, поскольку
гидрофобный эффект проявляется для
любых молекул, растворенных в воде
[9]. Стоит отметить, что скачки на графике
16 связаны с недостаточной точностью
определения энтальпии из температурной
Вид
графиков
–
для полярных веществ, например, этилацетата
[19], который может образовывать водородные
связи за счет акцепторного атома
кислорода (рис. 15), или молекулы
лекарственных препаратов напроксена
[57] и фенацетина [27] (рис. 16), часто
оказывается аналогичным, поскольку
гидрофобный эффект проявляется для
любых молекул, растворенных в воде
[9]. Стоит отметить, что скачки на графике
16 связаны с недостаточной точностью
определения энтальпии из температурной
 зависимости
растворимости.
зависимости
растворимости.
